青蒿素衍生物DHA/ARTS诱导肾癌细胞系786-0发生铁死亡的机制
黄成丽 林芳荣 李根 王忠玲 王雪娇
(海南医学院第一附属医院门诊部,海南 海口 570145)
新药青蒿素(Artemisinin,ART)及其衍生物双氢青蒿素(Dihydroartemisinin,DHA)和青蒿琥酯(artesunate, ARTS)的药物使用是当前的热点问题,已经被美国食品与药物管理局(Food and Drug Administration,FDA)批准,既往研究多集中于ART在铁离子调控方面,因而曾被称为“铁离子依赖性凋亡”药物,即“铁死亡”[1]。并且,随着铁死亡概念的提出及深入研究,逐渐证实ART及洐生物所诱导的多种恶性肿瘤细胞发生的死亡方式主要就是铁死亡。有研究[2]表明,不饱和脂肪酸DHA通过铁死亡强烈抑制急性髓细胞白血病(Acute inyeloid leukemia,AML)细胞系的活性。也有研究[3]表明,DHA通过Fork head box protein M1(FOXM1)介导导致头颈癌细胞系细胞周期停滞,特异性地通过引发铁蛋白沉积症并导致头颈癌细胞发生铁死亡。ART的卵巢癌细胞增殖作用与几种关键细胞周期调节蛋白[包括周期素D3(cyclinD3),转录因子E2F-1和细胞周期蛋白依靠性激酶抑制剂p21]的表达改变以及雷帕霉素信号传导的机制靶标的抑制有关。较高浓度的ART处理卵巢癌细胞后,可以导致活性氧(Reactive oxyge species,ROS)依赖性DNA损伤并导致铁死亡[4]。但是,ART是否能诱导肾癌细胞发生铁死亡,以及诱导肾癌细胞发生铁死亡的具体机制尚不清楚。因此,本研究探讨ART及其衍生物DHA和 ARTS对肾癌细胞系786-0的作用以及对其诱导铁死亡的机制,以期为临床上肾癌的治疗提供新的思路和方法。
1 材料与方法
1.1 DHA/ARTS作用786-0肾癌细胞系检测细胞存活率 786-0细胞正常培养至对数生长期,细胞用0.25%胰蛋白酶消化,计数,调整细胞密度为1×104/孔,接种于96孔板。摇匀细胞后将96孔板置于37℃,5%CO2培养箱中培养24 h。将细胞分为对照组(DMSO组)[加入1‰DMSO(二甲基亚砜)]、DHA组(加入5、10、20、50 μM DHA)、ARTS组(加入5、10、20、50 μM ARTS)、DHA+DFO组(加入5、10、20、50 μM DHA+20 μM DFO)、DHA+Fer-1组(加入5、10、20、50 μM DHA+20 μM Fer-1)、ARTS+DFO组(加入5、10、20、50 μM ARTS+20 μM DFO)、ARTS+Fer-1组(加入5、10、20、50 μM ARTS+20 μM Fer-1)。将96孔板置于5%CO2,37℃培养箱中继续培养48 h。取出96孔板,吸弃原培养液,然后在每孔加入CCK-8试剂为10 μL,终培养液为100 μL,培养箱中继续培养45 min后在450 nm处检测吸光度(OD)值。将处于对数生长期的786-0细胞用0.25%胰蛋白酶消化,计数,调整细胞密度为5×104/孔,接种于24孔板。倒置显微镜观察细胞杀伤情况并拍照。
1.2 细胞内活性氧化物检测 分组后用于荧光拍照的孔板细胞药物作用24 h,后续用于流式检测的细胞药物作用12 h,作用时间后,弃去培养基,PBS洗3次。用含有10 μM DCFDA的无酚红培养基细胞染色1 h。PBS洗去多余的DCFDA。然后用荧光显微镜观察荧光强度并拍照或者流式细胞仪检测。
1.3 RNA提取,反转录及RT-qPCR 收集预先处理好的786-0细胞,用PBS轻柔清洗2次,每孔加入500 μL Trizol裂解5 min,将细胞吹下收集至1.5 mL离心管。离心管中加入100 μL氯仿,充分混合并剧烈震荡15 s。4℃,12000 g离心15 min,小心吸取水相上清200 μL转移至一新1.5 mL离心管,弃乙醇,空气中干燥。加入适量的无核酶水溶解RNA,并测浓度。按试剂盒说明,配置每20μL逆转录体系中包含20 μL逆转反应混合物,1 μg RNA及水。反应条件为:65℃ 5 min,冰上2 min,25℃ 5 min,50℃ 45 min,85℃ 2 min,降温至4℃。cDNA可稳定保存于-20℃。按照实验目的,计划Q-RT-PCR实验方案,并配置反应体系。
1.4 细胞蛋白质提取和检测 用含1%脱脂牛奶的TBST缓冲液室温封闭PVDF膜2 h,TBST洗膜5 min,再将膜与特异性一抗4℃摇床孵育过夜。TBST洗膜3次,每次10 min,再将膜与特异性二抗室温孵育1 h。TBST再次洗膜3次,每次10 min。加ECL显影液,用Bio-Rad ChemiDoc XRS+化学发光成像系统检测发光情况。用Bio-Rad ChemiDoc XRS+化学发光成像系统检测发光情况。
1.5 构建pmCherry-EGFP-FTH1质粒 FTH1开放阅读框插入mCherry-GFP质粒。准备好生长状态良好的细胞,用适量生理盐水洗涤细胞2~3次。质粒提取试剂盒(南京Vazyme Biotech公司),分散将蛋白裂解液均匀滴加入培养皿内,再用干净的细胞刮刀将细胞刮于培养皿的一侧,然后利用移液枪将细胞碎片和裂解液的混合物转移到1.5 mL的EP管内。利用超声波细胞破碎仪对混合物超声3~5次,然后在冰盒内静置10 min。按说明书用质粒提取试剂盒提取,并保留部分菌液,质粒送测序。待测序结果正确,挑取剩余菌液接种到3 mL培养基中,摇床过夜。提取质粒,并标记好质粒浓度。
1.6 细胞转染 将786-0细胞接种到孔板中,待细胞生长至70%左右融合度时进行转染。按照Lipofectamine RNAi MAX说明书并稍加改进进行操作,转染RNA试剂时:A管:lipo RNAi MAX 7.5 μL,opti-MEM培养基将总体积稀释至100 μL,混匀B管:siRNA,opti-MEM培养基将总体积稀释至100 μL,A、B两管室温静置5 min;将B管中的液体全部加入A管中混匀,室温静置15 min。然后为待转染细胞换液,将250 μL混合液加入细胞培养基中继续进行培养。待达到合适的转染时间后可进行后续实验。转染质粒时,按照Lipofectamine LTX Reagent说明书并稍加改进进行操作,待达到合适的转染时间后可进行后续实验。
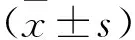
2 结果
2.1 DHA/ARTS作用786-0细胞形态和CCK-8分析 786-0细胞系在DHA和ARTS作用后,从显微镜观察和CCK-8检测,显示细胞发生了明显死亡,并且随着药物浓度的增大存活细胞数越少。而且由DHA和ARTS所产生的致死作用可以被铁死亡抑制剂DFO和Fer-1所抑制。见图1。

图1 DHA和ARTS作用786-0细胞后细胞活力
2.2 DHA/ARTS可增加786-0细胞内ROS水平 DHA和ARTS作用下786-0细胞内ROS的荧光强度明显高于对照组(q=2.894,2.342;P<0.05)。在铁死亡抑制剂DFO和Fer-1干预下,DHA+DFO组、DHA+ Fer-1组、ARTS+DFO组、ARTS+ Fer-1组786-0细胞内ROS的荧光强度明显低于DHA组和ARTS组(P<0.05)。见图2。
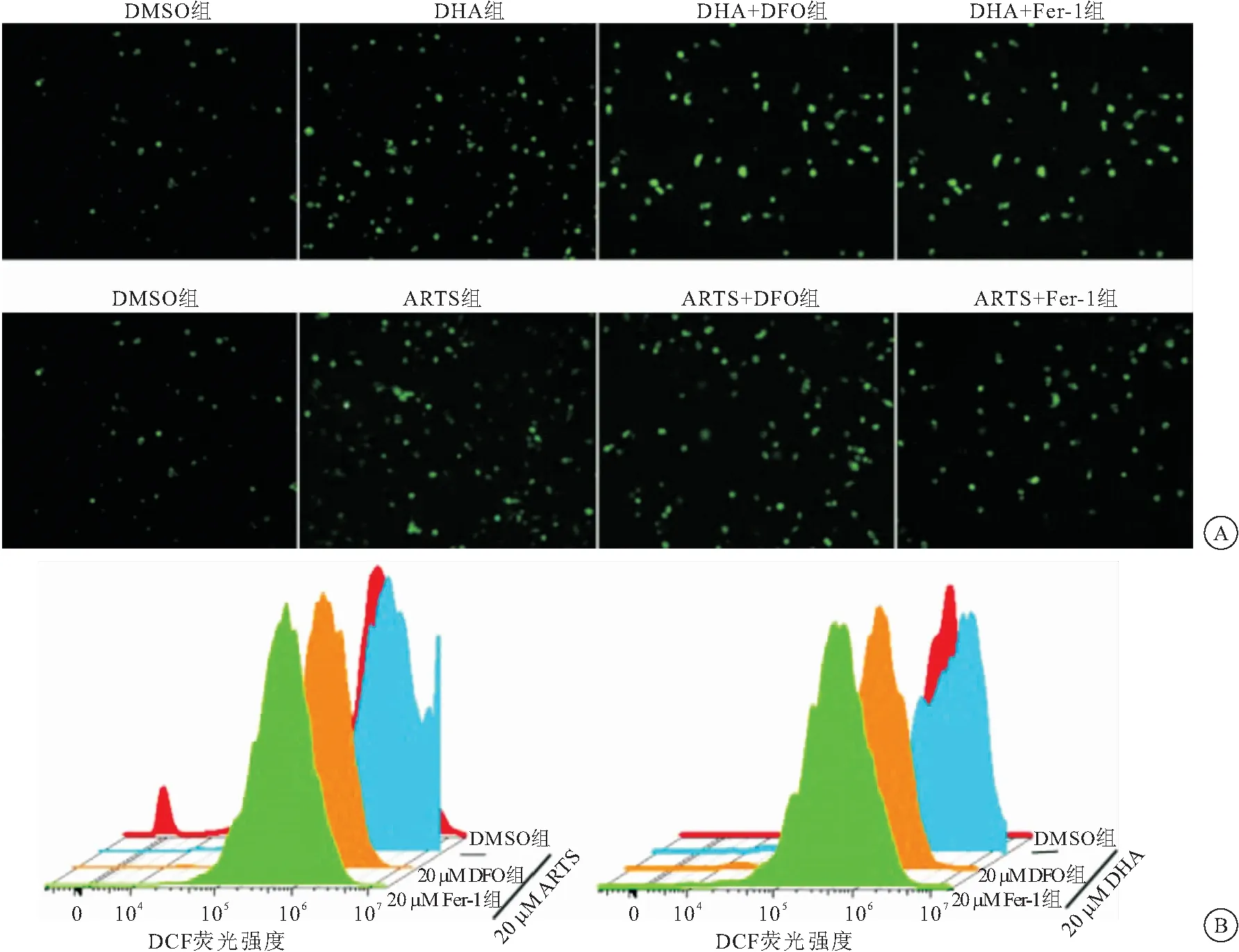
图2 DHA和ARTS升高786-0细胞内ROS水平
2.3 DHA/ARTS作用786-0细胞NCOA4和FTH1蛋白变化 DHA/ARTS作用786-0细胞,细胞内NCOA4和FTH1水平下降具有一致性,且蛋白下降具有药物时间依赖性,见图3。
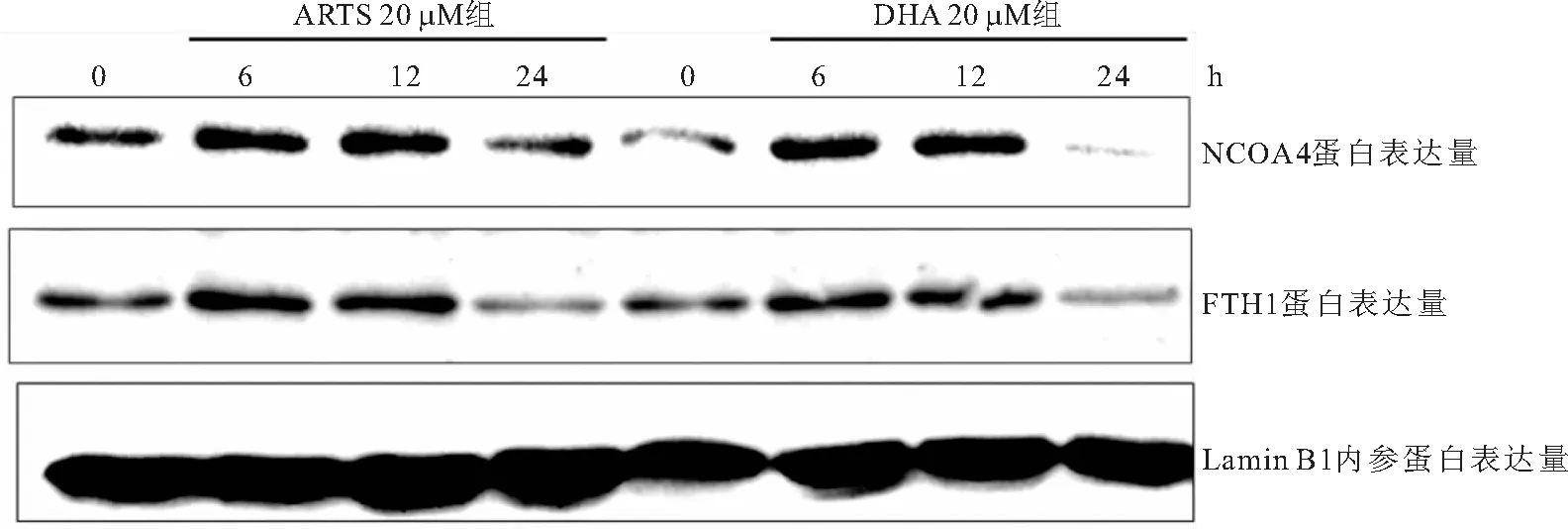
图3 DHA/ARTS降低NCOA4/FTH1的蛋白水平具有时间依耐性
2.4 敲减NCOA4可抑制DHA和ARTS对于786-0细胞作用 结果显示,si-NCOA4 2#和si-NCOA4 3#转染786-0细胞后,细胞内NCOA4的mRNA相对表达量和蛋白的相对表达量明显低于对照组(P<0.05)。CCK-8结果显示,si-NCOA4 2#和si-NCOA4 3#转染786-0细胞后,细胞的增殖率明显高于对照组(P<0.05),且si-NCOA4 3#组细胞增殖率明显高于si-NCOA4 2#组(P<0.05)。见图4。
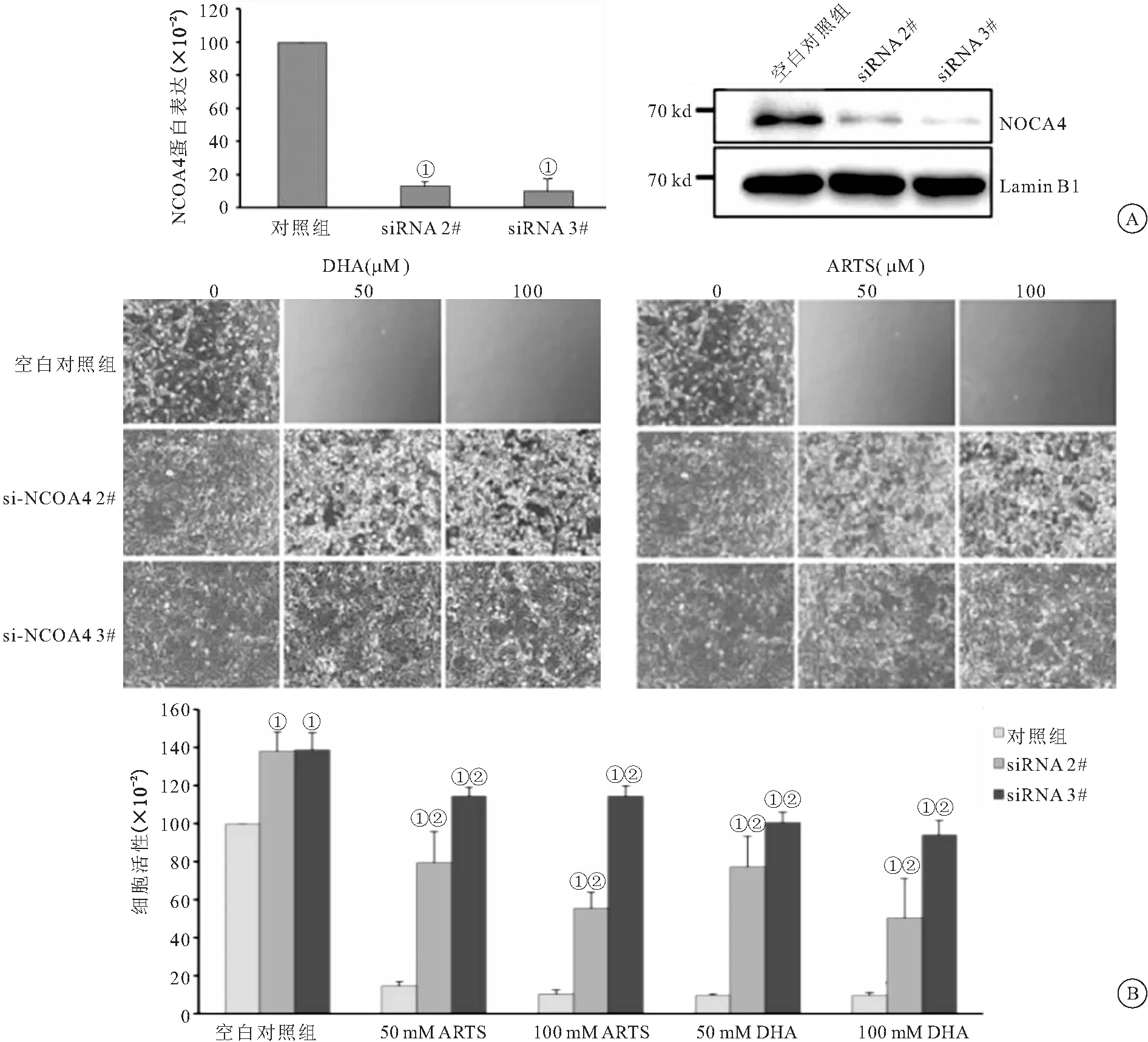
图4 敲减NCOA4可抑制DHA和ARTS对于786-0细胞作用
2.5 DHA/ARTS可增加FTH1自噬降解 结果显示,当没有自噬发生时,显示黄色荧光,当自噬发生,黄色荧光减少,红色荧光增多,且红色荧光强度可反映自噬水平。在DHA和ARTS作用之后黄色荧光减少,红色荧光明显增多,反映了DHA增加了FTH1的自噬水平而发生铁死亡作用(见图5)。从自噬结果来看,DHA组和ARTS组的细胞自噬率明显高于对照组(P<0.05),且50 μM的DHA和ARTS组细胞的自噬率明显高于20 μM的DHA和ARTS组(P<0.05)。在siRNA-NCOA4沉默NCOA4表达后,细胞自噬率明显降低(P<0.05)。见图6。

图5 DHA/ARTS作用细胞后FTH1自噬情况检测(50×)
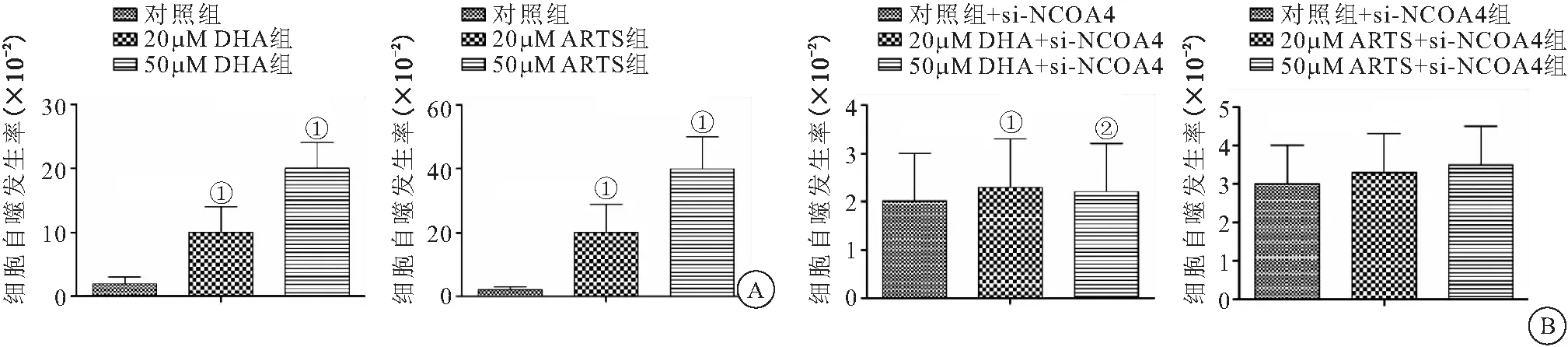
图6 细胞自噬发生率
3 讨论
自2012年Dixon等[5]在小分子化合物Erastin处理RAS基因突变的人纤维肉瘤细胞系HT-1080细胞时,发现一种新的具有铁离子依赖性的细胞死亡方式,并命名为铁死亡以来,有大量关于铁死亡的研究被发表。在药物研究方面,研究者发现如索拉非尼、柳氮磺胺吡啶、盐霉素、顺铂、青蒿素等[6-7]药物均能诱导铁死亡的发生。本研究显示青蒿素衍生物双氢青蒿素和青蒿琥酯可以诱导786-0肾癌细胞系内ROS水平增高,诱发肾癌细胞铁死亡。在肾癌化疗药物耐药性高,化疗效果不理想的情况下,这一发现对肾癌的药物治疗提供了一种新的可能性。
在铁死亡机制研究中,除了胱氨酸/谷氨酸逆向转运体和谷胱甘肽过氧化物酶4这两条非常经典的通路外,研究者还发现了p53、Nrf2、ATF4等[8-9]相关通路都和铁死亡有着密切的联系。而这些通路最终都影响细胞内ROS的代谢,导致ROS的聚积,而发生铁死亡。Lee等[10]发现NCOA4分子可以介导铁结合蛋白的进入溶酶体而发生蛋白自噬性降解,从而增加细胞内游离的Fe2+,而导致细胞发生铁死亡,这种方式也被称之为铁自噬性铁死亡。本研究结果和之前的研究结果相似,通过siRNA技术沉默NCOA4的表达,进而抑制铁死亡的发生。此外,在mCherry系统中发现,FTH1在DHA/ARTS作用下,发生了自噬性降解。这些都说明DHA和ARTS可以通过NCOA4/FTH1信号通路诱导肾癌细胞通过介导铁结合蛋白自噬性降解而发生铁自噬性铁死亡。
青蒿素是我国著名药学家屠呦呦教授首次发现并从黄花蒿中提取出来的活性成分,因其有效的抗疟作用,挽救了数百万人的生命。近年来,青蒿素及双氢青蒿素、青蒿琥酯等洐生物的抗肿瘤作用也逐渐成为化疗药物研发领域的热点[10-11]。现有研究表明,青蒿素及其衍生物抗肿瘤谱广,在体内外研究中,显示了对肺癌、卵巢癌、肝癌、膀胱癌、白血病等等肿瘤都其作用[12-16]。而其发挥抗肿瘤作用的机制复杂,包括干扰细胞周期,抑制肿瘤增殖;抑制肿瘤细胞侵袭和转移;诱导肿瘤细胞内质网应激和凋亡;增加细胞内氧化应激水平;诱导DNA损伤;诱发铁死亡。青蒿素及其等洐生物还能增加肿瘤细胞对化疗药物敏感性,增强化疗药物抗肿瘤疗效[17-18]。本研究通过检测肾癌细胞中ROS的表达发现,在DHA和ARTS作用786-0细胞,其细胞内ROS明显升高,并且其致ROS升高的作用,可被铁死亡抑制剂DFO和Fer-1所抑制。分析其原因,可能是DHA和ARTS可以通过NCOA4/FTH1信号通路激活细胞内ROS的激活,铁死亡主要是胞内脂质活性氧生成与降解的平衡失调所致,当细胞抗氧化能力降低,脂质活性氧堆积,就能引起细胞氧化性死亡。可见ROS的大量累积是铁死亡发生的重要因素。
本文仍存在一定局限性:首先,本研究尚未验证DHA和ARTS-NCOA4及FTH1通路中是否存在GPX4的调控,这将是本研究课题今后的延伸方向;其次,研究缺少能够直接提示铁死亡水平的标记物,缺少动物实验加以验证研究结果的准确性。
4 结论
青蒿素衍生物DHA和ARTS可诱导786-0肾癌细胞系发生铁死亡,其致铁死亡的发生是通过NCOA4介导FTH1特异性自噬降解而实现。本研究揭示了青蒿素衍生物DHA/ARTS诱导肾癌细胞系发生了铁死亡,并探讨了其发生机制,具有一定的临床意义。

