燃煤加氯影响烟气中汞形态转化规律及汞-氯反应机理的研究
傅静雯,仲兆平,许月阳1,,3,薛建明,朱法华,黄佳伟,徐元强,林正根
(1.国家能源集团科学技术研究院有限公司,江苏 南京 210046;2.东南大学能源与环境学院,江苏 南京 210096;3.清洁高效燃煤发电与污染控制国家重点实验室,江苏 南京 210046)
1 引言
随工业化进程的加快,化石能源的大量利用,特别是煤炭的燃烧,使得大量的汞污染物不断向大气中排放。化石燃料燃烧会导致60%的人为源汞释放[1-2]。由于汞具有生物毒性以及生物累积性,近年来燃煤烟气中汞的排放与控制受到了极大的关注。研究显示,我国对燃煤产生的汞及其控制一直处于较弱的水平[3-5]。大量含汞物质,通过各种途径进入大气或水体中,产生严重的环境污染问题,而汞难以降解,导致它们在自然环境中长期存在,并通过食物链富集威胁人类的身体健康。因此,控制汞污染应当引起人们的关注。
在燃煤烟气中,汞主要以气态元素汞(Hg0)、气态氧化态汞(Hg2+)和颗粒态汞(Hgp)的形式存在[6],相关研究结果表明通过现有的污染控制设备可以容易且有效地脱除氧化态汞和颗粒态汞[7]。而Hg0具有高挥发性、低水溶性等特点,能以相对稳定的形态存在于燃煤烟气中,难以通过现有污染控制设备进行脱除。因此,Hg0的脱除成了燃煤烟气脱汞需要克服的难点[8]。由于通过现有污染控制设备可以对氧化态汞实现有效脱除,因此如何经济高效地将Hg0转化为Hg2+成了提高脱汞效率的突破点。
现有研究表明,氯元素对Hg0的氧化和转化具有重要的促进作用[9-10]。但关于煤中氯质量分数对汞形态转化影响的理论研究和实验尚有不足,已有的数据很难进行汞-氯反应机理的深入理解。根据热力学平衡方程,在给定温度、压力和系统组成下,当系统的总吉布斯自由能达到最小时,整个系统处于热力学平衡状态,达到了反应的最终态,系统由热力学稳定的相和化学组分构成[11-13]。目前,量子化学是计算分子几何构型和能量的最精确的理论方法[14],其中密度泛函方法适用于不同类型的化学计算[15],并在处理多电子体系时是一种比较有效的方法,且可以处理有机金属体系和过渡金属体系并在计算过程中进行简单的相对论校正[16]。
量子化学从原子反应的根本途径出发,应用经典过渡态理论可以模拟计算基元反应、指前因子以及活化能等参数。汞氧化的动力学计算最早是由Horne等人[17]提出,随着实验方法的不断发展以及科学测定手段的进步,近年来的研究有了突出的发展。Widmer等人[18]首次建立了汞-氯化学动力学模型,其主要包括8个基元反应,但其模型中的动力学参数还是比较粗糙。Edwards等人[19]提出了新的汞化学动力学模型,包括汞氧化机理,还包括氯化反应以及汞氧化为氧化汞的途径。本研究首先利用化学热力平衡方程模型研究了煤及煤加不同质量分数氯在燃烧过程中汞形态随温度升高的变化,并采用管式炉热解试验台,研究了煤及煤添加不同质量分数氯在燃烧过程中汞形态随温度升高的变化。最后利用量子化学计算软件(Materials Studio)研究了汞-氯反应过程及其机理,并计算了反应过程中的能量变化及其反应动力学参数,这不仅为进一步研究燃煤烟气中汞排放的氧化控制动力学模型打下了坚实的理论基础,而且还具有重大的实践指导意义。
2 模拟与实验
2.1 热力学计算方法与输入条件
(1)计算方法
利用热力学计算软件进行热力学模拟,分析煤中汞在不同条件下的存在形式。在计算过程中,首先假设整个体系是一个封闭的、理想的体系,当系统平衡时,其总吉布斯自由能最小。系统的总吉布斯能为该体系内所有组分的自由能之和,而在系统中的每一个化学组分都拥有一个化学势,代表单位摩尔组分具有的自由能。通过计算总吉布斯自由能最小时系统的平衡状态,即可得到各化学组分对应的摩尔分数。
(2)输入条件
如表1所示,基于煤质分析和燃煤灰分分析结果,输入元素为Si、Al、Fe、Na、K、Ca、Mg、Ti、Hg、C、O、N、S、H、Cl。
对应于表1所示输入参数,空气过剩系数选择1.2,模拟温度范围设置为0~1500℃,压力设定为101.325kPa。
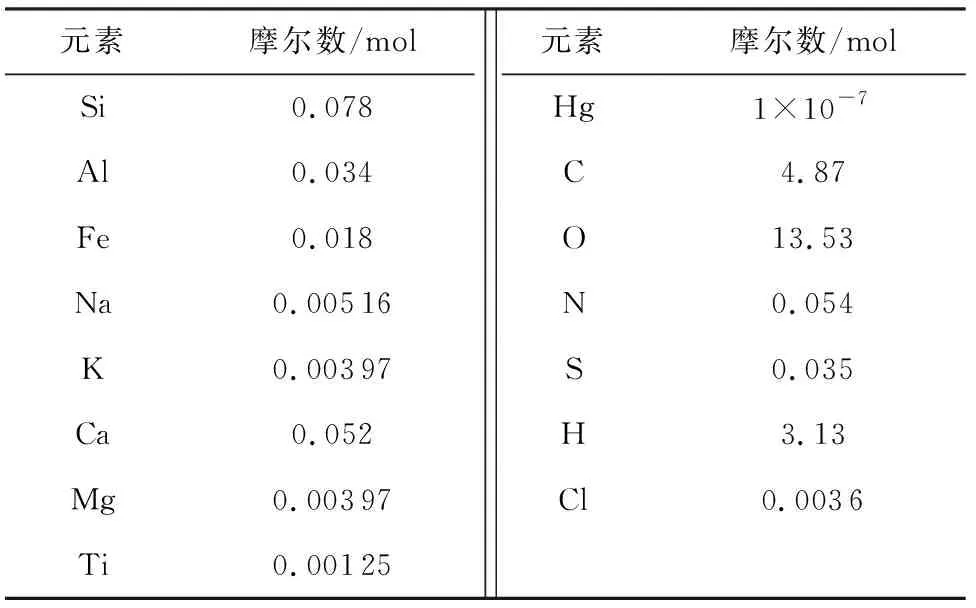
表1 热力学模拟输入参数表Tab.1 Input parameter table of thermodynamic simulation
2.2 实验材料和方法
(1)材料
实验所用原煤的元素分析和工业分析结果,具体如表2所示。
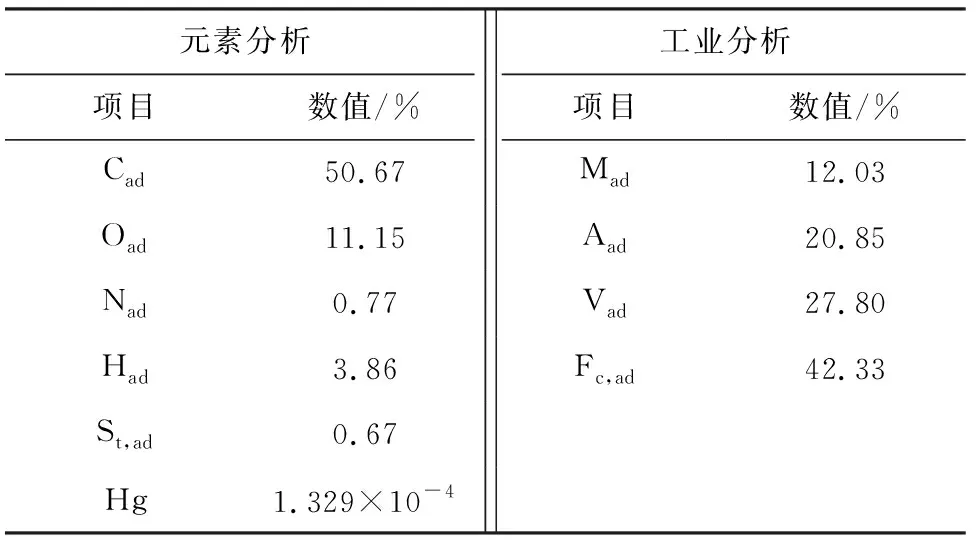
表2 燃煤元素分析及工业分析Tab.2 Element analysis and industrial analysis of coal combustion
(2)实验装置
煤及煤添加不同质量分数氯随温度升高的汞形态转化规律实验是在如图1所示的石英管式炉中进行的。管式炉管径为60mm,管长1000mm,采用硅钼棒为加热元件进行程序升温。
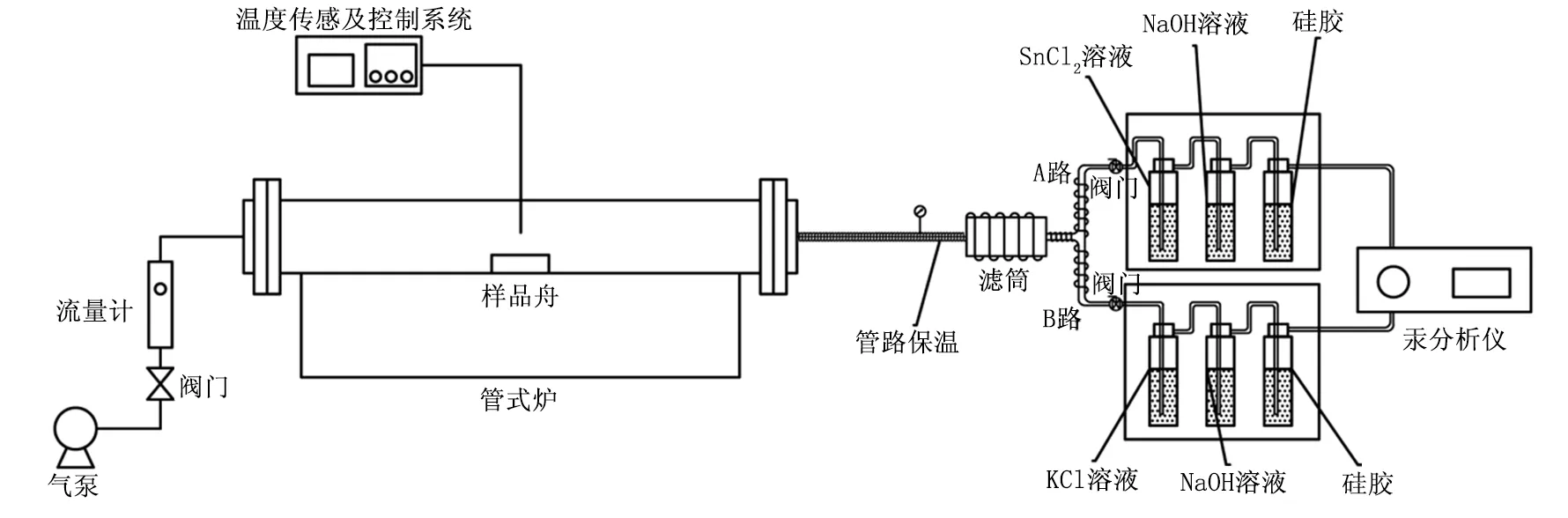
图1 管式炉实验装置示意图
实验前对煤种进行预处理:先采用破碎机进行破碎处理,后经逐级筛分至100目以下,最后在60℃干燥箱内干燥2h后放置于密封干燥皿中备用。实验中取2g煤样(精确到0.0001g)于样品舟内,平铺在样品舟底,置于反应器恒温区内。管内通入流量为3L/min的压缩空气。按照设定程序升温速率10℃/min开始实验,将炉内温度由室温升至实验温度,在升温过程中煤发生一系列的物理化学变化,烟气出口后布置滤筒,用于捕集烟气中的飞灰。
过滤后的烟气通过A、B两路。其中,A路吸收瓶包括100ml的0.1mol/L的SnCl2溶液以及NaOH溶液和100g无水硅胶,SnCl2溶液用以将烟气中的Hg2+还原为Hg0,NaOH溶液用以吸收烟气中的酸性气体,烟气中的水分被硅胶吸收。B路吸收瓶包括容积为100ml、浓度为0.1mol/L的KCl溶液以及NaOH溶液和100g无水硅胶,用以吸收烟气中的Hg2+、酸性气体和水分。经过处理后的烟气最终均流入汞测试仪VM3000,A路检测所得的值即为气态总汞Hgt,B路测得的数值为气态Hg0的浓度。为防止管路吸附部分烟气中汞,管路使用聚四氟乙烯并保持烟气出口至吸收瓶前管路温度为120℃。实验温度为1100℃,分别采用原煤以及添加了不同质量分数氯的煤样。所用含氯试剂为实验室配置模拟脱硫废水,其氯离子浓度为7000mg/L。实验时以2g煤为基础,模拟脱硫废水加入量按电厂运行工况进行等比例缩小,加氯量分别取0.3、0.6、0.9mg,其添加量分别占2g燃煤质量的0.015%、0.030%和0.045%,随后将模拟脱硫废水通过移液管加入盛有燃煤的瓷舟中。
(3)数据处理方法
在煤中汞析出过程中,烟气中汞浓度由汞测试仪实时测量并自动记录数据。实验完成后,利用Origin软件对实验数据进行整理,利用该软件自带的积分功能将汞浓度随时间变化曲线进行积分,得出对应的汞析出量。计算公式如下,无论析出总量还是瞬时析出浓度都有:
Ct=C0+C2
(1)
M=Lq
(2)
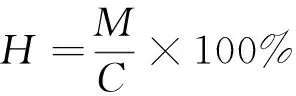
(3)
式中:Ct为气态总汞浓度,mg/m3;C0为气态零价汞浓度,mg/m3;C2为气态二价汞浓度,mg/m3;M为气态总汞的实际析出量,mg;L为管内气体流量,m3/min;q为汞浓度曲线的积分数值,mg/(m3·min);H为气态汞析出率,%;C为煤中汞的含量,mg。
2.3 量子化学计算模型与方法
计算模型上,选取密度泛函模块DFT-B3LYP(Becke型3参数密度泛函计算方法)进行计算。对于汞原子这种拥有80个电子的重金属元素,采用SDD(赝势基组)基组对其进行定义,而非金属元素如Cl、O、H等,考虑计算精度与荷电,则选用添加弥散的3-611++G(3df,3pd)(即分裂基组下叠加弥散函数)基组。
计算方法上,利用量子化学分析软件(Materials Studio)在微观水平上研究燃煤烟气中汞-氯反应机理,优化得到反应过程中各稳定点(反应物、过渡态、产物)的几何构型,并通过频率分析得出各稳定点的性质。此外,通过简振振动分析或内禀反应坐标(IRC)方法对过渡态进行确认,并在此基础上进行零点能校正,最后根据校正结果计算各反应过程所需的正逆反应活化能。此外,也根据经典过渡态理论,计算了不同温度下的动力学参数(包括指前因子和反应速率常数)。本研究在298~1500K的温度区间内进行计算,研究中所涉及的反应为:
Hg+Cl2=HgCl+Cl
(4)
Hg+HCl=HgCl+H
(5)
HgCl+HCl=HgCl2+H
(6)
3 结果与讨论
3.1 热力学模拟结果
在氧化性气氛下,0~1500℃温度范围内,煤燃烧产生烟气中汞的形态分布如图2所示。
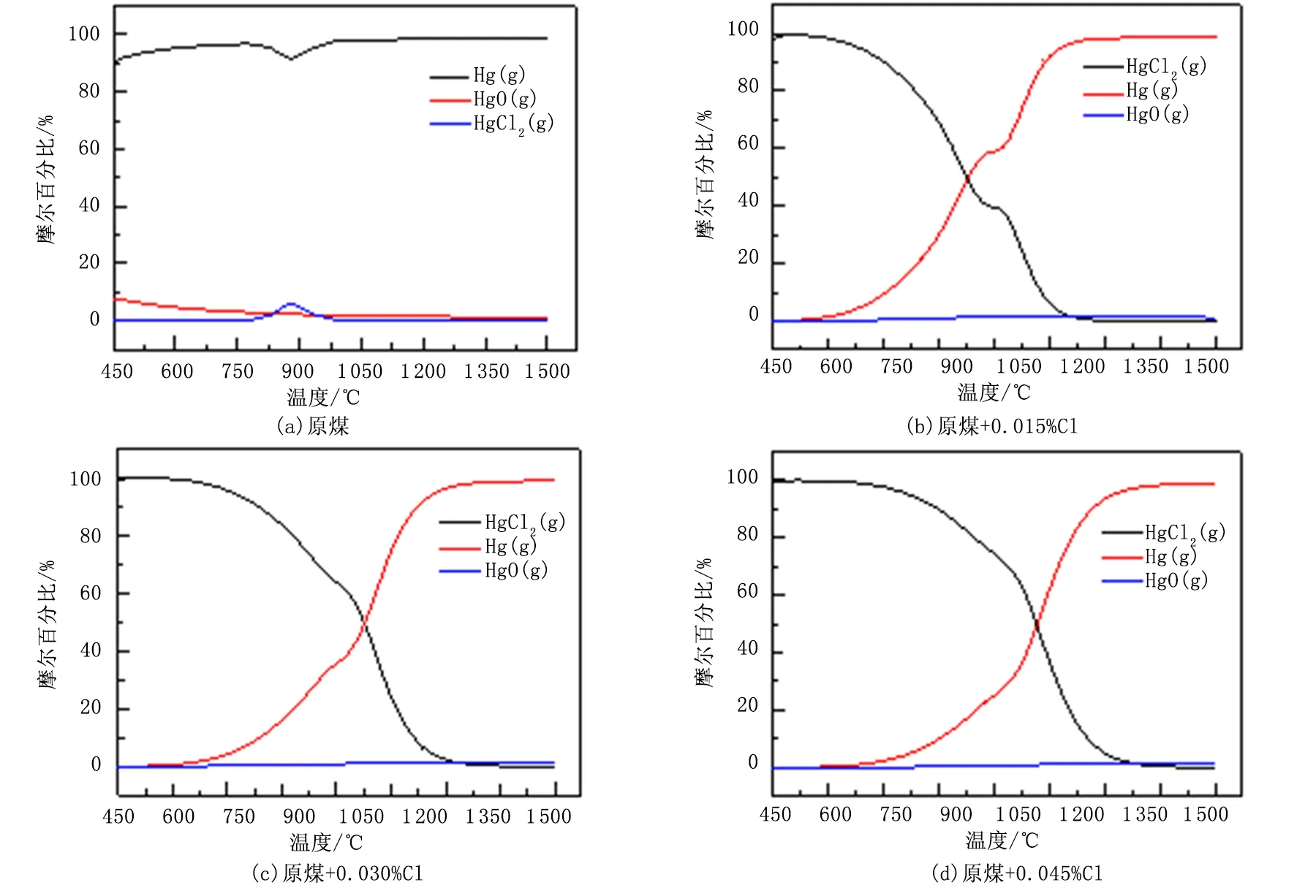
图2 气态Hg热力学形态分布
如图2(a)模拟结果所示,在模拟的温度范围内,燃煤产生的烟气中,汞的主要存在形态为零价元素汞,同时烟气中也存在较少量的氧化汞和氯化汞,元素汞的占比约为90%。在850~900℃的温度范围内,烟气中氯化汞的含量达到峰值,但仍然不足10%。燃煤烟气中零价汞比例过高,会降低烟气中汞的脱除率。向原煤中添加0.015%Cl、0.030%Cl和0.045%Cl后,模拟结果如图2(b)~2(d)所示。烟气中氯化汞的比例大大增加,表3给出了图2(b)~2(d)中氯化汞和元素汞的曲线积分面积,随着加氯量的上升,烟气中氯化汞对应的曲线积分面积增大,元素汞的曲线积分面积减小,这也从侧面反映出烟气一部分元素汞在氯的作用下氧化为氯化汞。氯添加量的增加,不仅提高了氯化汞的含量,而且氯化汞作为稳定相的范围也随之增大。据文献[20-21]报道,氯元素可以促进汞元素的释放,随着燃烧温度的降低,单质汞发生一系列化学反应生成氧化态汞化合物,同时氯元素的存在可以延缓汞的凝结。
3.2 管式炉实验结果
图3给出了由室温上升至1100℃的过程中,原煤及原煤添加不同质量分数氯后烟气中汞的析出情况。由误差分析可知,数据稳定性较好,实验结果具有可信度。

图3 原煤及原煤添加不同质量分数氯后烟气中汞的析出情况
如图3(a)所示,原煤在300℃时,汞开始析出,当温度上升至540℃时达到析出峰值,约为99μg/m3,其中16μg/m3为氧化态汞。易知,燃煤产生烟气中零价汞占据绝大部分,不利于汞的脱除,因此需要将烟气中部分零价汞氧化为氧化态汞,以便后续烟气净化装置对汞的脱除。图3(b)表明,当温度在500~700℃内时,随着温度的升高,汞的摩尔百分比逐渐增大,即煤中汞随着温度升高,大量从煤中析出。在温度700℃时,添加0.015%Cl、0.030%Cl和0.045%Cl后,煤中汞的析出率由原煤的85%上升至86.6%、89.3%和91.5%。在高温段(>700℃)下,煤中汞的析出率虽略有升高,但变化趋势并不明显,在温度1100℃时,加氯后煤中汞的析出率分别为87.1%、90.1%以及92.8%。由于燃烧温度较高,汞的挥发性得到了增加,氯元素的添加会使得汞与其生成氯化物,金属氯化态的蒸发压力通常高于氧化物,因而添加氯后汞的挥发率得到了进一步提升,且氯含量的增加使得汞更易向烟气中迁移,也能在一定程度上提高煤中汞的析出率。
如图3(c)所示,原煤在温度为300℃时汞开始析出,而添加氯后煤中汞的析出温度向高温方向移动,约为340℃时煤中汞开始析出。原煤在540℃时汞的析出浓度达到峰值,添加0.015%Cl、0.030%Cl和0.045%Cl时,煤中汞的析出峰值对应的温度均为520℃,峰值浓度由原煤的99μg/m3分别上升为101、105、107μg/m3。由图3(d)可知,1100℃下原煤燃烧后烟气中零价汞的比例为76%,其余24%为二价汞。添加0.015%Cl、0.030%Cl和0.045%Cl后,烟气中氧化态汞的比例分别上升为25.6%、27%以及27.7%,随着加氯量的增加,其对汞的氧化作用也随之增强。
向原煤中加入含氯溶液后,随着加热温度的上升,溶液中的氯元素主要以HCl的形式迁移至烟气中[22]。然后,迁移进入烟气中的HCl与烟气中的O2相互碰撞后会发生Deacon反应,进而生成H2O和Cl2[23],而Cl2具有极强的氧化性,可与烟气中汞发生的反应如下:
4HCl+O2→2Cl2+2H2O
(7)
Hg+Cl2→HgCl2
(8)
Deacon反应在低温(475℃)下才可以进行,在高温下几乎不存在Cl2,并且Hg与HCl反应的能垒较高[24],因此其反应主要通过Cl原子进行。当温度达到400~700℃时,大量的氯离子会与汞反应生成HgCl,随后HgCl与HCl反应生成HgCl2[25],这也就解释了煤中添加含氯溶液后,烟气中氧化态汞比例上升的原因。
3.3 量子化学计算结果
(1)反应过程分析
采用B3LYP方法,并结合SDD基组,对反应通道上所有驻点的几何构型进行优化,从而得到反应的微观过程,如图4~6所示。
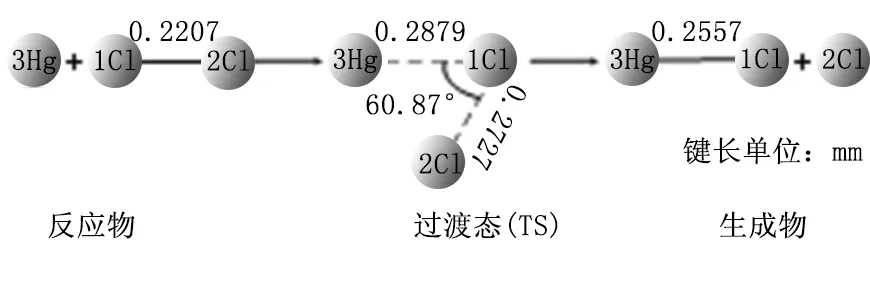
图4 Hg+Cl2=HgCl+Cl反应过程
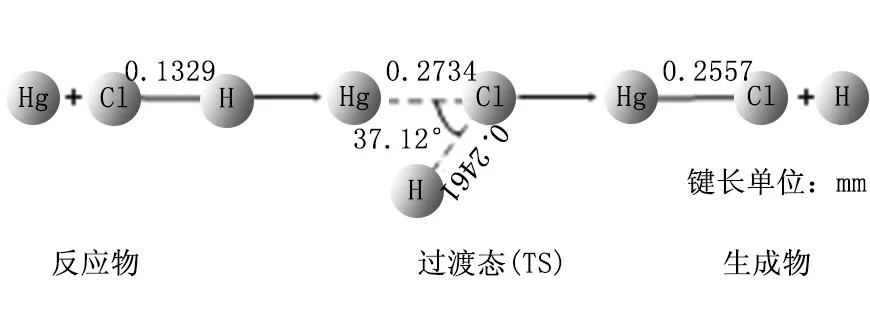
图5 Hg+HCl=HgCl+H反应过程
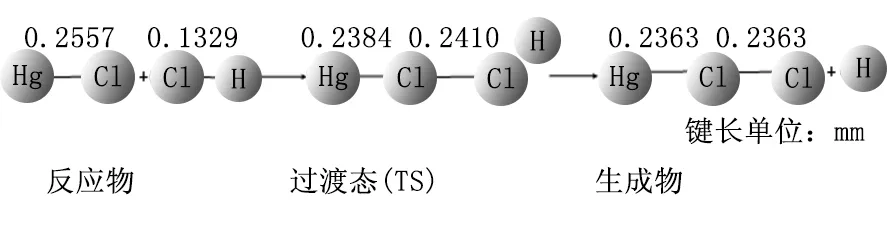
图6 HgCl+HCl=HgCl2+H反应过程
图(4)所示的过程为:Hg+Cl2→TS(HgClCl)→HgCl+Cl,即Hg与Cl2结合生成过渡态TS,最后得到产物HgCl与Cl原子。在该反应过程中,Hg-Cl键的距离逐渐减小(∝→0.2879nm→0.2557nm),最后生成稳定的HgCl,Cl-Cl键的距离逐渐增加(0.2207nm→0.2727nm→∝),最后脱离Cl原子。计算结果显示,反应物和产物的振动频率都为正值,表明它们的结构很稳定。对过渡态结构进行频率分析结果表明,其有且仅有一个虚频(-206.95cm-1),该结果表明此过渡态结构可能为图(4)所述反应的过渡态。通过对该过渡态结构进行简振振动模式分析,结果表明在该虚频振动模式下,Cl原子沿着直线,向远离Cl原子的方向有着显著的振动趋势,这种趋势的发生有利于反应的进行,表明该过渡态假设是成立的。上述分析结果表明,关于图(4)所述反应的机理的分析是合理且正确的。
图(5)所示的过程为:Hg+HCl→TS(HgClH)→HgCl+H,即Hg与HCl结合生成过渡态结构,经过一个过渡态后生成产物HgCl与H原子。在该反应过程中,Hg-Cl键的距离逐渐减小(∝→0.2734nm→0.2557nm),最后生成稳定的HgCl,Cl-H键的距离逐渐增加(0.1329nm→0.2461nm→∝),最后脱离Cl原子。计算结果表明,反应物和产物的振动频率都是正值,这可以说明它们的结构是很稳定的。通过对过渡态结构进行频率分析发现,其有且仅有一个虚频(-783.81cm-1),该结果证实了该过渡态结构可能为图(5)所示反应的过渡态。在本研究中,也对该过渡态进行内禀反应坐标分析(IRC),同时计算了图(5)所示反应从过渡态分别到达反应物和产物的最小能量路径。结果如图7(a)所示,经过IRC的反算,最终得到了Hg+HCl的结构,再对其进行几何结构优化得到反应物,坐标另一端得到HgCl+H的结构,经过几何结构优化后得到产物,因此可以确定该过渡态是可信的,所研究的反应机理是正确的。
图(6)所示的过程为:HgCl+HCl→TS(ClHgClH)→HgCl2+H,即HgCl与HCl结合生成过渡态TS,最后生成产物HgCl2与H。反应过程中,HCl中Cl与HgCl中Hg的Hg-Cl键的距离逐渐减小(∝→0.2410nm→0.2363nm),HgCl中Hg-Cl的键长逐渐缩小(0.2557nm→0.2384nm→0.2363nm),最后生成稳定的HgCl2。计算结果显示反应物和产物的振动频率均为正值,这可以说明它们的结构是很稳定的。对过渡态结构进行频率分析,该结构有且仅有一个虚频(-479.84cm-1),因此该结构可能为HgCl+HCl=HgCl2+H的过渡态。研究中对该过渡态进行内禀反应坐标分析(IRC),如图7(b)所示,最终得到了HgCl分子与HCl分子的结构,再对其进行几何结构优化即可得到反应物,坐标另一端得到HgCl2+H的结构,经过几何结构优化后得到产物,因此可以确定该过渡态是可信的,所研究的反应机理是正确的。
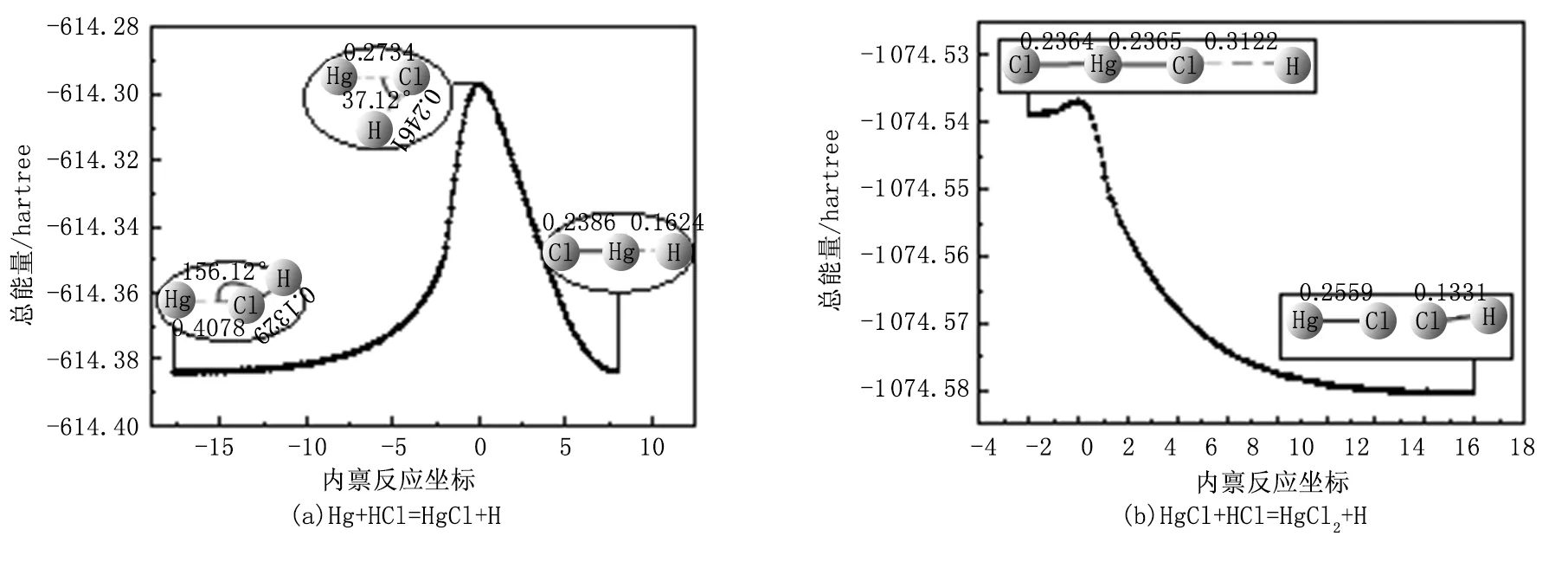
图7 过渡态TS的内禀反应坐标计算
(2)反应过程中的能量变化
本研究中,首先以相同的计算方法和基组为前提,计算了反应过程中各个驻点的能量。其中,驻点包括反应物、过渡态和生成物。然后以该计算结果为基础进行零点能校正。最后,利用校正后的能量计算出反应的能垒。根据经典过渡态理论,过渡态和稳定的反应物之间的能量差等于反应过程中的活化能E。基于该理论,可以计算得出在T=298K时,反应Hg+Cl2=HgCl+Cl的正反应的活化能为98.51kJ/mol,然后逆反应的活化能仅为43.80kJ/mol。根据计算结果可知,由于正反应的活化能大于逆反应的活化能,故正反应相对于逆反应较难进行。反应Hg+HCl=HgCl+H的正反应的活化能为207.58kJ/mol,逆反应的活化能为207.92kJ/mol,逆反应的活化能稍大于正反应的活化能,故正反应相对于逆反应容易进行;在HgCl+HCl=HgCl2+H反应中,其正反应的活化能为99.81kJ/mol,而逆反应的活化能为5.19kJ/mol,仅只是正反应的5.2%。由于正反应的活化能远大于逆反应的活化能,因此相对于正反应来说,逆反应更加容易进行。
(3)反应动力学参数计算
本研究中,采用了经典过渡态理论分别对不同温度下的动力学参数进行理论计算。此外,基于经典过渡态理论得到的反应速率常数的表达式为:
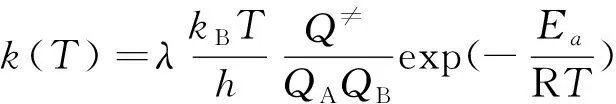
(9)
式中:λ为隧道效应校正系数。其经验表达式为:

(10)
式中:h为普朗克常数,J·s;v为过渡态振动虚频率,m-1;kB为玻尔兹曼常数,J/K;T为绝对温度,K;Q≠为过渡态的全配分函数;QA与QB为反应物A、B所对应的全配分函数;Ea为反应的活化能,J/mol;R为通用气体常数,J/(mol·K)。
根据所计算得到的数据,利用最小二乘法分别对其进行拟合,可以得到图5~图7所示反应的反应速率表达式(11)~(13):
k=1.019823×1010e-12410.3/Tcm3/(mol·s)
(温度为298~1500K)
(11)
k=7.8353×1016e-26690/Tcm3/(mol·s)
(温度为298~1500K)
(12)
k=8.425823×1015e-19380/Tcm3/(mol·s)
(温度为298~1500K)
(13)
4 结论
(1)基于热力学模拟结果可知向组分中添加氯后,通过增加氯的添加量,不仅能提高氯化汞的含量,而且氯化汞作为稳定相的范围也会随之增大。
(2)通过实验发现,温度是煤中汞析出的一个重要影响因素,温度越高,煤中汞的析出率越高,当温度达到1100℃时,原煤中汞的析出率为86.6%。燃煤添加不同比例含氯溶液后,煤中汞的析出率可得到进一步提高,原煤添加0.015%Cl、0.030%Cl和0.045%Cl后,煤中汞析出率分别提高为87.1%、90.1%以及92.8%。原煤燃烧烟气中零价汞占比远远大于氧化态汞占比,氯的添加能够有效提升烟气中氧化态汞的比例,可为后续汞的脱除创造良好的条件,烟气中氧化态汞比例由24%分别提高至25.6%、27%和27.7%。
(3)通过对3个汞-氯基元反应反应过程与机理的探究,获得了各个基元反应反应物、过渡态与产物间的能垒,并以此为基础计算得到各反应在298~1500K范围内的反应速率常数。Hg+Cl2=HgCl+Cl和Hg+HCl=HgCl+H的正反应的活化能分别为98.51kJ/mol和207.58kJ/mol,就正反应而言,活化能较低时,反应进行相对较快,因此Cl2对Hg0的氧化作用最为明显。因此提高烟气中Cl2的含量,有利于烟气中氧化态汞的形成。反应速率受温度的影响较大,温度越高,反应速率增加越快,促进烟气中含氯物质更多的转变为Cl2进而有利于提高脱汞效率。

