小鼠NR1D1 基因过表达载体的构建及其生物信息学分析
董 浩, 江海圳, 李 超, 高登科, 靳亚平, 陈华涛
(1.西北农林科技大学动物医学院临床兽医系,陕西 杨凌 712100;2.西北农林科技大学 农业农村部动物生物技术重点实验室,陕西 杨凌 712100)
核受体亚家族1 组D 成员1 (nuclear receptor subfamily 1 group D member 1,NR1D1),又被称为REV-ERBα,于1989 年首次被发现[1-2]。由于前期未发现NR1D1 的配体,NR1D1 一直被认为是孤儿核受体[3-5],阻碍了研究者对其功能特性进行充分认识。2007 年,RAGHURAM 等[6]证实血红素是NR1D1 的天然配体。进一步研究[7-11]表明:血红素既可激活单体NR1D1 与靶基因序列(AGGTCA) 的结合,也可激活2 个NR1D1 组成的二聚体与2 个间距2 bp 的靶序列结合,从而对下游靶基因起到转录抑制作用。随着对NR1D1 生理功能认识的不断深入和化学合成技术的发展,NR1D1 人工合成配体也应运而生。2010 年,GRANT 等[12]采用NR1D1 与核受体辅阻遏物1(nuclear receptor corepressor-1,NCoR-1) 之间相互作用的分析方法筛选出GSK4112 是一种与血红素竞争结合NR1D1 的小分子化合物。2012 年SOLT 等[13]人工合成了2 种NR1D1 配体SR9011和SR9009,并证明其在HEK293T 细胞中剂量依赖特性地增加与Gal4 DNA 结合域(DNA binding domain) 嵌合,起到增强NR1D1 转录抑制功能的作用。研究[13-14]表明: 小鼠腹腔注射SR9011 和SR9009 激动剂可增加机体能量消耗,并降低体脂、血浆甘油三酯和胆固醇水平,提示NR1D1 与机体代谢性功能之间存在重要的关联。NR1D1 配体的发现,加深了对NR1D1 生理功能的认识,但在分子生物学水平需要更进一步深入研究和探讨。
NR1D1 基因位于小鼠第11 号染色体上,在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI) 网站上的Gene ID 是217166,基因长度为7 476 bp,包含7 个内含子和8 个外显子。BONNELYE 等[15]于1994 年发现NR1D1 的 同 源 异 构 体NR1D2。NR1D1 和NR1D2 在编码序列和蛋白结构上具有很高的相似性,在昼夜节律和代谢稳态维持中均发挥其相应作用[8,16]。进一步的研究[16-17]显示:NR1D1-/-小鼠表现出较严重的昼夜节律和代谢紊乱,NR1D2-/-小鼠在昼夜节律和代谢稳态方面却无明显异常,说明NR1D1 在昼夜节律和代谢稳态方面发挥着更重要的生理作用。
NR1D1 调控的下游靶基因种类繁多且复杂,目前对其调控昼夜节律和代谢等多种生理功能的认识尚不全面。因此,本研究通过构建小鼠NR1D1基因的过表达载体,并对小鼠NR1D1 蛋白进行生物信息学分析,以期为后续NR1D1 基因功能及其相关通路机制的研究提供理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器
8 周龄雄性ICR 小鼠购于北京维通利华实验动物技术有限公司,动物生产许可证号: SCXK(京) 2016-0011。HEK293T 细胞购于中国科学院细胞库。pcDNA3.1 质粒购于美国Promega 公司,DH5α 感受态细胞、 无内毒素小提中量试剂盒和DNA 纯化回收试剂盒购于天根生化科技(北京)有限公司,ECL Super Sensitive Kit 和DiGreen Safe DNA Dye 购于北京迪宁生物科技有限公司,THUNDERBIRD SYBR®qPCR Mix 和逆转录反应试剂盒购于东洋纺(上海) 生物科技有限公司,PrimeSTAR HS DNA Polymerase 、 TRIzol 、XhoⅠ、DL 10 000 DNA marker 和DL 5 000 DNA marker 购于宝日医生物技术(北京) 有限公司,ClonExpress®ⅡOne Step Cloning Kit 购于南京诺唯赞生物科技股份有限公司,胰蛋白酶、DMEM 培养基和胎牛血清购于美国Gibco 公司,BCA 蛋白含量检测试剂盒购于江苏凯基生物技术股份有限公司,兔抗NR1D1 抗体购于美国Abcam 公司,鼠抗β-actin 抗体购于天津三箭生物技术有限公司,HRP共轭羊抗兔抗体和HRP 共轭羊抗鼠抗体购于北京中杉金桥生物技术有限公司,Striping Buffer 购于北京康为世纪生物科技有限公司。PCR 扩增仪、荧光定量系统和电泳仪购于美国Bio-Rad 公司,凝胶成像分析系统购于英国Syngene 公司,核酸蛋白测定仪和CO2培养箱购于美国Thermo Fisher 科技有限公司。
1.2 小鼠肝组织总RNA 提取和cDNA 获取
选用ICR 品系8 周龄小鼠,脱颈处死后摘取肝脏,称取100 mg 肝脏组织加入到提前准备好的TRIzol 试剂中,用组织匀浆机打碎肝组织,- 80 ℃储存备用。采用TRIzol 提取法提取肝组织中总RNA,按说明书进行操作获得总RNA,用超微量分光光度计测量总RNA 浓度,取部分RNA 稀释至200 mg·L-1。使用TOYOBO 逆转录反应试剂盒并严格按说明书操作,获得cDNA 样品。反应体系共10 μL,由模板Total RNA 5 μL、5×RT Master Mix 2 μL 和去离子水3 μL 组成。PCR 反应程序: 37 ℃、 15 min,50 ℃、 5 min,98 ℃、5 min,4 ℃保存。获得的cDNA 置于-20 ℃冰箱中保存备用。
1.3 NR1D1 编码区片段获取和重组质粒构建
1.3.1 NR1D1 编码区引物设计 从NCBI 网站中查找小鼠的NR1D1 编码区序列(coding sequence,CDS),用Primer Premier 6.0 软件设计其PCR 引物序列: 上游引物5′-CGATATCGGATCCGGTACCCTCGAGATGACGACCCTGGACTCCAAT A-3′,下游引物5′-GCGGTTTAAACTTACCGGTCTCGAGTCACTGGGCGTCCACCCGGAAG-3′。在NR1D1 CDS 的引物序列上下游5′端加上线性化pcDNA 3.1 载体两末端的同源序列,设计的引物序列由西安擎科泽西生物科技有限责任公司合成。
1.3.2 目的序列片段扩增及纯化回收 采用PrimeSTAR HS DNA Polymerase 合成扩增NR1D1 CDS 片段,按照其说明书配制反应体系:小鼠肝组织cDNA 4 μL (200 ng),5×PrimeSTAR Buffer (Mg2+Plus) 10 μL,dNTP Mixture 4 μL,Primer F 1 μL,Primer R 1 μL,PrimeSTAR HS DNA Polymerase 0.5 μL,加去离子水补至50 μL。PCR 反应程序:98 ℃预变性2 min;98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸2 min,循环35 次;72 ℃终延伸5 min。PCR 反应结束后,通过琼脂糖凝胶电泳检测PCR 产物,结束后,将符合预期的条带凝胶切下,并按照DNA 纯化回收试剂盒说明书操作将目的基因片段纯化回收。
1.3.3 载体线性化 采用限制性内切酶XhoⅠ将载体pcDNA3.1 线性化,反应体系: pcDNA3.1 1 μL,10×QuickCut Green Buffer 2 μ L ,XhoⅠ1 μL,加去离子水补至20 μL。37 ℃反应30 min。反应结束后,通过琼脂糖凝胶电泳实验检测酶切产物,将符合预期的条带凝胶切下并使用胶回收试剂盒回收纯化线性化载体片段。
1.3.4 同源重组反应 采用ClonExpress®ⅡOne Step Cloning Kit 中的Exnase Ⅱ将回收的NR1D1 CDS 片段与线性化载体进行同源重组反应。反应体系:线性化pcDNA3.1 104.3 ng,NR1D1 CDS片段76 ng,5×CE ⅡBuffer 4 μ L ,Exnase Ⅱ2 μL,加去离子水补至20 μL。37 ℃反应30 min,结束后立即4 ℃条件下保存。
1.3.5 重组质粒的扩增、提取和鉴定 采用DH5α感受态细胞扩增重组质粒,将重组质粒转至DH5α内,在含30 mg·L-1羧苄青霉素的LB 固体培养基平板上涂布培养,12~16 h 之后挑取单克隆菌落,将其放入37 ℃恒温摇床中扩增12 h。采用无内毒素小提中量试剂盒按其说明书提取重组质粒,并按照“1.3.3” 中方法对重组质粒进行酶切鉴定,将鉴定正确的重组质粒送至西安擎科泽西生物科技有限责任公司进行测序,将测序结果与NCBI 中的序列进行比对。
1.4 重组质粒转染HEK293T 细胞
HEK293T 细胞培养于含青霉素-链霉素-两性霉素B 和10% 胎牛血清的DMEM 高糖培养基的60 mm 培养皿中。转染前24 h,将生长状态良好的293T 细胞接种至2 个6 孔细胞培养板内,每孔接种2×105个细胞。接种24 h 后,使用转染试剂Turbofect 且按其说明书操作,选取每个6 孔细胞培养板中的3 个孔将pcDNA3.1 空载体和pcDNA3.1-NR1D1 重组质粒分别转染至HEK293T 细胞中,分别为对照组和pcDNA3.1-NR1D1 转染组,将培养板置于37 ℃、5% CO2培养箱中继续培养。
1.5 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测2 组细胞中NR1D1 mRNA 表达水平
转染48 h 后,使用TRIzol 试剂提取细胞样品总RNA 并进行反转录,反转录操作方法同 “1.2”。用Primer Premier 6.0 设计人GAPDH 和人与小鼠通用的NR1D1 引物序列,见表1。使用TOYOBO的THUNDERBIRD SYBR®qPCR Mix 并按说明书操作进行RT-qPCR 反应。反应体系: qPCR Mix 10 μL,Primer F 1 μL,Primer R 1 μL,cDNA 4 μL,去离子水4 μL。反应程序:95 ℃预变性60 s;95 ℃变性10 s,60 ℃延伸30 s,循环40 次;95 ℃变性15 s,60 ℃延伸60 s,95 ℃变性15 s。采用荧光定量系统进行反应,以人GAPDH 基因作为内参基因,采用2-△△Ct相对定量法计算目的基因mRNA 表达水平。
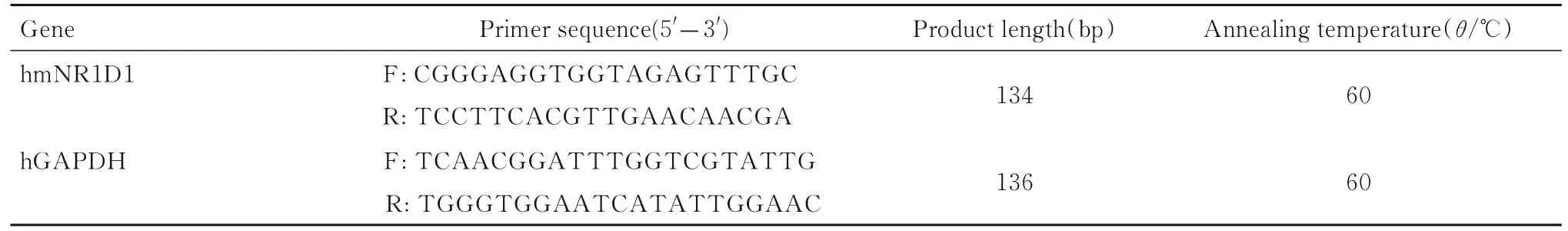
表1 RT-qPCR 引物序列Tab.1 Primer sequences of RT-qPCR
1.6 Western blotting 法检测2 组细胞中NR1D1 蛋白表达水平
转染48 h 后,使用RIPA 细胞裂解液并按其说明书操作提取细胞蛋白样品。采用BCA 蛋白含量检测试剂盒测定总蛋白浓度后加入Loading Buffer,金属浴100 ℃、10 min;配制12% 凝胶电泳分离胶和5% 浓缩胶,取20 μg 总蛋白经SDS-PAGE 电泳分离,待蛋白样品电泳至合适位置时电泳结束;将蛋白转印至PVDF 膜;用10% 脱脂奶粉封闭2 h后,将PVDF 膜放入提前稀释好的兔抗NR1D1 抗体中室温摇床孵育2 h,4 ℃孵育过夜;TBST 洗膜5 次,每次5 min;HRP 共轭羊抗兔二抗室温孵育1 h,用TBST 洗膜5 次,每次5 min。将ECL 发光液滴加至膜上,曝光并拍摄保存图像。用TBST 洗膜5 次,每次5 min,加入抗体洗脱液Striping Buffer 使其没过PVDF 膜,洗脱15 min 后,孵育鼠抗β-actin 抗体按上述操作进行。用ImageJ 软件对条带灰度进行分析,以目的蛋白条带灰度值与内参β-actin 条带灰度值的比值代表NR1D1蛋白表达水平。
1.7 生物信息学分析
通过DNAStar 软件将测序结果同其他物种NR1D1 CDS 序列进行相似性比对;应用MEGA7软件对人、小鼠、大鼠、中国仓鼠、黑猩猩、兔、犬、猪、马、牛、绵羊、山羊、家猫和斑马鱼的NR1D1 CDS 序列进行分析并构建系统进化树;使用ExPASy (https://web.expasy.org/protparam/)在线工具预测小鼠NR1D1 蛋白的理化性质,包括理论分子质量、分子式、原子总数、等电点、氨基酸数、消光系数、半衰期、不稳定系数和脂肪族系数; 应用ProtScale (https://www.expasy.org/resources/protparam) 预测小鼠NR1D1 氨基酸序列的亲/疏水性;通过SingalP5.0 (https://services.healthtech.dtu.dk/service.php?SignalP-5.0) 在线程序对小鼠NR1D1 氨基酸序列进行信号肽预测;通过TMHMM-2.0 (https://services.healthtech.dtu.dk/service.php? TMHMM-2.0) 在线程序进行跨膜结构预测; 应用 PhosphoSitePlus®(https://www.cellsignal.cn/learn-and-support/phosphositeplus-ptm-database) 在线生物资源系统对小鼠NR1D1 蛋白翻译后修饰(磷酸化和泛素化)研究提供相关信息;通过SOPMA (https://npsa
prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html) 在线程序对小鼠NR1D1 蛋白的二级结构进行预测; 通过SWISS-MODEL(https://swissmodel.expasy.org/interactive) 程序对小鼠和人NR1D1 蛋白的三级结构进行预测,并采用pyMOL 软件对两者相似性进行比较。
1.8 统计学分析
采用GraphPad Prism 6.0 统计软件进行统计学分析。各组HEK293T 细胞中NR1D1 mRNA 和蛋白表达水平均符合正态分布,以±s表示,2 组间样本均数比较采取两独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 目的片段获取和载体线性化
以小鼠组织的cDNA 为模板,通过PCR 扩增获得带有pcDNA3.1 同源臂的NR1D1 CDS 片段(图1 A),琼脂糖凝胶电泳结果与预期大小(1 898 bp) 相符。通过XhoⅠ将pcDNA3.1 载体酶切线性化,采用琼脂糖凝胶电泳鉴定酶切产物。线性化载体条带大小与预期结果(5 211 bp) 相符(图1 B)。
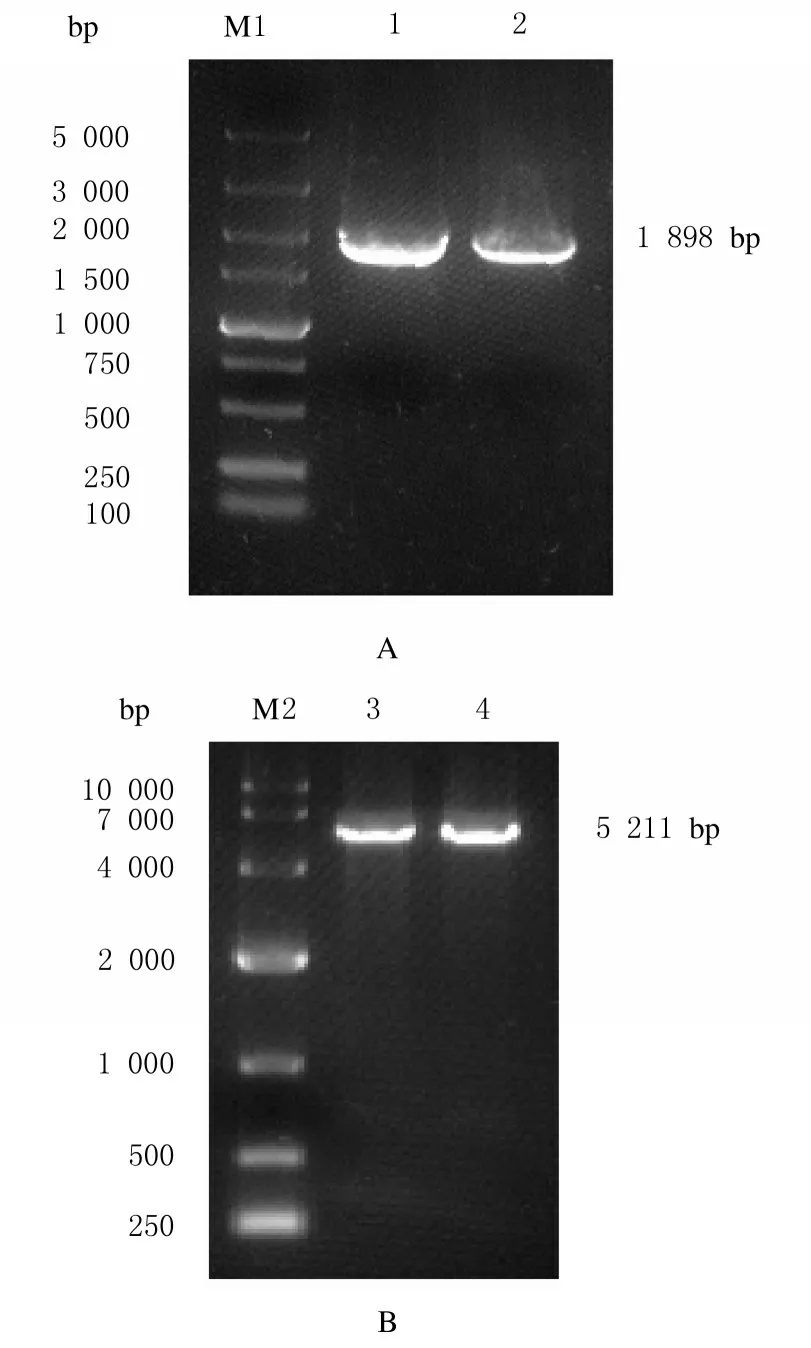
图1 NR1D1 CDS PCR 产物(A)和pcDNA3.1 载体线性化结果(B)鉴定Fig.1 Identification of NR1D1 CDS PCR products(A) and linearized pcDNA3.1 vector (B)
2.2 重组质粒鉴定
使用无缝克隆酶将纯化回收后NR1D1 CDS 片段连接至线性化的pcDNA3.1 载体,将重组质粒转化至DH5α,扩增后提取菌液中的质粒,使用XhoⅠ将重组质粒进行酶切鉴定,酶切产物鉴定结果见图2。重组质粒酶切产物电泳后获得与预期大小一致的2 条电泳条带(pcDNA3.1: 5 211 bp;NR1D1 CDS:1 854 bp)。将鉴定正确的重组质粒测序,pcDNA3.1-NR1D1 中NR1D1 CDS 片段的测序结果与NCBI 数据库中已知序列完全一致,证明过表达载体pcDNA3.1-NR1D1 构建成功。

图2 小鼠pcDNA3.1-NR1D1 重组质粒的酶切产物鉴定Fig.2 Identification of enzyme digestion products of mouse pcDNA3.1-NR1D1 recombinant plasmid
2.3 2 组细胞中NR1D1 mRNA 和蛋白表达水平
分别将pcDNA3.1 和pcDNA3.1-NR1D1 转染至HEK293T 细胞,48 h 后收取细胞样品,用于提取总RNA 和总蛋白样品。RT-qPCR 法检测结果显示: 与对照组比较,pcDNA3.1-NR1D1 转染组NR1D1 mRNA 表达水平明显升高(P<0.01)。Western blotting 法检测结果显示: pcDNA3.1-NR1D1 转染组在相对分子质量67 000 处有明显的条带;与对照组比较,pcDNA3.1-NR1D1 转染组NR1D1 蛋白表达 水 平明显升 高(P<0.01)。见图3。

图3 2 组HEK293T 细胞中NR1D1 mRNA(A)和蛋白(B)表达水平及NR1D1 蛋白表达电泳图(C)Fig.3 Expression levels of NR1D1 mRNA(A) and protein(B) and electrophoregram(C) of expressions of NR1D1 protein in HEK293T cells in two groups
2.4 小鼠NR1D1 CDS 相似性比对和系统进化树构建
采用DNAStar 软件对小鼠NR1D1 CDS 进行相似性分析(图4),小鼠NR1D1 CDS 与人、大鼠、中国仓鼠、黑猩猩、兔、犬、猪、马、牛、绵羊、山羊、家猫和斑马鱼等不同物种的相似性分别为90.0%、 94.8%、 86.5%、 90.0%、 89.6%、88.3%、 89.7%、 89.8%、 88.8%、 89.1%、89.1%、89.7% 和65.1%。系统进化树结果显示:小鼠NR1D1 基因与中国仓鼠、大鼠的遗传距离最近,与斑马鱼的遗传距离最远,进化树的形态与动物分类学基本保持一致。见图5。

图4 小鼠与其他物种NR1D1 基因序列相似性比对Fig.4 Similarity alignment of NR1D1 gene between mice and other species

图5 小鼠NR1D1 基因系统进化树Fig.5 Phylogenetic tree of mouse NR1D1 gene
2.5 小鼠NR1D1 蛋白理化性质分析
利用ExPASy 在线工具中的ProtParam 对小鼠NR1D1 进行蛋白质理化性质分析,结果显示:小鼠NR1D1 蛋白理论分子质量为66 802.05,分子式为C2886H4553N845O914S34,原子总数是9 232 个,等电点(pI) 为8.66,属于碱性蛋白; 该蛋白含有615 个氨基酸,其中丝氨酸含量最高(14.0%),色氨酸含量最低(0.5%)(表2);在水中以波长280 nm 预测消光系数为33 765,半衰期为30 h,不稳定系数为63.20,脂肪族系数为64.24。
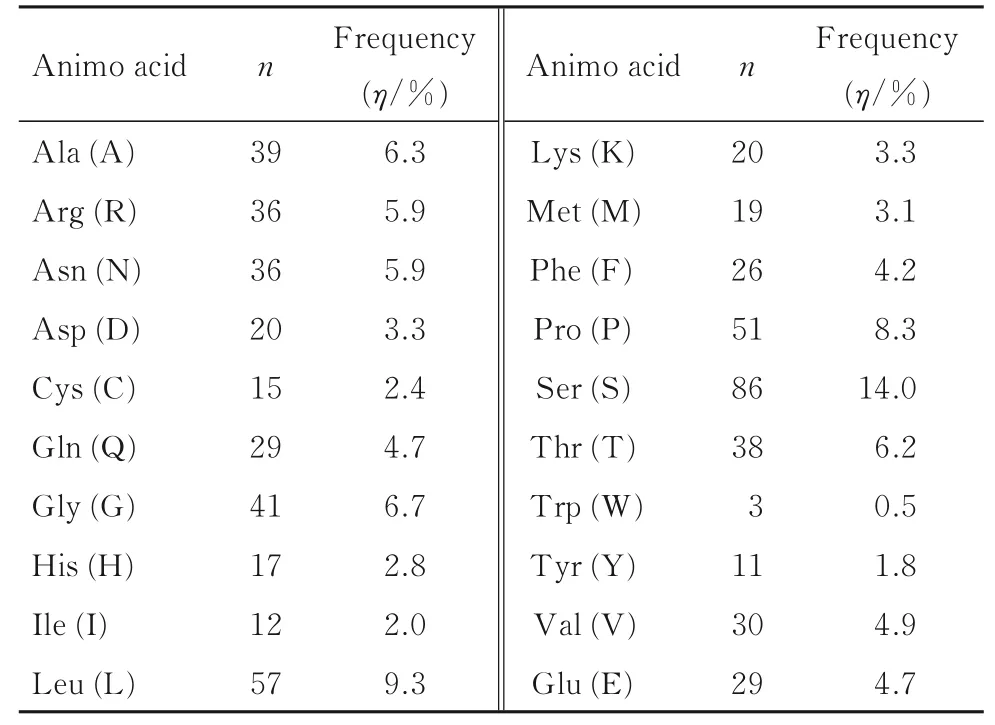
表2 小鼠NR1D1 蛋白氨基酸组成Tab.2 Amino acid composition of mouse NR1D1 protein
2.6 小鼠NR1D1 蛋白亲/疏水性预测
利用ExPASy 在线工具中的ProtScale 对小鼠NR1D1 氨基酸序列的亲/疏水性进行预测,小鼠NR1D1 氨基酸序列最低分值为-2.822 (位于第212 位氨基酸),亲水性最强; 最高分值为2.633(位于第543 位氨基酸),疏水性最强;该蛋白整条肽链大部分属于亲水区域,表现为亲水性,由此推测小鼠NR1D1 蛋白为亲水性蛋白。见图6。

图6 小鼠NR1D1 蛋白亲/疏水性Fig.6 Hydrophilicity/hydrophobicity prediction of mouse NR1D1 protein
2.7 小鼠NR1D1 蛋白信号肽和跨膜结构预测
采用SingalP 5.0 程序对小鼠NR1D1 氨基酸序列进行信号肽预测(图7),该蛋白不存在信号肽。利用TMHMM Serverv.2.0 程序对小鼠NR1D1 进行跨膜结构预测(图8),该蛋白不存在跨膜区。

图7 小鼠NR1D1 蛋白信号肽预测Fig.7 Signal peptide prediction of mouse NR1D1 protein

图8 小鼠NR1D1 蛋白跨膜结构预测Fig.8 Transmembrane structure prediction of mouse NR1D1 protein
2.8 小鼠NR1D1 蛋白化学修饰位点
采用PhosphoSitePlus®在线生物资源系统分析小鼠NR1D1 蛋白,该蛋白存在12 个磷酸化位点和10 个泛素化位点,每个位点至少有1 篇文献数据支撑,且具有锌指蛋白C4 型区域(zinc finger C4 type,zf-C4) 和激素受体的配体结合域。见图9。

图9 小鼠NR1D1 蛋白化学修饰位点Fig.9 Chemical modification sites of mouse NR1D1 protein
2.9 小鼠NR1D1 蛋白二级结构和三级结构预测
通过SOPMA 在线程序对小鼠NR1D1 蛋白二级结构进行预测(图10)。小鼠NR1D1 蛋白二级结构主要是无规则卷曲(54.63%),α-螺旋、延伸链和β-转角分别占26.50%、12.68% 和6.18%。通过SWISS-MODEL 程序对该蛋白三级结构进行预测(图11),小鼠NR1D1 蛋白含有α-螺旋、β-转角和无规则卷曲等复杂结构。通过pyMOL 软件对小鼠和人的NR1D1 蛋白三级结构进行比较,原子位置均方根偏差 (root-mean-square deviation,RMSD) 为0.561,表明二者三级结构差异较小。

图10 小鼠NR1D1 蛋白二级结构预测Fig.10 Secondary structure prediction of mouse NR1D1 protein

图11 小鼠NR1D1 蛋白三级结构预测Fig.11 Tertiary structure prediction of mouse NR1D1 protein
3 讨 论
生物钟基因是维持内源生物钟系统节律性振荡的基础。哺乳动物核心生物钟基因有近20 种,主要包括BMAL1、 CLOCK、 PER1/PER2/PER3(PERs)、 隐花色素1 (cryptochrome-1,CRY1) /隐花色素2 (cryptochrome-2,CRY2)(CRYs)、NR1D1/NR1D2 (REV-ERBα/REV-ERBβ) 和视黄酸相关的孤儿受体(RAR-related orphan receptor,ROR) α/β/γ 等,通过转录和翻译形成多个反馈环路来调节生物钟基因和生物钟控制基因的节律性表达[17]。生物钟核心转录因子BMAL1 和CLOCK 以异源二聚体的形式进入细胞核,结合特定DNA 顺势作用元件E-box 以激活PERs 和CRYs基因的转录,随后细胞质内不断累积的PERs 和CRYs 蛋白进入细胞核直接抑制BMAL1-CLOCK的转录活性,进而抑制其下游靶基因的转录。其次,在核心反馈环的外围,BMAL1/CLOCK 通过E-box 元件促进NR1D1 和RORα 的转录,而NR1D1 和RORα 蛋白分别通过与BMAL1 启动子特异序列REV-ERBα/RORα 结合序列直接结合,反过来分别抑制和促进BMAL1 的转录[18-20]。因此,NR1D1 作为核心生物钟基因在维持机体生物钟系统的稳定方面起到重要作用[21]。
NR1D1 基因既是生物钟系统的重要组成部分又是能量代谢中的状态依赖性调节因子,通过调节代谢相关基因的转录,维持机体代谢的稳态[22-24]。大量研究[25-26]表明:NR1D1 基因缺失会引起小鼠代谢功能障碍,导致脂肪组织沉积、胆汁酸增加和肌肉氧化能力受损,引起相关代谢性疾病的发生。NR1D1 通过抑制载脂蛋白C3 的表达,降低了胆固醇反应元件结合蛋白(sterol regulatory elementbinding proteins,SREBPs) 的蛋白水解活性,进而抑制胆固醇和脂肪酸合成中关键功能酶的活性,导致脂质代谢紊乱[27]。NR1D1 缺陷小鼠的线粒体数量减少、线粒体功能障碍以及生物合成能力不足,导致骨骼肌氧化能力受损而表现出严重的跑步能力下降,因此NR1D1 被认为是一种新型骨骼肌氧化能力调节因子[28]。研究[29-30]显示:NR1D1 还可抑制肝受体类似物1 (liver receptor homologue-1,LRH-1),从而抑制细胞色素P450 家族7 亚科多肽1(cytochrome P450,family 7,subfamily A,polypeptide 1,CYP7A1) 催化胆汁酸合成和胆固醇分解,引起胆固醇代谢异常,并确定了NR1D1/LRH-1 轴是一种新的CYP7A1 表达和胆固醇稳态调节通路,提示后期以NR1D1/LRH-1 轴为靶点可为胆固醇代谢障碍相关疾病的治疗提供一种新的途径。此外,NR1D1 可以调控机体的免疫应答,并且还可以通过抑制自噬小体的形成和溶酶体降解来调节自噬过 程[31-32]。CHANDRA 等[33]发现:NR1D1 对单核细胞中白细胞介素10 (interleukin-10,IL-10) 表达有抑制作用,加速胞内溶酶体的成熟,导致细菌在单核细胞内无法生存,证明NR1D1 通过抑制IL-10 转录增加了巨噬细胞的杀菌能力。
NR1D1 基因在肝脏、脂肪和大脑等组织中均呈现高表达的模式[34],尤其在肝脏中表现为明显的节律性变化。肝脏是机体重要的代谢器官,本研究采用小鼠肝脏组织扩增NR1D1 基因的CDS 序列,为后续研究NR1D1 基因与代谢之间的关系提供了理论依据。蛋白功能由氨基酸序列和蛋白结构决定,对小鼠NR1D1 蛋白进行生物信息学分析可为进一步研究NR1D1 蛋白的生理功能奠定基础。NR1D1 蛋白是一种疏水碱性蛋白质,具有12 个磷酸化位点和10 个泛素化位点,上述化学修饰位点可能决定了NR1D1 蛋白的相关重要生理功能。NR1D1 蛋白通过特异性锌指结构对特定DNA 序列进行识别,从而对靶基因的转录进行调控。小鼠和人NR1D1 蛋白的三级结构差异较小,后续可以对小鼠NR1D1 蛋白结构进行深入研究,为治疗昼夜节律紊乱和糖脂代谢失调等相关疾病提供新的研究思路。
本研究成功构建了pcDNA3.1-NR1D1 重组载体,并将其转染至HEK293T 细胞,进一步在mRNA 和蛋白质水平验证了NR1D1 的过表达。对小鼠NR1D1 CDS 区及其蛋白结构进行生物信息学分析的结果显示:NR1D1 CDS 区在小鼠、大鼠和人等多个物种中高度保守,且小鼠NR1D1 蛋白是一种疏水碱性蛋白质,其含有12 个磷酸化位点和10 个泛素化位点,二级结构包括无规则卷曲、α-螺旋、延伸链和β-转角,与人的NR1D1 蛋白三级结构比较差异较小。本研究结果为后续NR1D1 基因功能及其相关信号通路调控机制研究奠定了基础。
——一道江苏高考题的奥秘解读和拓展

