血清肠三叶因子(TFF3)在非小细胞肺癌的诊断及化疗疗效评估中的意义
常远敏 尤青海
肺癌作为最常见的恶性肿瘤,是目前癌症相关性死亡的常见原因之一,占癌症相关死亡率的25%,根据分期及地区的不同,其5年生存率波动于4%-17%之间[1-2]。随着对肺癌研究的深入,多种肿瘤血清标志物已被证实与肺癌的诊断、鉴别诊断有关,或可用于治疗效果及预后的评估,如目前国际上最常用的神经元烯醇化酶(NSE)、癌胚抗原(CEA)、细胞角蛋白19片段(CYFRA21-1)[3]。血清标记物检测有低损害、成本低、操作简便等优点,但无论单独检测、联合联测均存在准确性低、易漏诊等不足之处,以上优缺点使得肿瘤标记物检测在临床上备受青睐的同时,也限制了其临床地位的进一步提高,仅能起到辅助作用。肠三叶因子〔(Intestinal Trefoil Factor, ITF) or (Trefoil Factor 3,TFF3) 〕是一种稳定的小分子分泌性多肽,研究证明TFF3参与黏膜保护、促进细胞迁移等生理、病理过程,是目前血清肿瘤标记物的研究热点之一。已有的研究表明,TFF3在促进肿瘤细胞转移、增殖、侵袭能力等方面有重要的作用[4]。
资料与方法
一、一般资料
2020年06月20日至2021年06月06日于安徽医科大学第一附属医院呼吸与危重症科初次确诊的84例非小细胞肺癌患者(肺腺癌46例,肺鳞癌38例)作为非小细胞肺癌组被纳入研究,其基本特征为:男性65例、女性19例,年龄为35~80岁,平均年龄65.45岁,TNM分期为I-IV期。确诊方法包括:痰脱落细胞学、胸腔积液细胞学、纤维支气管镜或肺组织活检及病理检查。合并其他恶性肿瘤、严重肝肾功能不全、免疫系统疾病、血液系统疾病的患者则被排除在外。同时期在本医院接受体检的21例健康者作为对照组,男性11例、女性10例,年龄51~88岁,平均年龄63.86岁。随访非小细胞肺癌组中仅接受化疗,而无放疗、靶向等其他治疗方式的患者,最后以连续接受至少2个周期以上化疗的患者作为化疗组,化疗方案为培美曲塞(肺腺癌)或紫杉醇(肺鳞癌)+铂类。有效随访接受化疗的非小细胞肺癌患者共18例(男性16例、女性2例),年龄53~80岁,平均年龄66.06岁。本研究中的受试者均知情同意,研究经安徽医科大学第一附属医院伦理委员会批准。
二、方法
1 标本收集 采集患者初次入院时、健康对照组体检第一天空腹外周静脉血3~5 mL,3 000 r/min离心10 min(离心半径10 cm)分离出上清液置EP管中 -80 ℃冰箱保存待测。同时采集符合随访条件的非小细胞肺癌患者2个化疗周期后空腹外周血3~5 mL,经上述过程分离血清并保存待测。采用上海酶联免疫试剂盒检测血清中TFF3水平,检测时严格按照试剂盒的说明书进行操作。
2 资料收集及疗效评估 采集非小细胞肺癌组患者初次确诊时外周血实验室指标(中性粒细胞计数、淋巴细胞计数、血小板计数)、NSE、CEA、CYFRA21-1,分别计算中性粒细胞计数、淋巴细胞计数、血小板计数中位数、NSE、CEA、CYFRA21-1中位数。
3 TCGA数据库肺癌数据 从TCGA数据库下载肺腺癌、肺鳞癌组织的TFF3表达数据及病例信息,数据经过标准化处理后,TFF3在肿瘤组织中的表达水平以log2(TPM+1)形式呈现,筛选出仅接受化疗且有完整化疗疗效的患者,最终纳入研究的样本包括肺腺癌74例、肺鳞癌49例。化疗疗效评价分为:临床完全缓解(Complete Response)、部分缓解(Partial Response)、疾病稳定(Stable Disease)、疾病进展(Progressive Disease)。
三、统计学分析

结 果
一、非小细胞肺癌组与对照组一般资料及血清TFF3水平比较
将非小细胞肺癌组患者分为腺癌组、鳞癌组,年龄在腺癌组、鳞癌组与对照组之间的差异无统计学意义(P>0.05)。3组间性别比例的差别具统计学意义(P<0.05)。血清TFF3水平在此3组间的差异有统计学意义(P<0.05)。腺癌组、鳞癌组TFF3水平均分别高于正常对照组,差异有统计学意义(P<0.05),而鳞癌组及腺癌组间的差异则无统计学意义(P>0.05)(见表1)。
表1 非小细胞肺癌组与对照组一般资料及血清TFF3水平比较
二、不同实验室指标非小细胞肺癌组患者血清TFF3水平间的关系
不同中性粒细胞计数、淋巴细胞计数、NSE、CEA、CYFRA21-1水平的非小细胞肺癌患者血清TFF3比较,差异无统计学意义(P>0.05)(见表2、3)。在血小板计数≥中位数的非小细胞肺癌患者血清中,TFF3的水平较高于血小板<中位数组的非小细胞肺癌患者,差异有统计学意义(P<0.05,见表2)。中性粒细胞计数、血小板计数、淋巴细胞计数的中位数分别为4.355×109/L、228.5×109/L、1.48×109/L,NSE、CEA、CYFRA21-1的中位数分别为15.385 ng/mL、5.45 ng/mL、7.4 ng/mL。
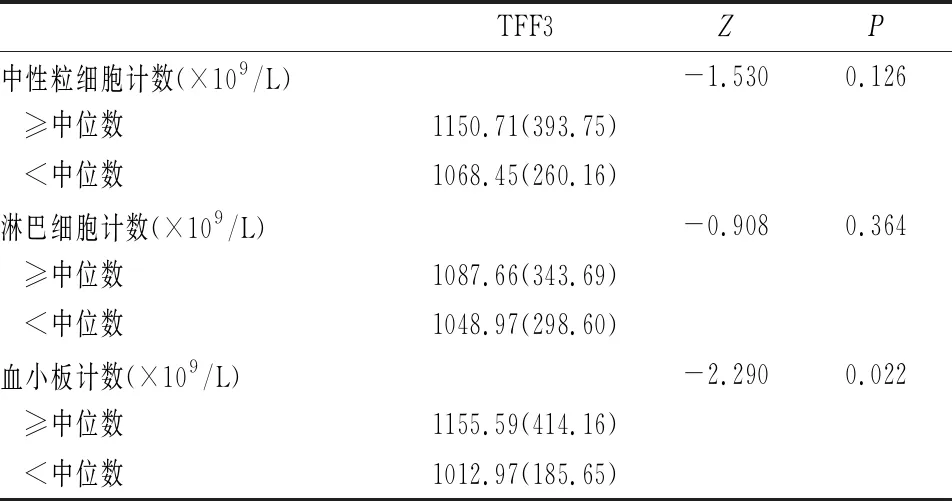
表2 不同实验室指标非小细胞肺癌组患者血清TFF3水平比较〔M(QR),n=42,pg/mL〕
表3 不同肿瘤标记物非小细胞肺癌组患者血清TFF3水平的比较
三、血清TFF3水平诊断非小细胞肺癌的临床价值
非小细胞肺癌组患者血清TFF3水平诊断非小细胞肺癌的ROC曲线下面积(AUC)为0.73〔95%CI(0.62,0.83)〕,约登指数为0.45; 诊断肺腺癌的AUC为0.69〔95%CI(0.56,0.82)〕,约登指数为0.37;诊断肺鳞癌的AUC为0.77〔95%CI(0.66,0.89)〕,约登指数为0.55(见图1A-C)。非小细胞肺癌组患者血清TFF3水平诊断非小细胞肺癌、肺腺癌及肺鳞癌的截断值分别为1109.37 pg/mL、1109.37 pg/mL、1110.61 pg/mL。
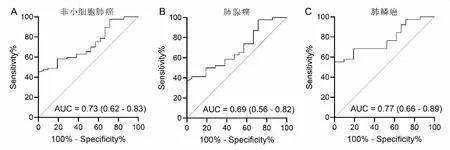
图1 血清TFF3水平诊断非小细胞肺癌、肺腺癌及肺鳞癌的ROC曲线
四、化疗组非小细胞肺癌患者化疗前后血清TFF3水平比较
化疗组非小细胞肺癌患者化疗前后血清TFF3水平发生改变,差异有统计学意义(P<0.05)。将化疗组的患者分为腺癌组、鳞癌组,并分别将其化疗前后血清TFF3水平进行比较,腺癌组化疗后的血清TFF3水平显著低于化疗前,差异有统计学意义(P<0.05),而鳞癌组化疗前后血清TFF3水平变化则无统计学意义(P>0.05)(见表4)。
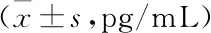
表4 化疗组非小细胞肺癌患者化疗前后TFF3水平比较
五、肺腺癌、肺鳞癌组织中TFF3表达水平与化疗效果之间的关系
采用TCGA数据库下载TFF3在肺腺癌、肺鳞癌组织中的表达水平,通过分析不同化疗效果的肺腺癌、肺鳞癌患者组织TFF3表达水平,发现CR+PR的肺腺癌患者组织中TFF3表达水平较PD+SD高(P<0.05),而在肺鳞癌患者中TFF3的表达水平与化疗疗效无明显关系(P>0.05)(见表5)。
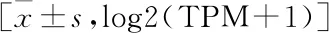
表5 化疗后不同疗效肺腺癌、肺鳞癌组织TFF3水平比较
讨 论
肿瘤血清标志物是肿瘤组织分泌或与肿瘤组织有关的存在于血液内的物质,通过进入局部微环境、循环扩散或与周围环境进行物质交换等方式,参与肿瘤细胞生长、侵袭、转移,多数肿瘤标志物的组织特异性低,仅少数与特定的肿瘤明显相关(如:前列腺特异性抗原与前列腺癌、甲胎蛋白与肝癌)[1, 5-6]。目前,肺癌的发病率和死亡率均处于恶性肿瘤的前三位,其中非小细胞肺癌患者占肺癌患者总数的85%~90%,而鳞癌、腺癌则是非小细胞肺癌最常见的两种病理类型[7]。目前可用于肺癌的肿瘤血清标记物较少,不同肿瘤血清标记物诊断不同病理类型的肿瘤时,呈现不同的敏感性和特异性[8],如NSE主要用于小细胞肺癌,CEA用于肺腺癌,CYFRA21用于肺鳞癌[3,9],但以上标记物仍然会因为其不高的敏感性和特异性而致漏诊或错误评估,因此研究者们在进一步探索具有良好的诊断及预后评估价值的新型血清肿瘤标记物。
TFF3作为一种新型肿瘤标志物,是目前研究的热点,多种研究已证实其在胃癌、宫颈癌、食管癌等肿瘤中增高,也有少量研究探索肺癌与TFF3之间的潜在关联[10]。本研究结果表明化疗前非小细胞肺癌患者血清中TFF3的表达高于健康对照者,与Qu等[11]的研究结果保持一致。同时我们的研究追踪了非小细胞肺癌患者化疗后血清TFF3的表达,其与化疗前相比表达水平下降,差异有统计学意义,可推测TFF3与化疗相关。通过分析TCGA数据库中TFF3的表达与化疗效果之间的关系,我们发现,对化疗完全缓解及部分缓解的肺腺癌患者组织中TFF3表达水平较疾病稳定及疾病进展患者高,而在肺鳞癌患者中TFF3表达水平与化疗疗效未发现明显相关性,故TFF3可作为一种评估肺腺癌化疗疗效的实验室指标。
本研究结果显示:非小细胞肺癌患者血清中TFF3水平在血小板计数≥中位数组中的表达高于血小板<中位数组,差异有统计学意义,而不同中性粒细胞计数、淋巴细胞计数、CEA、NSE、CYFRA21-1水平的非小细胞肺癌患者血清TFF3比较,差异无统计学意义。Zhang等研究表明TFF3高表达肺腺癌细胞,较TFF3低表达细胞拥有较高的增殖、转移、修复损伤能力[4],另有研究认为血小板参与多种肿瘤细胞的生长、转移及促进血管的生长,其促肿瘤细胞的转移作用主要是通过与肿瘤细胞相互作用激活TGF-β、NF-κB途径[12-13],以上表明血小板的促肿瘤作用可能与TFF3表达升高有关。因时间、临床条件等因素的限制,本研究纳入的样本量较少,性别比例存在差异,但目前尚未有报道表明TFF3的表达与不同性别之间存在相关性。综上,此结果为探索TFF3在非小细胞肺癌中的作用提供了新的研究方向。
综上所述, TFF3可用于非小细胞肺癌的诊断、肺腺癌化疗疗效评估。虽然本研究有样本量较少、研究较为表浅等缺点,但仍为研究非小细胞肺癌的发生发展途径提供新的思路。

