miR-301a靶向雌激素受体信号通路对乳腺癌细胞侵袭及上皮-间质转化的影响
沈娜
乳腺癌是全世界女性中最普遍的癌症类型,其发病率和死亡率较高,严重危害女性生命健康[1]。75%的乳腺癌是雌激素依赖型肿瘤,雌激素信号传导通路在乳腺癌的发生、发展过程中起主要作用[2]。雌激素受体α(estrogen receptor-α,ERα)调节参与调节癌细胞的增殖、侵袭和迁移,在乳腺生物学和发育中起关键作用[3],ERα及其相关信号通路介导上皮-间质转化(epithelial-mesenchymal transition,EMT)影响乳腺癌细胞的侵袭过程[4]。目前研究发现miR-301a是一种致癌性miRNA,与结直肠癌和乳腺癌等多种癌症的进展和不良预后有关[5],但miR-301a对雌激素依赖性乳腺癌雌激素受体ERα调控作用研究笔者所见较少。本研究采用双荧光素酶报告试验验证miR-301a与ERα的靶向关系,探讨二者在乳腺癌细胞侵袭及EMT中的调控机制,为治疗提供新的靶点。
1 材料与方法
1.1 材料 细胞株:人乳腺癌细胞MCF7(HZ-CC100452)购自上海沪震实业有限公司。
1.2 细胞培养及实验设计分组
1.2.1 细胞培养:将MCF7细胞从液氮罐中取出,解冻并离心收集细胞,用含10%胎牛血清(美国Hyclone公司)的DMEM培养基(美国Hyclone公司)悬浮细胞并接种于细胞皿中,置于37℃、5%CO2、饱和湿度条件下培养,细胞密度达80%时,对细胞进行传代、计数。
1.2.2 试验设计及分组:收集对数生长期、生长状态好的MCF7细胞,分为control组(不做任何处理,正常培养)、miR-301a mimics组[转染miR-301a激动剂(miR-301a mimics,货号:CMH0147,购自广州威佳科技有限公司)]、miR-301a inhibitiors组[转染miR-301a抑制剂(miR-301a inhibitiors,货号:hsa-mir-301a-3p,购自江苏百奥迈科生物技术有限公司)]、miR-301a MNC组[转染miR-301a激动剂阴性对照试剂(miR-301a MNC)]、miR-301a INC组[转染miR-301a抑制剂阴性对照试剂(miR-301a INC)]。5组均以2×105/孔接种于6孔板上,各转染试剂均按照LipofectamineTM2000转染试剂盒说明书进行转染,转染后48 h收集细胞供后续使用。5组均设置6个复孔,试验重复6次。
1.3 方法
1.3.1 Transwell检测MCF7细胞侵袭情况:将基质胶(美国BD公司)与不含血清的DMEM培养基按1∶8的比例混合稀释后包被在上层小室并风干过夜,在上室中接种1.2.2中5组重悬细胞(细胞密度2×106/ml),下室加入600 μl DMEM培养基(含10% FBS)。培养24 h后去除小室,棉签擦除上室基质胶与细胞,甲醛固定15 min后0.1%结晶紫染色,用IX53倒置显微镜(Olympus Corporation)随机选取5个视野并拍照,取平均值。5组均设置6个复孔,试验重复6次。
1.3.2 双荧光素酶报告:合成ERα的3’非翻译区(3’UTR)的miR-301a识别序列,克隆至pmiRGlo载体,得到pmiRGlo-ERα 3’UTR-WT。另外对miR-301a识别区ERα碱基进行突变连接至pmiRGlo载体,得到pmiRGlo-ERα 3’UTR-MUT,分别将pmiRGlo-ERα-3’UTR-WT、pmiRGlo-ERα-3’UTR-MUT质粒与miR-301a NC、miR-301a mimics共转染,24 h后按照双荧光素酶报告基因检测试剂盒说明书添加萤火虫和海参荧光素酶试剂上机检测。每孔的数值以萤火虫荧光活性/海参荧光活性显示,试验重复6次。
1.3.3 荧光实时定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)法检测miR-301a、ERα mRNA表达情况:收集1.2.2中5组细胞,利用Trizol试剂盒(货号:15596026,购自赛默飞世尔中国公司)抽提细胞总RNA,应用反转录试剂盒(货号:4366597,购自赛默飞世尔中国公司)将1 μg RNA反转录为cDNA。用反转录混合液(5x HOT FIREpol Eva Green qRT-PCR,货号:08-33-00001,购自爱沙尼亚Solis Biodyne)进行qRT-PCR。反应体系为:将2.5 μl含10 ng模板RNA的cDNA与5 μl的预混液(含1.5 μl Eva Green混合液,0.2 μl 10 μmol/L正向和反向特异性引物和3.3 μl H2O)混合,反应条件(95℃持续12 min,95℃持续10 s,60℃持续20 s,72℃持续20 s的38个循环),miR-301a、ERα、均以U6为内参基因,引物由生工生物工程(上海)股份有限公司合成。采用2-ΔΔCt算法计算miR-301a、ERα mRNA相对表达量。见表1。
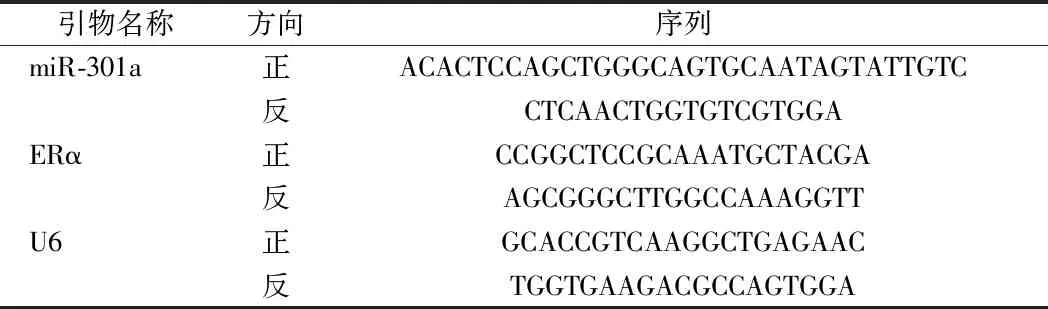
表1 qRT-PCR引物序列
1.3.4 免疫印迹法(Western blot)检测相关蛋白表达情况:收集1.2.2中5组细胞,加入RIPA裂解液,充分裂解后用蛋白提取试剂盒(货号:AM1556,购自赛默飞世尔中国公司)提取总蛋白。使用BCA蛋白试剂盒(货号:23227,购自赛默飞世尔中国公司)测定细胞中总蛋白浓度。将50 μg总蛋白溶解在聚丙烯酰胺(SDS)凝胶上,并印迹到硝酸纤维素膜(BioRad)上,5%脱脂奶粉封闭液封闭1 h后。加入适宜浓度的一抗[ERα(货号:K15071-KFE,购自北京百奥莱博科技)、PR(货号:hz273Hu01,购自上海沪震)、GREB1(货号:bs-3854R-1,购自北京博奥森)、N-cadherin(bs-1172R-1,购自北京博奥森)、Vimentin(货号:abs44057644,购自上海爱必信),各抗体浓度分别为1∶1 000],室温孵育2 h,洗涤后加入二抗(辣根过氧化物酶),室温孵育1 h,洗涤,以β-actin(货号:sc-365062,购自圣克鲁斯生物技术公司)为内参,通过ECL(货号:P0018FA,购自上海碧云天)显影,Alpha凝胶成像系统(New Discovery公司)照相并分析灰度值。每组实验重复6次。
2 结果
2.1 双荧光素酶法检测miR-301a与ERα关系 miRtarbase预测显示,miR-301a与ERα有结合位点。双荧光素酶报告基因检测显示,与miR-301a NC组+ERα-3’UTR-WT组(1.11±0.31)比较,miR-301a mimics+ERα-3’UTR-WT组(0.46±0.11)荧光素酶活性降低(P<0.05),miR-301a NC+ERα-3’UTR-MUT组(1.10±0.29)及miR-301a mimics+ERα-3’UTR-MUT组(1.12±0.30)荧光素酶活性差异无统计学意义(P>0.05)。见图1。

图1 miRtarbase预测miR-301a靶基因a
2.2 5组细胞侵袭情况 与Control组侵袭细胞数(263.62±25.31)相比,miR-301a mimics组侵袭细胞数(372.52±22.17)显著升高(P<0.05);miR-301a inhibitiors组侵袭细胞数(105.65±24.56)显著降低(P<0.05);miR-301a MNC组(261.88±23.27)及miR-301a INC组(261.88±24.27)与Control组相比差异无统计学意义(P>0.05)。见图2,表2。

Control组miR-301aMNC组miR-301aINC组miR-301a mimics组miR-301a inhibitiors组
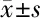
表2 5组细胞侵袭情况 n=6,个,
2.3 5组细胞miR-301a、ERα miRNA相对表达水平 与Control组相比,miR-301a mimics组miR-301a表达升高(P<0.05),ERα miRNA表达降低(P<0.05);miR-301a inhibitiors组miR-301a表达降低(P<0.05),ERα miRNA 表达升高(P<0.05);miR-301a MNC组及miR-301a INC组与Control组相比差异无统计学意义(P>0.05)。见表3。
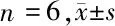
表3 5组细胞miR-301a、ERα miRNA相对表达水平的影响
2.4 5组细胞ERα通路相关蛋白表达的影响 与Control组相比,miR-301a mimics组ERα、PR、GREB1蛋白表达降低(P<0.05);miR-301a inhibitiors组ERα、PR、GREB1蛋白表达升高(P<0.05),miR-301a MNC组及miR-301a INC组与Control组相比差异无统计学意义(P>0.05)。见表4,图3。
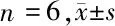
表4 5组ERα、PR、GREB1蛋白表达情况
2.5 5组细胞中EMT标志蛋白的影响 与Control组相比,miR-301a mimics组N-cadherin、Vimentin蛋白表达升高(P<0.05);miR-301a inhibitiors组N-cadherin、Vimentin蛋白表达降低(P<0.05),miR-301a MNC组及miR-301a INC组与Control组相比差异无统计学意义(P>0.05)。见表5,图4。
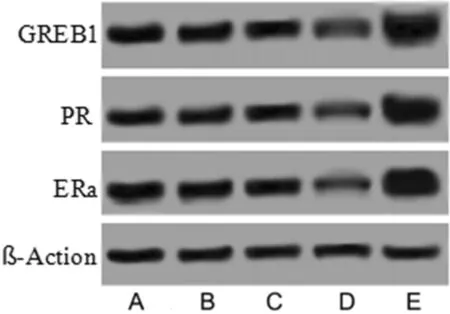
图3 5组ERα、PR、GREB1蛋白表达免疫印迹图;A Control组;B miR-301a MNC组;C miR-301a INC组;D miR-301a mimics组;E miR-301a inhibitiors组
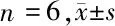
表5 5组N-cadherin、Vimentin蛋白表达情况
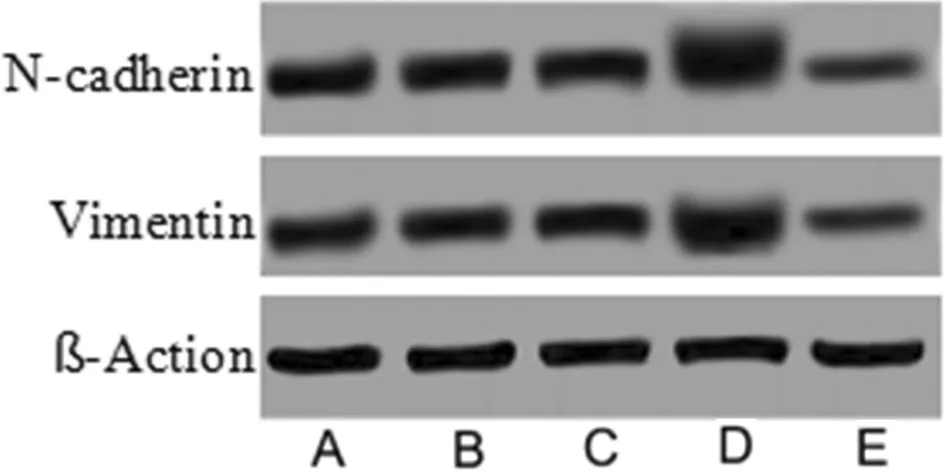
图4 5组细胞N-cadherin、Vimentin蛋白表达免疫印迹图;A Control组;B miR-301a MNC组;C miR-301a INC组;D miR-301a mimics组;E miR-301a inhibitiors组
3 讨论
乳腺癌已成为威胁女性健康的第一大杀手,miR-301a的表达与肿瘤发展、转移和总体预后不良有关。Yin等[6]发现miR-301a上调是三阴性乳腺癌细胞增殖和侵袭的关键因素。本研究发现,MCF7细胞过表达miR-301a后,MCF7侵袭细胞数目显著高于Control组,而抑制miR-301表达后,MCF7侵袭细胞数目显著低于Control组,进一步证实miR-301a参与MCF7细胞侵袭恶性行为学过程。
超过50%的乳腺癌患者被诊断出为雌激素阳性癌症[7],虽然用抗雌激素药物他莫昔芬进行治疗有效且耐受性好,但由于患者雌激素受体丧失,仍有 30%~40%的患者因癌细胞复发转移而死亡[8]。研究发现,ERα的表达可被认为是乳腺癌生存的良好指标,而ERα的丢失表明乳腺癌细胞侵袭性较高和患者预后不良[9]。且ERα可调控下游靶基因PR和GREB1表达参与雌激素信号传导,并调控EMT相关指标E-cadherin及Vimentin蛋白表达,来参与乳腺癌细胞EMT发展及侵袭等恶性行为学过程[10],预示ERα可作为乳腺癌治疗效果和判断预后的重要指标。有研究发现,miR-301a能够抑制雌激素受体ER阳性乳腺癌细胞中的ER信号传导[11],提示miR-301a与ERα可能共同参与乳腺癌雌激素受体传导过程。本研究给乳腺癌MCF7细胞转染miR-301a激动剂和抑制剂后发现miR-301a mimics组细胞,miR-301a表达高于Control组,而ERα mRNA和蛋白及介导的雌激素信号传导通路蛋白PR、GREB1显著降低,EMT相关指标E-cadherin及Vimentin蛋白表达均增高,提示过表达可抑制ERα介导雌激素信号传导通路激活,促进乳腺癌侵袭及EMT发展,这可能是ERα丢失导致乳腺癌预后不良的可能原因。而miR-301a inhibitiors组细胞,miR-301a表达异常低于Control组后,ERα mRNA和蛋白及其介导的雌激素信号传导通路蛋白PR、GREB1却明显升高,细胞侵袭及EMT进程也明显受到抑制,表明miR-301a可能通过靶向作用于ERα,通过ERα介导雌激素信号传导通路活化来参与乳腺癌侵袭及EMT过程。本研究发现转染miR-301a mimics与WT-ERα后,双荧光素酶活性明显抑制,提示miR-301a对MCF7细胞中ERα基因发挥抑制作用。
综上所述,miR-301a过表达可抑制ERα及相关通路蛋白表达,促进癌细胞侵袭和EMT,抑制miR-301a表达,可上调ERα及相关通路表达,抑制癌细胞侵袭和EMT。miR-301a可能作为MCF7细胞雌激素受体的潜在靶标。

