鱼类工厂化循环水人工繁育设施装备应用研究进展
张宇雷,张瑜霏,单建军,黄 达,高倩倩
鱼类工厂化循环水人工繁育设施装备应用研究进展
张宇雷1,2,张瑜霏1,2,单建军1,2,黄 达1,高倩倩1
(1. 中国水产科学研究院渔业机械仪器研究所,上海 200092;2. 农业农村部水产养殖设施工程重点实验室,上海 200092)
水产种业的高质量发展是推动养殖业发展的基础,现阶段中国鱼类人工繁育生产方式设施装备化程度低,产业大而不强,转型升级的需求迫在眉睫。该研究在文献调研整理的基础上,首先就循环水人工繁育设施装备在亲鱼产卵、鱼卵孵化、鱼苗培育等方面的研究和应用情况展开论述。相对于常规培育方式,循环水系统能够最大程度上构建出符合亲鱼交配和产卵的环境条件,养殖密度0.01~4.5 kg/m3,系统循环率9~76%/h,换水率0.7~3%/d;针对不同性质的鱼卵,介绍了国内外目前常用的孵化器主要有瓶式孵化罐、平列式孵化槽、漏斗式孵化器等,阐明了其适用对象、工作原理和主要性能表现;针对育苗和养殖系统构建需求的差异,综述了目前在循环水育苗设施装备应用研究中关注的重点和难点。其次,概述了中国鱼类人工繁育发展现状和问题,分析了循环水人工繁育技术的优势和面临的挑战。最后提出,鱼类工厂化循环水人工繁育具有较高的可行性和引领性,但是要实现产业化应用仍需要进一步开展基于品种对象的人工繁育环境构建及循环水处理、繁育过程鱼类对环境应激源的生物学响应、智能繁育装备等方面技术攻关和装备研发。
水产;循环水繁育;人工繁殖;鱼卵孵化;苗种培育
0 引 言
苗种作为水产养殖产业的重要投入要素之一,是开展水产养殖生产的重要物质基础与保障。苗种的质量在一定程度上决定了水产养殖业的生产效率,关系到整个养殖产业的发展前景[1-3]。中国鱼类苗种产业起步于20世纪50年代,经过70余年的发展,淡水鱼苗种产量基本维持在1.2~1.3万亿尾,海水鱼苗产量近10年增涨较快,从2010年44.5亿尾到2020年116.6亿尾,增幅比例达162%[4]。苗种的稳定供给为养殖业的快速发展提供了坚实保障。
鱼类人工繁育是一项复杂而精细的工作,为了满足亲鱼性腺发育、交配、产卵以及受精卵孵化、幼鱼摄食、发育等各方面的需求,需要对养殖过程温、光、声、水质等关键环境因子进行精准控制,以充分保证鱼苗的产量和质量。现阶段中国鱼类规模化人工繁育采用的生产方式仍相对粗放,大部分苗种场设施装备比较简陋,对于气候和资源的依赖性较高,生产管理的装备化和现代化水平与发达国家相比存在较大差距[5]。
工厂化循环水人工繁育通过环境工程、土木建筑、现代生物、电子信息等领域先进技术和装备的有机集成,能够更准确地构建出符合鱼类生理和行为需求的环境条件,是目前国内外循环水养殖应用技术研究的重点方向之一。分析掌握相关领域研究进展对于中国鱼类苗种产业技术转型升级,改变落后的整体面貌,实现产业提质增效具有重要的参考和借鉴意义。
1 循环水繁殖设施装备
1.1 亲鱼产卵
亲鱼的健康状况和培育环境很大程度上决定了鱼卵的产量和质量,相对于常规培育方式,循环水人工繁殖能够通过人工干预最大程度上构建出符合亲鱼性腺发育、交配和产卵的环境条件。Boccanfus等[6]通过使用循环水人工繁殖系统模拟光、温、盐季节变化,研究了其对牙鲆()亲鱼产卵和孵化率的影响,结果表明,2015-2018年间牙鲆亲鱼产卵总数增加92.8%,受精卵孵化率从38.1%提高至61.0%。Okumura等[7]发现赤点石斑()在40 m3容积亲鱼池中产出受精卵数量仅是在350 m3亲鱼池中的一半,主要原因是亲鱼交配时没有足够的游动空间,出现不正常的跳跃现象。从系统配置情况来看,现有研究采用的循环水人工繁殖系统水处理工艺与成鱼养殖系统相似,主要通过介质过滤和蛋白分离技术去除固体颗粒,通过生物反应器分解去除氨氮,通过紫外杀菌对水体进行消毒处理,通过热泵实时控制系统水温。由于养殖密度较常规养殖系统要低,系统循环率(即单位时间内从鱼池流入循环水处理系统的水体体积占鱼池总水体的比例)一般设定在30 %/h以下(表1)。
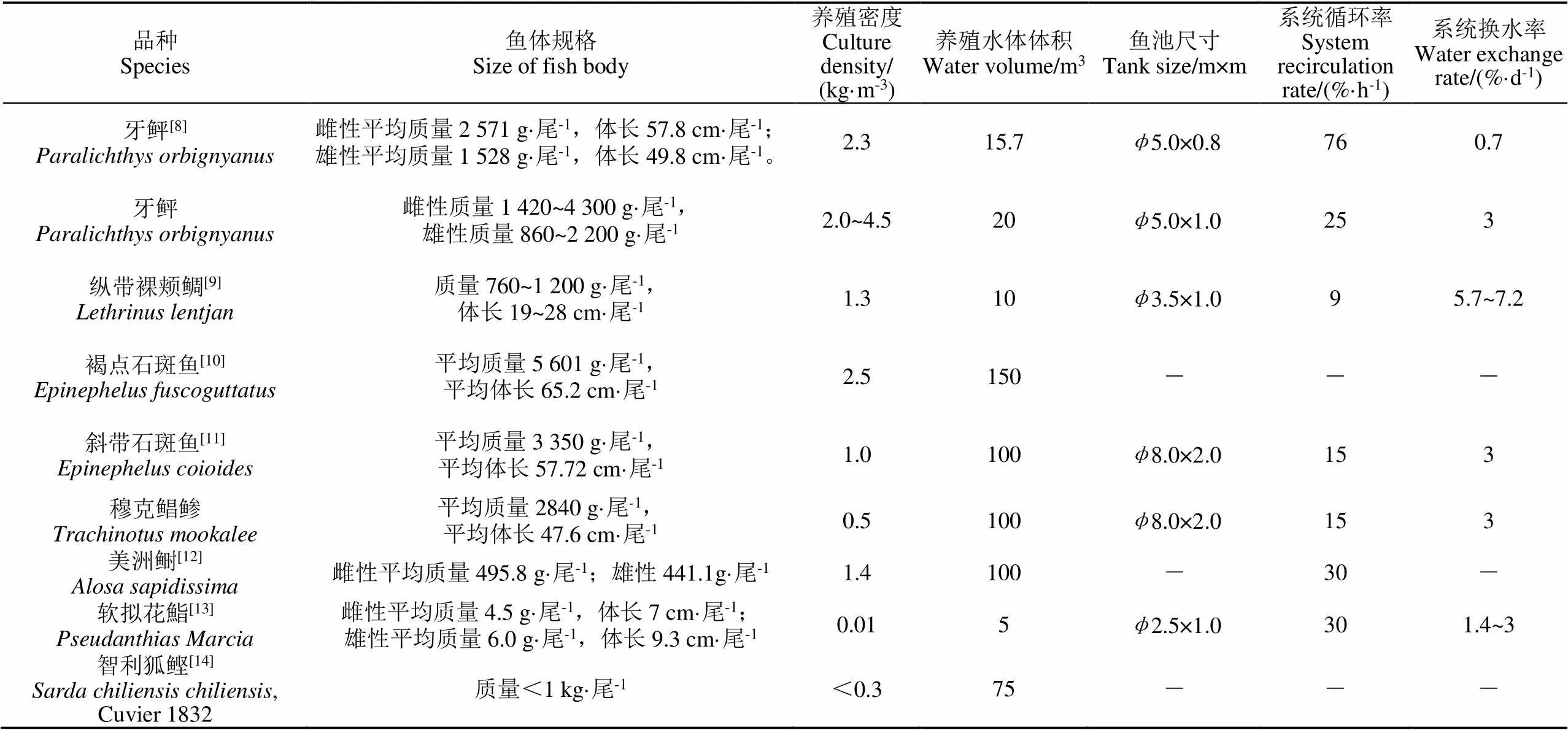
表1 循环水繁殖设施研究对象和配置情况
总结相关研究进展认为,在循环水人工繁殖系统中可以实现石斑、牙鲆、鲥鱼等品种的正常交配和繁殖生产,但是存在的问题也很明显:首先,由于鲜活饵料投喂,导致养殖池底沉积物较多,人工清理的工作量较大;其次,光、温、盐等环境因子调节容易导致系统水质的波动造成鱼类应激;催产、交配和产卵等行为的把控主要依赖于经验,可复制性低;最后,由于水体的循环流动容易导致鱼卵流失。当然,不同品种繁殖所需条件的差异性也较大,需要进一步针对性和系统性的开展相关生物学研究工作,为系统构建提供理论依据。
1.2 鱼卵孵化
根据质量比不同鱼卵分为沉性卵、浮性卵和漂流性卵等;根据卵粒粘性又分成无粘性卵和粘性卵。针对不同性质的受精卵,国内外目前常用的孵化器主要有以下几种:
1)瓶式孵化罐(mcdonald-type hatching jar)。罐体由透明、易清洁的塑料制成,工作原理简单可靠。干净水流从罐体中心导流管注入,从底部流出,通过上升水流的带动使沉底鱼卵形成漂浮和流动状态,保证与水流的充分接触。罐体顶部安装过滤网,可防止鱼卵随水流溢出,上升水流经过滤网后从溢流口排出孵化器。鱼卵孵化后取下滤网,即可使仔鱼随水流流出。该孵化罐主要用于鲑鳟类、鲟鱼、鲈鱼、鲤鱼等沉性鱼卵的孵化,1个6 L的瓶式孵化罐可容纳约10万粒鲑鱼卵(图1)。
2)平列式孵化槽(california-type incubation troughs)。通常由玻璃钢或强化塑料制成,槽内放置4~8个底部和侧面穿孔透水的孵化托盘,托盘隔板延伸至槽底以阻挡水流(图2)。通过这种方式,可使水流逐一从托盘底部流入,流经鱼卵层后再从上部溢出。新孵化的仔鱼亦可通过网孔流出托盘,待所有鱼卵孵化后,可将托盘连同剩余的死卵一起取出。该孵化器主要适用于质量比大,需要静置或者是彼此大量粘附的鱼卵,如鲑鳟类、斑点叉尾鮰、鲶鱼等,每80~100 L水体可容纳100~150 g鱼卵。抽屉式孵化柜(Vertical Incubators)工作原理和平列式孵化槽比较类似,但是孵化托盘采用垂直布置,水流从上而下流经每个托盘,结构更紧凑,占地面积更小,但是水体空间不大,鱼苗孵化后必须立即转移。
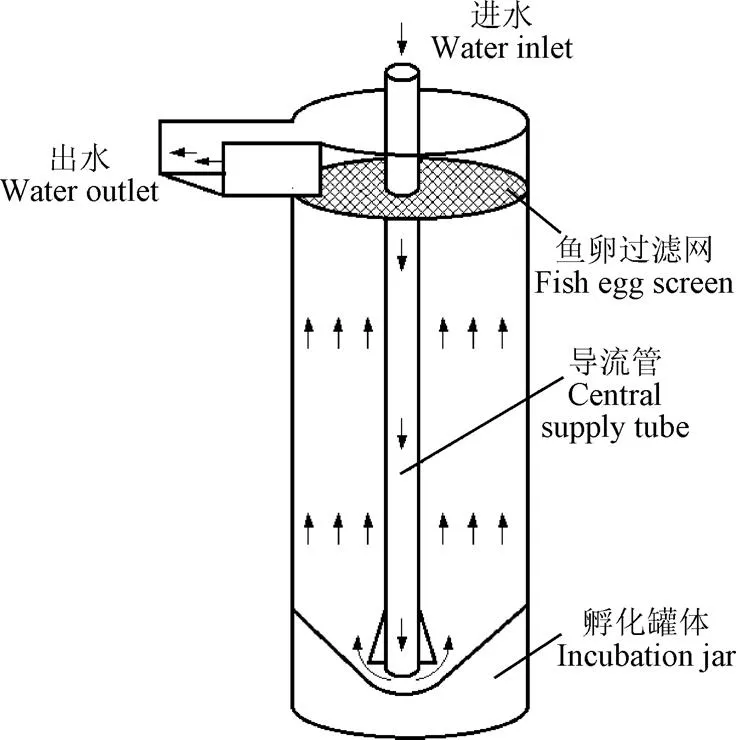
图1 瓶式孵化罐[15]
1.进水管;2.孵化托盘;3.受精卵;4.鱼卵过滤网;5.溢流出水口;6.孵化槽
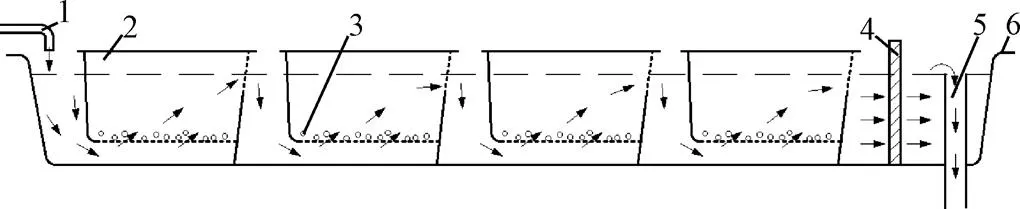
3)漏斗式孵化器(funnel type incubators)。罐体由玻璃纤维、钢板或工程塑料制成,容量40~200 L不等。干净水从罐底部流入,从培养箱的上边缘流出,水体流动使鱼卵悬浮并保持不停的翻滚。为防止鱼卵或鱼苗随流水溢出,罐体顶部安装过滤网。该类型孵化器可用于鳙鱼、鲤鱼、锦鲤、鲶鱼等鱼卵的孵化(图3)。
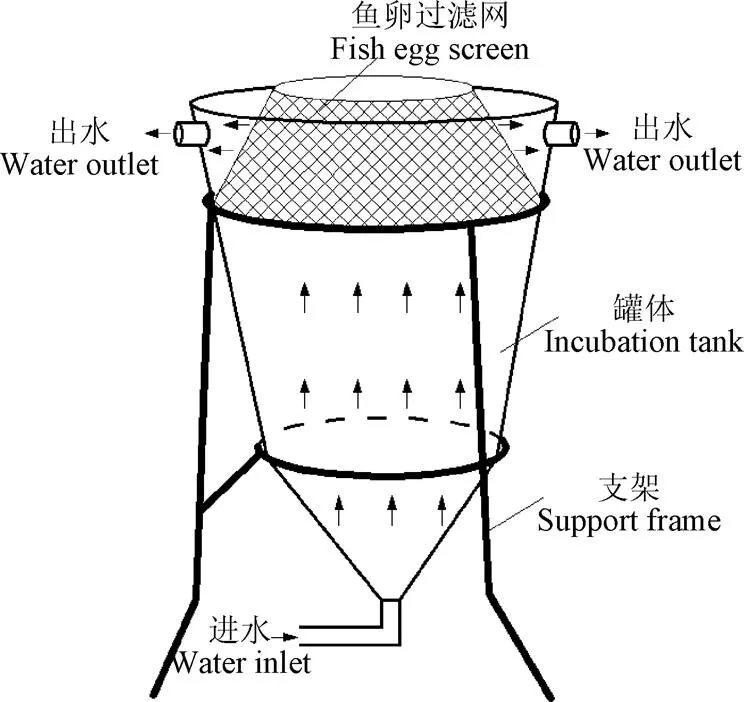
图3 漏斗式孵化器[17]
图4显示了一套典型的大西洋鲑鱼循环水孵化系统工艺流程图[18],鱼卵孵化阶段和鱼苗破膜早期(卵黄囊吸收阶段)不需要添加外源性饲料,因此在循环水孵化系统水处理环节中主要考虑水温控制、增氧及消毒杀菌。但是,Irani等[19]研究发现,可能是由于氨氮累积的原因,循环水孵化的虹鳟仔鱼的脂肪含量和抗氧化酶活性均低于流水系统。Robinson等[20]也发现,与流水孵化相比,循环水孵化的大西洋鲑仔鱼表皮较薄,骨骼矿化较少,环境差异是导致该现象的主要原因,但是具体机理机制尚不清晰。另外,也有研究提出,循环水系统中孵化酶的累积可能会导致仔鱼提前破膜,影响后期发育的问题[21-22]。
图5显示的是Mordenti等[23]设计研制的欧洲鳗鲡产卵、孵化一体化装置,配备1套循环水处理系统(包括蛋白分离器、生物滤器、紫外杀菌、臭氧混合等设备)。该设计的最大优势在于能够通过水流的作用使得产出的受精卵从产卵腔自动流入孵化腔,避免了人工转移鱼卵的操作。试验结果显示,胚胎24 h存活率达到62.8%±17.5%。
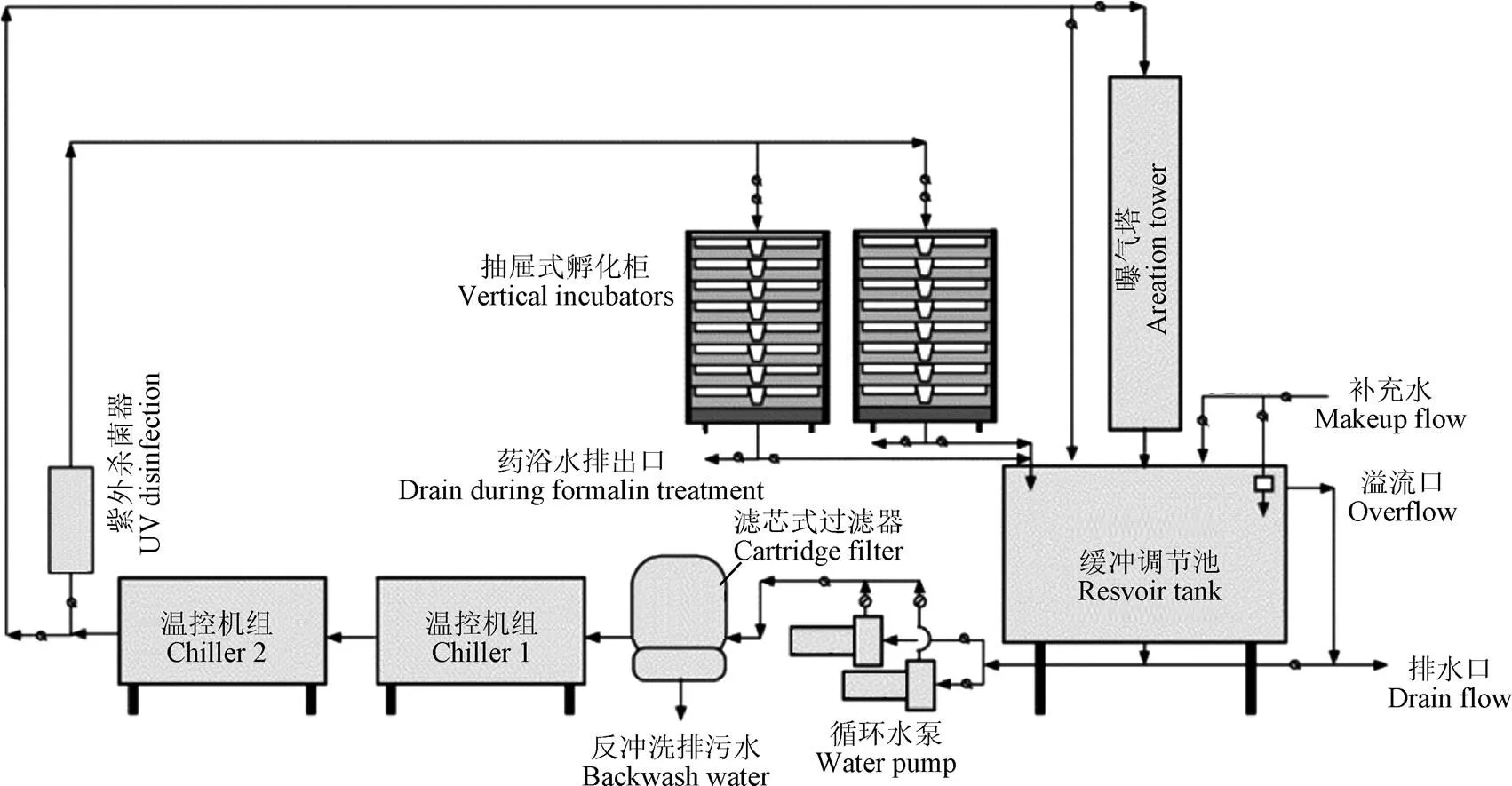
图4 MCRA育苗场循环水孵化系统工艺流程图[18]
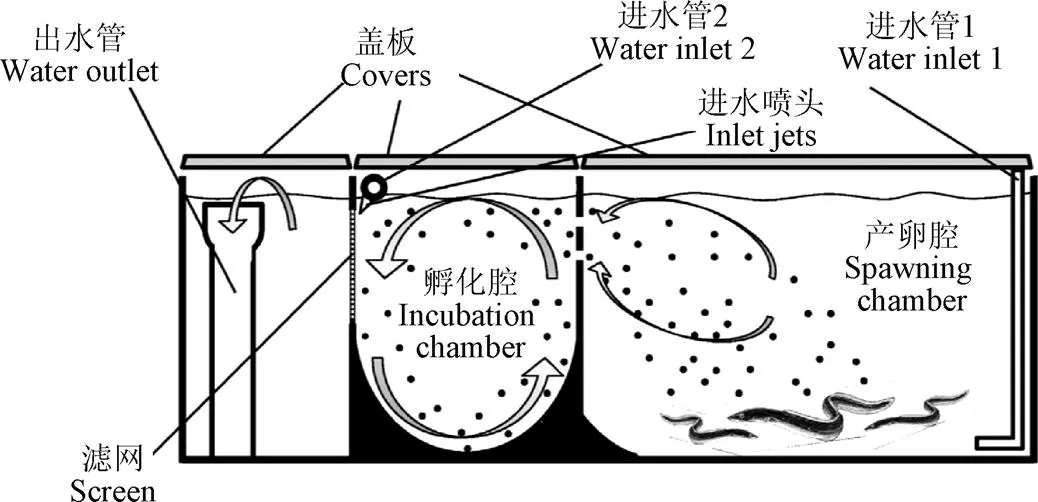
图5 欧洲鳗鲡封闭循环水育苗系统原理图[23]
2 循环水育苗设施装备
与成鱼相比,仔稚鱼生长发育和体态变化过程较多,营养需求高,饵料种类复杂;免疫系统和肠道功能不完全,对环境因子变化更敏感,病害抵抗能力弱;规格小、体质量轻,游泳和主动摄食能力弱。这些差异是循环水育苗系统区别于成鱼养殖系统的重要原因,也是目前循环水育苗技术领域的研究重点。
藻类、轮虫、卤虫等是仔鱼前期生长发育最常用的生物饵料,而这些饵料的使用往往导致水体中细菌的增加[24-26]。Attramadal等[27-31]通过一系列的研究认为,虽然循环水育苗系统中的水质相对于流水系统要略差,但是,借助成熟的生物滤器和科学的消毒杀菌策略,能够在水体中构建形成稳定的细菌群落,抑制条件致病菌的比例,提高幼鱼生长和存活率。此外,鱼类早期生活和饲养条件决定了肠道中的微生物群落组成,进一步影响幼鱼的免疫和组织学发育,对鱼类健康和生长起着至关重要的作用[32-36]。Deng等[37]研究发现,在循环水育苗系统中添加枯草芽孢杆菌()可增加罗非鱼肠道中细菌微生物丰度,幼鱼存活率显著高于流水方式和未添加枯草杆菌的循环水系统。另外,仔稚鱼前期几乎没有什么游泳能力,过高或过低的水流都有可能导致鱼类无法正常游泳和摄食。针对该问题, Shiotania等[38-42]深入研究了鱼池形状以及曝气方式对真鲷、石斑和金枪鱼仔鱼生长的影响。总体认为,水体内的流场分布对于幼鱼的存活率影响较大,圆形育苗池在曝气的作用下形成的流场分布相对更均匀稳定,相对于矩形育苗池成活率更高,但是特定生长率没有显著差异。此外,为了保证仔稚鱼更好的觅食,鱼池的颜色和环境光线的调控也是研究的重点[43-45]。
3 分析与展望
中国现阶段规模化人工繁育主要采用池塘、网箱和工厂化流水三种方式。池塘繁育方式的应用最为普遍,以青鱼()、草鱼()、鲢鱼()、鳙鱼()等淡水鱼为典型代表。该方式一般会根据实际情况设置亲鱼培养池、产卵池、孵化池、苗种培育池等,配备水泵、增氧机、鼓风机等设备。亲鱼培养池主要用于亲鱼营养强化和催产;产卵池0.1~1 hm2,水深1.5~2.5 m不等,底泥厚度10~30 cm不等;塘内放置若干产卵巢用于收集卵块,通过增氧机维持溶解氧,通过增加水泵加大水流速度;鱼卵一般在室内采用微流水方式孵化后再放入苗种培育池(0.2~0.4 hm2)进行培育[46-49]。该方式投入少,成本低,而且池塘中天然饵料较为丰富,鱼苗营养可以得到充分保证,存活率较高。但是,缺点在于受气候和外源性干扰影响较大,产能不高、稳定性不足。工厂化流水繁育方式更多地应用在冷水性鱼类和海水鱼繁育,主要设施包括亲鱼培育池和产卵池(5 m×5 m左右)以及苗种培育池(3 m×3 m左右),通过连续不断的微流水结合相应的温、光调控设备保证养殖环境和水质符合繁育要求[50-51]。该方式优点在于环境可控性相对较高,水质更稳定、产能较高。但是,缺点在于对水源条件的要求较为苛刻,而且由于营养来源比较单一,鱼苗生长发育速度不如池塘方式。网箱培育方式相对较少,主要品种包括石斑鱼()、军曹鱼()等。在海水中一般使用5 m×5 m左右的网箱,在池塘中一般为2 m×2 m或者3 m×3 m的网箱进行亲鱼培育和产卵,需要和池塘或者流水池相结合,完成受精卵孵化和鱼苗培育[52-54]。现阶段国内鱼类人工繁育的成活率普遍不高,生物学、行为学、水环境等方面的问题相互交叉影响,难以进行科学严谨地分析判断。以具有典型代表性的大黄鱼()为例,其人工繁育生产主要采用工厂化流水或微流水方式,受精卵孵化率在90%左右,而出苗率不到30%。其中,死亡高峰主要出现在受精卵孵化后3日龄左右,仔鱼开口摄食阶段;另外,在10~20日龄左右也会出现一定比例的死亡,主要是由于水质条件变化以及自相残杀等方面的原因。
相对于传统繁育方式,工厂化循环水人工繁育的主要优势在于:1)环境高度可控,产能和品质更稳定。通过技术集成人为构建出符合对象需求的环境条件,更容易保证苗种生产的高效性和稳定性;2)资源节约,环境友好。循环水技术能够实现90%以上的养殖水体循环利用,可有效减少对水资源的消耗,避免面源污染等问题的进一步严重化。
当然,循环水人工繁育技术目前存在的弊端也很明显,主要是:1)针对性的繁育工艺和技术尚不成熟。现有繁育技术基本都是基于开放环境,无论是营养源、水化学成分、微生物等条件均与封闭系统存在较大差异,需要形成针对性的循环水繁育工艺技术来保证使用效果;2)系统维护和设备操作技术要求较高。循环水人工繁育系统中需要集成水处理、自动化、信息化等各种不同类型的设施和装备,及时的维护和规范的操作是保证系统正常运行的必要前提,导致生产管理难度和运维成本会有明显增加。
综合以上可以看出,鱼类工厂化循环水人工繁育具有较高的可行性和引领性,但是要实现产业化应用仍需要攻克一系列的技术难题,研究方向主要包括以下几个方面:
1)繁育过程鱼类对环境应激源的生物学响应。鱼类繁育是一个非常复杂的生物学过程,涉及营养学、免疫学、微生物学、行为学、环境生态学等多个领域。传统繁育技术研究侧重在如何实现特定品种的人工催产、鱼卵孵化、仔稚鱼中间培育、幼鱼培育等方面,是所有繁育生产方式的基础前提。不同的是,在循环水人工繁育系统中,所有环境要素都是由人为进行干预控制的,因此对繁育过程的环境生态学研究提出了更高的要求,更准确地掌握亲本、鱼卵、幼鱼的生长发育过程及其对环境应激源的生物学相应,是系统构建和高效运行的根本保障。
2)基于品种对象的人工繁育环境构建及循环水处理技术研究。不同鱼类品种无论是亲鱼、受精卵还是仔稚鱼,其生理习性、物理特性、环境需求等或多或少都存在一定的差异,而且由于循环水系统水体封闭循环,会导致一部分难降解物质在水中长期累积,如类固醇、孵化酶、生物滤器细菌代谢产物和重金属等[55],需要针对性的开发相应的循环水处理技术,建立科学合理的系统配置工艺,构建出符合对象生理和行为需求的繁育环境。同时,在水产养殖工业化发展的现代,人工繁育系统的创新更要体现宜机化、数字化、模块化等特点,朝渔业无人化方向发展。
3)智能繁育装备技术研发。亲鱼的选择对于产卵的数量和产量都有重要的影响。目前,对于亲鱼的筛选主要采用传统形态学测量方法,参数局限性较大,精准程度低,细微差别无法测量;测量过程时间长,容易造成鱼体损伤。采用信息化技术手段研发智能化的亲鱼性状评估技术和装备可以通过非入侵方式对鱼类表观形态、行为轨迹等进行更客观地分析,筛选出状态优异的鱼作为产卵亲本,无论对于育苗产业还是科学研究都具有重要的价值。此外,相对成鱼来说,仔稚鱼数量密集、体形微小,体质脆弱,各方面生产作业和管控难度都大幅增加。养殖人员对于水质和仔鱼状态的评估几乎完全依赖经验,24h轮班工作来完成饵料投喂、鱼情观察和鱼池清理等工作,导致鱼苗生产的不可控性大幅增加。利用机器视觉、深度学习、人工神经网络等前沿技术研发智能繁育装备技术,实现受精卵/仔稚鱼在线计数、鱼情评估、饵料丰度实时分析、鱼苗智能投喂和柔性分池起捕,能够大幅提高鱼苗生产的机械化水平,解决人工作业的主观性和不稳定性,是实现鱼苗工业化生产不可或缺的硬件保障,具有广阔的市场需求和发展前景。
4 结 论
水产种业的高质量发展是推动养殖业发展的基础,现阶段中国鱼类人工繁育采用的生产方式仍相对粗放,产业规模大但效率不高、质量不稳定,生产方式的转变和设施装备的提升已经迫在眉睫。开展鱼类工厂化循环水人工繁育设施装备应用技术研究具有重要的意义。
1)循环水人工繁殖系统水处理工艺主要由介质过滤、蛋白分离、生物过滤、紫外杀菌等环节组成,结合对光、温、盐等环境因子的精准调控,可以实现石斑、牙鲆、鲥鱼等品种正产交配和产卵,且产卵率和受精率都有明显提高。但是,仍存在池底清理难度大、鱼卵易流失、生产过程智能化程度低等问题。
2)瓶式孵化罐、平列式孵化槽和漏斗式孵化器是目前国内外较为常用的鱼卵孵化设备。循环水孵化系统目前在大西洋鲑、虹鳟等冷水性鱼类上的应用较多,水处理工艺主要考虑控温、增氧及消毒杀菌。同时,封闭水环境对受精卵和仔鱼发育及生长的影响及其机理问题是目前亟需攻克的难点。
3)循环水育苗设施装备的研究方向涵盖了鱼池结构工艺、流态和流场构建、高效水处理和微生物调控等,以更好地满足幼鱼生长生理的需求。
现阶段鱼类工厂化循环水人工繁育设施装备应用技术的研究在中国刚刚起步,不仅需要加快鱼类繁育过程对封闭水环境中应激源的生物学响应研究;更需要加快智能繁育装备技术研发,创新工业化的繁育系统和模式,实现“人管机器,机器管鱼”,将成为今后的产业发展的重要方向。
[1] 操建华,孙东升. 中国现代水产种业创新发展的路径思考[J]. 农业现代化研究,2021,42(3):377-389.
Cao Jianhua, Sun Dongsheng. The innovative development path of modern aquaculture seed industry in China[J]. Research of Agricultural Modernization, 2021, 42(3): 377-389. (in Chinese with English abstract)
[2] 中国水产杂志编辑部. 中国水产种业发展报告(1949-2019年)[J]. 中国水产,2020(9):11-21.
[3] 张安琪. “十四五”时期水产种业发展的现状与对策思考[J]. 北方经济,2021(12):41-44.
[4] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会. 中国渔业统计年鉴(2011-2021)[M]. 北京:中国农业出版社.
[5] 张宇雷,倪琦,刘晃,等. 挪威大西洋鲑鱼工业化养殖现状及对中国的启示[J]. 农业工程学报,2020,36(8):310-315.
Zhang Yulei, Ni Qi, Liu Huang, et al. Status quo of industrialized aquaculture of Atlantic salmon in Norway and its implications for China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(8): 310-315. (in Chinese with English abstract)
[6] Boccanfuso J J, Abud E O A, Berrueta M. Improvement of natural spawning of black flounder,(Valenciennes, 1839) by photothermal and salinity conditioning in recirculating aquaculture system[J]. Aquaculture, 2019, 502: 134-141.
[7] Okumura S, Okamoto K, Oomori R, et al. Improved fertilization rates by using a large volume tank in red spotted grouper ()[J]. Fish Physiology and Biochemistry, 2003, 28: 515-516.
[8] Bambill G A, Oka M, Radonić M, et al. Broodstock management and induced spawning of flounder(Valenciennes, 1839) under a closed recirculated system[J]. Revista de Biología Marina y Oceanografía, 2006, 41(1): 45-55.
[9] Anil M K , Gomathi P, Sugi V V, et al. Captive maturation, breeding and seed production of Pink ear emperor,(Lacepede, 1802) (Family: Lethrinidae) in recirculating aquaculture system (RAS)[J]. Aquaculture, 2019, 503: 207-216.
[10] Mustafa S, Hajini M H, Senoo S, et al. Conditioning of broodstock of tiger grouper,, in a recirculating aquaculture system[J]. Aquaculture Reports, 2015, 2: 117-119.
[11] Ranjan R, Megarajan S, Xavier B, et al. Design and performance of recirculating aquaculture system for marine finfish broodstock development[J]. Aquacultural Engineering, 2019, 85: 90-97.
[12] Liu Q H, Zheng Y H, Fu L, et al. Brood-stock management and natural spawning of American shad () in a recirculating aquaculture system[J]. Aquaculture, 2021, 532: 735952.
[13] Anil M K, Gomathi P, Raheem P K, et al. Captive broodstock development, breeding and seed production of Anthid fish (family: Serranidae) Marcia's anthias,in recirculation aquaculture system (RAS)[J]. Aquaculture, 2018, 492: 265-272.
[14] Pepe-Victoriano R, Miranda L, Ortega A, et al. First natural spawning of wild-caught premature south pacific bonito (, Cuvier 1832) conditioned in recirculating aquaculture system and a descriptive characterization of their eggs embryonic development[J]. Aquaculture Reports, 2021, 19: 100563.
[15] Happer C J, Wrege B M, Isely J J. Striped bass, morone saxatilis, egg incubation in large volume jars[J]. Journal of the World Aquaculture Society, 2010, 41(4): 633-639.
[16] Delince G A, Cambell D, Janssen J A L, et al. Seed production[Z/OL].1987[2022-06-29]. https://www.fao.org/3/ac182e/ AC182E00.htm#TOC.
[17] Woynarovich E, Horváth L. The artificial propagation of warm-water finfishes-A manual for extension[Z/OL]. 1980[2022-06-29]. https://www.fao.org/3/ac742e/AC742E00.htm#TOC.
[18] Summerfelt S T, Wilton G, Roberts D, et al. Developments in recirculating systems for Arctic char culture in North America[J]. Aquaculture Engineering, 2004, 30: 31-71.
[19] Irani A, Noori F. Comparative study on the biochemical factors and antioxidant enzymes of rainbow trout eggs and larvae in a recirculating and flow-through system[J]. Aquaculture, 2020, 523: 735202.
[20] Robinson N, Karlsen C, Ytteborg E, et al. Skin and bone development in Atlantic salmon () influenced by hatchery environment[J]. Aquaculture, 2021, 544: 737155.
[21] Martins C I M, Pistrin M G, Ende S S W, et al. The accumulation of substances in Recirculating Aquaculture Systems (RAS) affects embryonic and larval development in common carp[J]. Aquaculture, 2009, 291: 65-73.
[22] Hagenmaier H E. The hatching process of fish embryos: IV. The enzymological properties of a highly purified enzyme (chorionase) from the hatching fluid of the rainbow trout,rich[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1974, 49(2): 313-324.
[23] Mordenti O, Casalini A, Mandelli M, et al. A closed recirculating aquaculture system for artificial seed production of the European eel (): Technology development for spontaneous spawning and eggs incubation[J]. Aquacultural Engineering, 2014, 58: 88-94.
[24] Blancheton J P, Canaguier B. Bacteria and particulate materials in recirculating seabass () production system[J]. Aquaculture,1995, 133: 215-224.
[25] Olsen A I, Attramadal Y, Jensen A, et al. Influence of size and nutritional value of Artemia franciscana on growth and quality of halibut larvae () during the live feed period[J]. Aquaculture, 1999, 179: 475-487.
[26] Skjermo J, Vadstein O. Characterization of the bacterial flora of mass cultivated[J]. Hydrobiologia, 1993, 255: 185-191.
[27] Attramadal K J K, Salvesen I, Xue R Y, et al. Recirculation as a possible microbial control strategy in the production of marine larvae[J]. Aquacultural Engineering, 2012, 46: 27-39.
[28] Attramadal K J K, Oie G, Storseth T R, et al. The effects of moderate ozonation or high intensity UV-irradiation on the microbial environment in RAS for marine larvae[J]. Aquaculture, 2012, 330: 121-129.
[29] Attramadal K J K, Truong T M H, Bakke I, et al. RAS and microbial maturation as tools for K-selection of microbial communities improve survival in cod larvae[J]. Aquaculture, 2014, 432: 483-490.
[30] Attramadal K J K, Minniti G, Oie G, et al. Microbial maturation of intake water at different carrying capacities affects microbial control in rearing tanks for marine fish larvae[J]. Aquaculture, 2016, 457: 68-72.
[31] Attramadal K J K, Oien J V, Kristensen E, et al. UV treatment in RAS influences the rearing water microbiota and reduces the survival of European lobster larvae ()[J]. Aquacultural Engineering, 2021, 94: 102176.
[32] Dehler C E, Secombes C J, Martin S A M. Environmental and physiological factors shape the gut microbiota of Atlantic salmon parr (L.)[J]. Aquaculture, 2017, 467: 149-157.
[33] Giatsis C, Sipkema D, Smidt H, et al. The impact of rearing environment on the development of gut microbiota in tilapia larvae[J]. Scientific Reports, 2015, 5: 18206.
[34] Rawls J F, Samuel B S, Gordon J I. Gnotobiotic zebrafish reveal evolutionarily conserved responses to the gut microbiota[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(13): 4596-4601.
[35] Nayak S K. Role of gastrointestinal microbiota in fish[J]. Aquaculture Research, 2010, 41: 1553-1573.
[36] Vadstein O, Bergh O, Gatesoupe F J, et al. Microbiology and immunology of fish larvae[J]. Reviews in Aquaculture, 2013, 5(1): 1-25.
[37] Deng Y L, Verdegem M C J, Eding E, et al. Effect of rearing systems and dietary probiotic supplementation on the growth and gut microbiota of Nile tilapia () larvae[J]. Aquaculture, 2022, 546: 737297.
[38] Shiotania S, Hagiwara A, Sakakura Y, et al. Estimation of flow in a rearing tank of marine fish larvae by simplified numerical computation: a case of two-dimensional flow[J]. Aquacultural Engineering, 2005, 32: 465-481.
[39] Sumida T, Kawahara H, Shiotani S, et al. Observations of flow patterns in a model of a marine fish larvae rearing tank[J]. Aquacultural Engineering, 2013, 57: 24-31.
[40] Sakakura Y, Yamazaki W, Takakuwa Y, et al. Flow field control in marine fish larviculture tanks: Lessons from groupers and bluefin tuna in Japan[J]. Aquaculture, 2019, 498: 513-521.
[41] Win A N, Yamazaki W, Hasegawa T, et al. Effect of tank shape on survival and growth of Pacific bluefin tunalarvae[J]. Aquaculture, 2020, 524: 735283.
[42] Win A N, Yamazaki W, Sumida T, et al. Effects of tank shapes and aerations on survival, growth and swim bladder inflation of red seabreamlarvae[J]. Aquaculture Reports, 2020, 18: 100451.
[43] Bera A, Kailasam M, Mandal B, et al. Effect of tank colour on foraging capacity, growth and survival of milkfish () larvae[J]. Aquaculture, 2019, 512: 734347.
[44] McLean E. Fish tank color: An overview[J]. Aquaculture, 2021, 530: 735750.
[45] Cobcroft J M, Battaglene S C. Jaw malformation in striped trumpeterlarvae linked to walling behaviour and tank colour[J]. Aquaculture, 2009, 289: 274-282.
[46] 黄标武,林旭吟,曾瑞娟,等. 黄金石斑鱼苗种繁育技术[J]. 中国水产,2021(7):78-79.
[47] 李潇轩,杨志强,马行空,等. 锦鲤苗种繁育及成鱼养殖技术[J]. 科学养鱼,2017(8):84-86.
[48] 罗曼. 鳡鱼规模化繁养殖技术[J]. 当代水产,2016,41(5):80-82.
[49] 周志金,胡大雁,朱强. 浙北地区大口黑鲈“优鲈1号”苗种规模化早繁技术[J]. 科学养鱼,2016(2):8-9.
[50] 吴锦辉,林佩玲,黄锦雄,等. 工厂化循环水育苗技术[J]. 农业与技术,2020,40(6):137-138.
[51] 孙中之,柳学周,徐永江,等. 漠斑牙鲆工厂化苗种繁育试验[J]. 海洋水产研究,2008,29(6):57-62.
Sun Zhongzhi, Liu Xuezhou, Xu Yongjiang, et al. Experiment on the industrial scale seedling rearing of southern flounder[J]. Marine Fisheries Research, 2008, 29(6): 57-62. (in Chinese with English abstract)
[52] 杨薇,符书源,郭仁湘,等. 鞍带石斑鱼人工繁殖技术研究[J]. 现代农业科技,2011(2):320-322.
Yang Wei, Fu Shuyuan, Guo Renxiang, et al. Research on artificial propagation technology of[J]. Modern Agricultural Science and Technology, 2011(2): 320-322. (in Chinese with English abstract)
[53] 刘新富,庄志猛,孟振,等. 七带石斑鱼人工繁育技术研究进展[J]. 中国水产科学,2010,17(5):1128-1136.
Liu Xinfu, Zhuang Zhimeng, Meng Zhen, et al. Progress of artificial breeding technique for seven-band grouper[J]. Journal of Fishery Sciences of China, 2010, 17(5):1128-1136. (in Chinese with English abstract)
[54] 关忠志,牟均素,衣维国. 鸭绿江斑鳜水库网箱育苗试验[J]. 河北渔业,2009(9):22-47.
[55] Martins C I M, Ochola D, Ende S S W, et al. Is growth retardation present in Nile tilapia Oreochromis niloticus cultured in low water exchange recirculating aquaculture systems[J]. Aquaculture, 2009, 298: 43-50.
Review of progress on fish breeding and seed production using Recirculating Aquaculture System (RAS)
Zhang Yulei1,2, Zhang Yufei1,2, Shan Jianjun1,2, Huang Da1, Gao Qianqian1
(1.200092,;2.200092,)
Fish seed is one of the primary input materials for the large-scale production in aquaculture industry. In this review, a systematic summary was firstly made on the artificial fish breeding, hatchery, and larval rearing using Recirculating Aquaculture System (RAS). It is much easier to keep the environment much more convenient for the parent fish to mate and spawn in the RAS, compared with traditional. Specifically, the flounder, grouper, and butterfish can successfully lay spawn in the RAS. Among them, the previous studies reported the culture density of 0.01-4.5 kg/m3, system recirculation rate of 9-76%/h, and water discharged 0.7-3%/day. In terms of the fish eggs hatching, three kinds of incubator were mainly used for the different kind of eggs. Mcdonald-type hatching jar was used for the trout, sturgeon, and seabass, all of which eggs were suspended in water. California-type incubation troughs and vertical incubators were mainly used for the salmon and catfish, of which eggs were be stationary. Similar to the Mcdonald-type hatching jar, the funnel type incubators were used for the fresh water fish, such as the big head, grass, and koi carp. Furthermore, the different requirements of the system to grow out have been summarized to evaluate the influence of the live feed, microorganism, tank size, and light condition on the fish larval rearing. Secondly, the overview has been provided for the fish breeding and seed production in China. The current large-scale artificial fish breeding and seed production were practiced either in the outdoor ponds, net cages or the flow through various systems. Most of the seed production facilities were outdated, where the control of water quality was depended only on the climate and water resources. More importantly, the production efficiency and quality of fish seed were much lower and unstable at present, leading to the less development of aquaculture. Therefore, it is very necessary to upgrade the fish breeding and seed production technology. Recirculating aquaculture can be a promising kind of land-based industrialized aquaculture, due mainly to the high production, high efficiency, strong reproducibility, and environment friendly. Because of the high controllable water quality, recirculating aquaculture can fully meet the harsh requirements for the fish breeding and seed production. Hence, a plenty of practices on the fish breeding and seed production using RAS have been carried out with the different species all over the world. Thirdly, three research fields can be developed to promote the practice of RAS in the fish breeding and seed production in the future. 1) It is essential for the biological response of parent fish, eggs, and larval to the RAS environment stressors in the system design and seed production. 2) The control technology of environment and water quality can be developed in the scientific system configuration for different fish species. 3) The corresponding intelligent equipment can also developed during this time, such as, the screening for the parent fish using the computer vision, automatic counting for the eggs and larval, as well as the smart feeder for the live food.
aquaculture; recirculating hatchery; artificial propagation; egg incubation; seed production
10.11975/j.issn.1002-6819.2022.19.023
S954.1; S961.2
A
1002-6819(2022)-19-0212-07
张宇雷,张瑜霏,单建军,等. 鱼类工厂化循环水人工繁育设施装备应用研究进展[J]. 农业工程学报,2022,38(19):212-218.doi:10.11975/j.issn.1002-6819.2022.19.023 http://www.tcsae.org
Zhang Yulei, Zhang Yufei, Shan Jianjun, et al. Review of progress on fish breeding and seed production using Recirculating Aquaculture System (RAS)[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(19): 212-218. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.19.023 http://www.tcsae.org
2022-06-29
2022-08-20
国家重点研发计划项目(2021YFE0108700);现代农业产业技术体系建设专项资金(CARS-47-G20);中国水产科学研究院科技创新团队项目(2020TD78)
张宇雷,副研究员,研究方向为渔业装备与工程。Email:zhangyulei@fmiri.ac.cn。

