用于射频消融研究的三维可视化仿生胶体设计*
邹金成,侯睿哲,王红英,赵诗庆,张爱丽
(上海交通大学 生物医学工程学院,上海 200030)
引言
热消融是通过将超声及射频、微波电磁波引入生物组织,导致能量沉积并转化成热,使组织发生凝固性坏死的局部治疗技术。为实现良好的治疗效果,需要对消融区的形状和大小进行评估。在热消融实验中最理想的实验材料是动物组织,然而在体动物模型测量较为昂贵,即使是真实组织的体外使用也可能因取材、处理、存储,特别是结果标准化方面而面临很大困难[1]。因此,能模拟靶组织物理性质和几何性质的凝胶体模被广泛用作替代性研究材料。
目前,常用于热消融研究的体模材料有明胶、琼脂、聚丙烯酰胺。明胶保质期长、成本低、制作简单,且具有良好的透明度,但是机械强度与熔点低,不适宜用于温度超过50℃的热物理研究。琼脂虽有良好的机械和热稳定性,因其不透明,即使可以通过在距离消融探针不同位置处插入热电偶,来测得不同点的升温速率并判断消融情况,但无法精确测量消融区域的大小及形状[2]。而聚丙烯酰胺凝胶则兼具良好的热学稳定性、机械性质与光学透明度[3],可以适配较大范围的热学、电学性质,是可视化仿生胶体的更优选择[4]。
聚丙烯酰胺胶有良好的光学透明度,通过添加热敏感物质可以观察和测量胶体内部凝固区域的三维形状和尺寸,被广泛应用于射频和微波频段。常用的热敏感剂有牛血清白蛋白(BSA)、蛋清。二者均可以在达到阈值温度后发生不可逆的凝固,形成不透明的变白区域。相比于BSA,蛋清的成本更加低廉。也有采用非离子表面活性剂[11]和热致变色染料作为热敏感剂,用来制备可重复使用的可视化胶体。
然而,目前使用的可视化聚丙烯酰胺胶大多用于模拟肝脏组织的性质,包括声学[14]、热学和电学性质。其中,电学性质主要是模拟470 kHz的频率[15],即临床上射频消融使用的频率。也有部分模拟肌肉组织的仿生胶体,但所使用的频率范围大部分在MHz到GHz区间,很少有模拟kHz频段的仿生胶体研究。虽然Aditya等[18-19]利用水、铝粉和结冷胶制备了500 kHz下模拟人体肌肉介电性质的体模,但也仅是单个频率的电学性质匹配,未进行更大范围频段的适配度研究。
因此,本研究制作了一种三维可视化聚丙烯酰胺仿生胶体,可以较好地模拟肌肉组织在100~500 kHz频率范围内的电学性质,同时在射频消融过程中还能三维立体地观察射频消融范围。使用自主研发的460 kHz射频消融系统加热,观察和对比了所制备胶体的射频加热响应,效果较好,能为临床研究提供有利参考。
1 方法
1.1 三维可视化仿生胶体制作材料
本研究参考Takegami等[10]的方法提出制作100 mL的三维可视化仿生胶体配方为:新鲜鸡蛋蛋清35 mL,溶解NaCl的去离子水31.4 mL,含30%(w/v)丙烯酰胺-甲叉双丙烯酰胺的水溶液(丙烯酰胺:甲叉双丙烯酰胺=19∶1)(迪申生物)33 mL,10%(w/v)的过硫酸铵(ammonium persulfate,APS)(默克)1mL,四甲基乙二胺(TEMED)(碧云天生物)0.1 mL。
其中,聚丙烯酰胺凝胶主要由丙烯酰胺和甲叉双丙烯酰胺在水溶液中的交联反应,以及随后的聚合反应制成[9],APS和TEMED分别作为聚合反应的引发剂和催化剂被添加至胶体溶液中[20-21];丙烯酰胺-甲叉双丙烯酰胺,可以使胶体具有足够的硬度,以保证独立放置或插入射频探针不会破裂[10];利用蛋清对温度的敏感性作为射频消融方法研究的温度指示剂,由于蛋清浓度过高会增大胶体的不透明度,浓度过低会导致灵敏度和光学对比度降低,浓度范围在0%~40%为宜[10],本研究选择体积分数为35%的蛋清,符合良好可视化的浓度范围。
此外,已有研究构建的以牛血清白蛋白为温度指示剂的聚丙烯酰胺凝胶在470 kHz时的电导率约为0.117 S/m[15],接近肝脏组织的电导率为0.148 S/m[22]。与以蛋清为指示剂的聚丙烯酰胺胶体电导率接近,显著低于肌肉组织的电导率0.45 S/m[21]。因此,本研究在制作过程中添加了NaCl来调整胶体的导电性能和电学性质[23-25],并配置了含有不同浓度NaCl的胶体以探究其对胶体电学特性的影响。
1.2 三维可视化仿生胶体的制作
参照文献报道的聚丙烯酰胺凝胶制作流程[12,20,22],本研究中三维可视化胶体的制作过程为:在室温条件下,向35 mL的蛋清中加入31.4 mL含有一定浓度NaCl的去离子水,用磁力搅拌子将其搅拌均匀后,再向制备的蛋清-NaCl水溶液中加入33 mL丙烯酰胺-甲叉双丙烯酰胺溶液,使其混合均匀。之后向蛋清/水/丙烯酰胺-甲叉双丙烯酰胺混合溶液中滴加1 mL 10%(w/v)的APS溶液以及0.1 mL的TEMED。在溶液搅拌1 min后,将制备的溶液倒入制作好的胶体模型中,室温条件下静置半小时直至混合并固化成凝胶。最后,在制作好的胶体表面滴加少量去离子水,用封口膜密封后置于4℃冰箱保存。
1.3 仿生胶体的电特性测量
射频消融技术主要利用高频电流场作用下的热效应,达到对靶向组织消融治疗的目的。然而,不同个体或同一个体不同组织的导电性能(即电阻抗特性)有差异,为更好地研究其射频消融治疗方法,本研究设计制作的仿生胶体可通过改变去离子水中NaCl的浓度,调节胶体的电阻抗特性。为验证该仿生胶体与生物组织阻抗特性的一致性与NaCl浓度对胶体电特性的影响,本研究使用LCR表(keysight,E4980A)测量了猪里脊肉与含不同浓度NaCl的仿生胶体分别在100 kHz~2 MHz(射频消融频率一般在300 kHz~1 MHz之间)频率区间内的阻抗幅值和相位角,测量过程均在室温22℃下进行。其中,对猪里脊肉的阻抗特性测量包括肌肉纤维平行和垂直于电极时的两种情况。另外,为补偿测试电极引起的杂散导纳,实际测量之前均对测量电路进行了开路修正。
1.4 射频加热实验
本研究利用自主设计的射频发生系统对制备的仿生胶体进行了恒定电压(15 V)模式、频率为460 kHz、时长10 s的加热实验,并观察其可视化与量化指标。实验装置见图1。其中,实验所使用的电极为加工在聚酰亚胺薄膜上且尺寸为1.4 mm×4 mm、间距为1 mm的两个铜电极。胶体完全覆盖电极,并且胶体底面边缘与电极短边相重合。
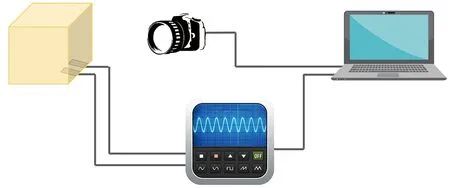
图1 射频加热实验装置Fig.1 Radiofrequency heating experimental device
2 结果与讨论
2.1 不同浓度NaCl胶体的电特性测试
为探究仿生胶体及消融组织的电特性要求,本研究分别制作了不同浓度的NaCl胶体。在20℃环境下,对比了各种胶体、肌肉纤维方向分别与电极平行、垂直时的阻抗幅值和相位角,其随频率变化的曲线见图2。其中,仿生胶体中分别含有的NaCl浓度为0%,0.14%、0.28%和0.42%(w/v)。

图2 含不同浓度NaCl的胶体、肌肉(猪里脊肉)纤维方向分别与电极平行时、垂直时的阻抗幅值(a)和相位角(b)随频率变化的曲线图
实验发现,肌肉组织的阻抗幅值随频率增加有先增大,再迅速下降的趋势,在约300 kHz时达到峰值。其中,上升区间内的阻抗幅值变化在肌肉与电极平行和垂直时分别为1.30%、1.67%,在误差可接受范围内(5%)。因此,阻抗幅值在100~500 kHz无显著性差异,可认为基本不变。此外,相位角在500 kHz以下时随频率增加而剧烈下降;当频率高于500 kHz时,阻抗角基本不随频率变化。
相同频率下,肌肉纤维平行于电极时测得的阻抗幅值要高于肌肉纤维与电极垂直时的幅值,且相位角的绝对值略大,表明肌肉纤维平行于电极时的容性稍强。
通过调节仿生胶体中NaCl的含量并对含不同浓度(0.14%、0.28%和0.42%)NaCl的仿生胶体进行电学特性的测量发现:(1)随NaCl浓度的增加,仿生胶体的阻抗幅值逐渐减小;相位角在500 kHz以下时无明显变化,高频时与NaCl浓度成正相关。(2)仿生胶体中NaCl含量为0.28%,即制作过程中添加浓度为0.9%的NaCl-去离子水溶液时,阻抗幅值介于两种肌肉纤维与电极相对取向之间,且幅值与相位角随频率变化的趋势基本相同。
2.2 三维可视化仿生胶体的量化与可视化测试
为显示本研究制作的三维可视化胶体在射频加热过程中的加热效果,将加热电极置于胶体的底部,使用460 kHz射频对胶体进行加热,记录射频加热10 s过程中,不同时间节点的加热胶体形态变化。同时使用红外热成像仪同步测试胶体的温升过程,记录结果见图3。其中,图3(e)-(h)中,白色虚线表示胶体底部边缘,黑色实线表示15℃的等温线。随射频电流的施加,仿生胶体与电极接触的部分温度会迅速升高,胶体正面形成以电极为底边的扇形温升区域,且温度整体以电极为中心向外扩散。受热区域逐渐变白,形成类似四分之一椭球体的加热形状,并且随射频作用时长的不断增加,白色加热区域在纵向深度和横向宽度上都会有明显增加。
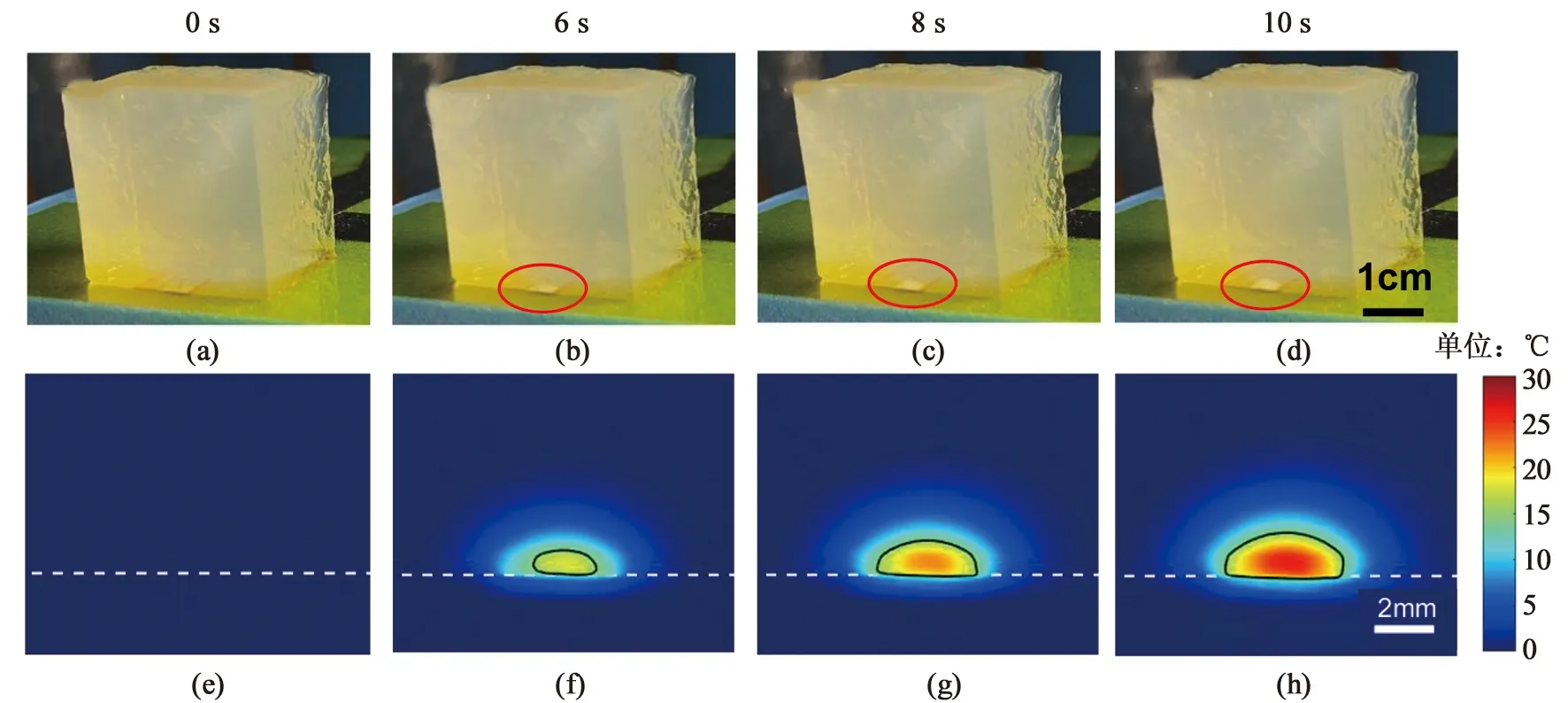
图3 不同加热时长下,仿生胶体的明场拍摄照片(a)-(d) 与红外温升(ΔT)图像(e)-(h)
对图3中不同射频加热时长下明场拍摄的仿生胶体正面变白区域,以及对红外温升图像中15℃的等温线包围的区域进行高度和宽度的测量、统计。对四块胶体,各重复测量三次取平均值,结果见图4。可发现红外温升图像中15℃温升包围区域与明场中胶体变白区域的尺寸基本一致。
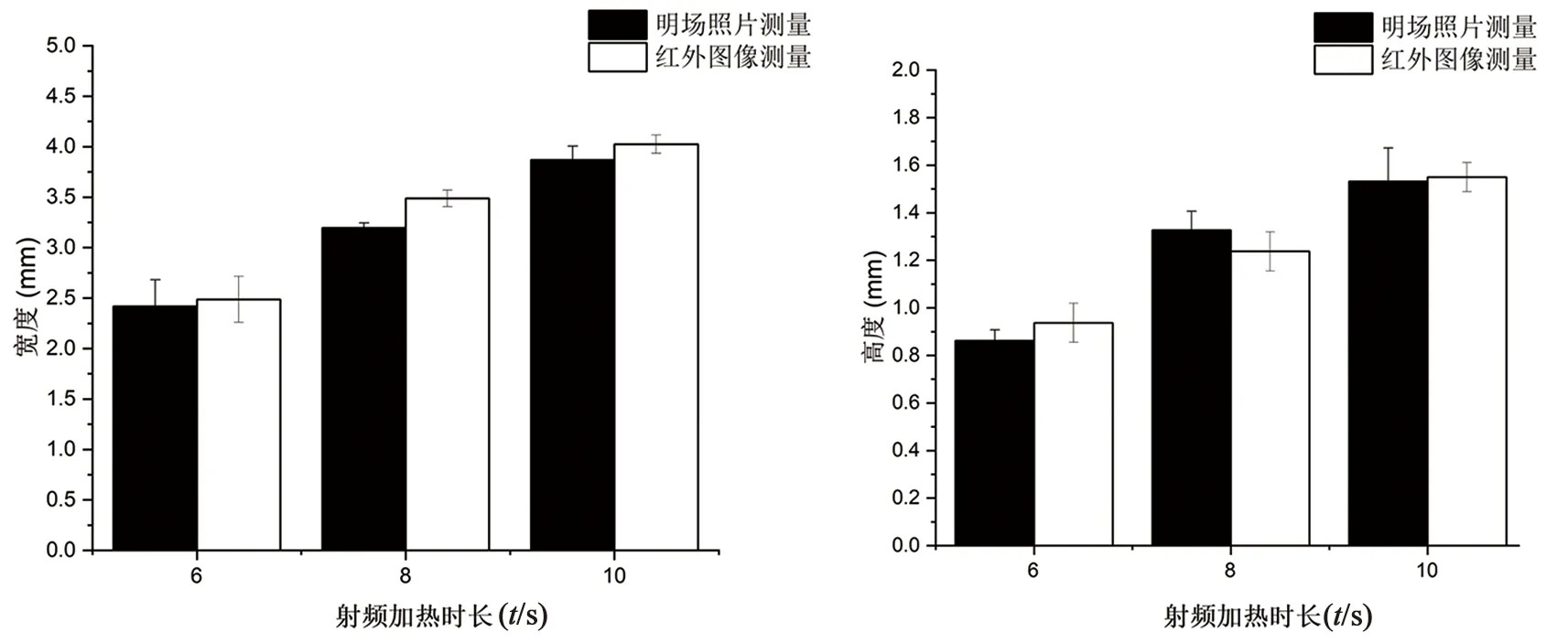
图4 不同射频加热时长下,明场照片正面变白区域和红外温升图像中15℃温升区域的宽度、高度对比图
2.3 胶体与肌肉组织加热效果对比测试
为验证本研究制作的加热胶体在实际应用中的消融情况,根据电特性曲线测试结果,选择含0.28%(w/v)NaCl的仿生胶体与肌肉组织进行对比实验。实验前,首先使用直径5 cm、高8 cm的亚克力管制作仿生胶体,同时切好相同尺寸的肌肉放在模具中。使用上海美杰医疗科技有限公司研发的多模态肿瘤消融探针(探针直径2 mm,探针有效消融长度3 cm),采用460 kHz频率射频,控制恒定射频电压有效值30 V,分别对仿生胶体与肌肉组织加热3 min,实验装置示意图,见图5。肌肉组织和胶体在加热过程中的实时阻抗变化见图6。分别将消融后的组织与胶体从中间切开,观察消融情况并测量其消融范围,结果见图7。

图5 胶体与肌肉组织加热装置示意图Fig.5 Schematic diagram of tissue-mimicking phantom and muscle tissue heating
由图6可知,在射频消融过程中,胶体与肌肉组织的阻抗变化曲线几乎一致,说明本研究胶体具有与肌肉组织相同的电特性。图7中对比测试的仿生胶体消融范围为16.4 mm,肌肉组织消融范围为16 mm,并且胶体消融与组织消融的变白区域近乎相同。

图6 肌肉组织与胶体射频消融过程中实时阻抗
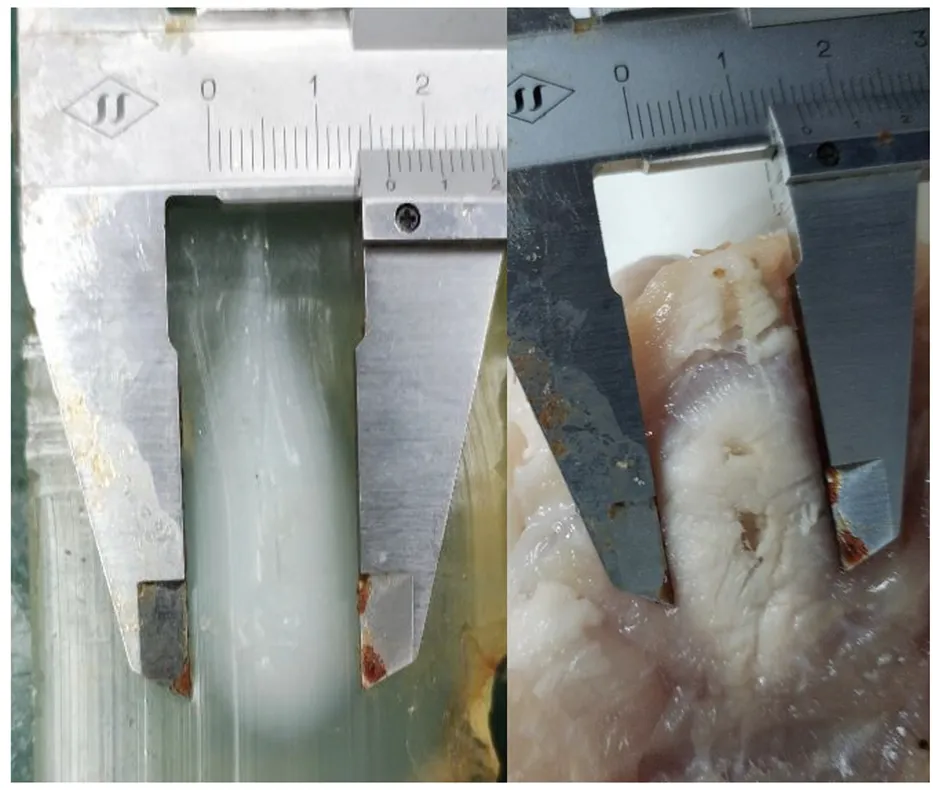
图7 肌肉与胶体的消融范围
3 结论
本研究根据射频消融的基本原理与生物组织相关电学特性,研制了一种应用于射频消融研究的三维可视化仿真胶体,并对比测试了仿真胶体与肌肉组织的电特性,结果表明,通过改变胶体中NaCl浓度,可以改变其电特性,并且能拥有与生物组织相似的电性质。对胶体的射频加热实验表明,本研究胶体能够实时清晰地显示射频消融的区域,且与肌肉组织对比实验发现,二者具有相同的加热区域。本研究的仿生胶体可为射频精准消融治疗方法的研究提供可视化和量化的热响应效果,同时也为不同组织胶体的研究提供了设计方法,有利于指导射频消融技术的临床治疗研究。

