ATP1A1在结肠腺癌组织中的表达及其与临床病理特征和预后的关系
韩 娜,张彦彦,张中冕,张 芳,张 相,赵文超
(1.郑州大学第二附属医院肿瘤科,河南 郑州 450014;2.郑州大学基础医学院生理学与神经生物学系,河南 郑州 450001)
结直肠癌(colorectal cancer,CRC)是我国常见的恶性肿瘤之一,其发病率和死亡率在恶性肿瘤中分别排在第2位和第5位[1]。大部分CRC患者确诊时已经处于局部进展期,造成了CRC患者的预后较差,5 a生存率较低[2-3]。因此,寻找有效的生物预测指标和治疗靶点对于CRC的防治具有重要的意义。CRC分为结肠癌和直肠癌,其中95%以上的结肠癌属于结肠腺癌(colonic adenocarcinoma,COAD)。Na+/K+转运ATP酶α亚单位1(ATPase Na+/K+transporting subunit alpha 1,ATP1A1)是Na+/K+转运ATP酶的主要成分之一[4]。研究[5-7]表明,ATP1A1在多种肿瘤中的表达发生了改变,与肿瘤的发生发展有着密切的关系。但是,ATP1A1在COAD组织中的表达及其作用并不清楚。本研究采用实时荧光定量PCR检测了ATP1A1在COAD组织中的表达,并分析了ATP1A1的表达与COAD患者临床病理特征和预后的关系。
1 材料与方法
1.1 临床资料选择2012年11月至2014年12月期间于郑州大学第二附属医院进行手术治疗的患者作为纳入对象。纳入标准:1) 原发肿瘤;2) 符合COAD在WHO中的诊断标准;3) 临床及随访资料完整。排除标准:1) 既往有恶性肿瘤病史;2) 术前行放、化疗;3) 合并其他恶性肿瘤或林奇综合征。根据上述标准,共纳入166例COAD患者。手术切除后的COAD组织以及配对的癌旁组织标本(距离肿瘤边缘≥3 cm)保存于-80 ℃低温冰箱中。男103例,女63例;年龄19~87岁,中位年龄63.0岁,其中≤65岁85例,>65岁81例。肿瘤分级、TNM分期按照国际抗癌联盟/美国癌症联合会2017年第8版CRC分期标准:高中分化99例,低分化67例;T1+T2期34例,T3+T4期132例;N0期84例,N1+N2期82例。电话随访截至2019年1月1日。本研究经郑州大学第二附属医院伦理委员会审查后批准,所有患者或家属均签署了知情同意书。
1.2 主要试剂Trizol Reagent购自美国Invitrogen 公司,反转录试剂盒PrimeScript RT reagent Kit购自日本Takara公司,FastStart ESSENTIAL DNA GREEN MASTER购自瑞士Roche公司,上、下游引物由中国生工生物工程股份有限公司合成。
1.3 组织总RNA的提取及反转录将COAD组织样本研磨成粉后加入Trizol裂解,加入氯仿沉淀蛋白后离心取上清,加入异丙醇沉淀RNA,体积分数75%乙醇洗涤并离心沉淀RNA 2次,无酶水溶解RNA沉淀后测定浓度,按照说明书采用反转录试剂盒PrimeScript RT reagent Kit进行反转录获取cDNA。
1.4 实时荧光定量PCR配制20 μL反应体系:10 μL荧光染料(FastStart ESSENTIAL DNA GREEN MASTER),上下游引物各4 μL(终浓度均为0.4 μmol/L),反转录产物0.4 μL,无酶水1.6 μL。反应过程如下:94 ℃预变性10 min,94 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,40个循环。以GAPDH作为内源参照,计算2-△△CT作为基因的表达水平。ATP1A1引物序列如下:上游:5’-ACAGACTTGAGCCGGGGATTA-3’,下游:5’-TCCATTCAGGAGTAGTGGGAG-3’。GAPDH引物序列如下:上游:5’-GGAGCGAGATCCCTCCAAAAT-3’,下游:5’-GGCTGTTGTCATACTTCTCATGG-3’。
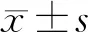
2 结果
2.1 ATP1A1在COAD组织和配对的癌旁组织中表达的比较与癌旁组织(5.70±5.87)相比,ATP1A1在COAD组织中的表达显著降低(2.96±3.98,t=4.966,P<0.001)。
2.2 ATP1A1的表达与COAD临床病理特征的关系以0.945 543为界值,将166例COAD患者分为ATP1A1低表达组(≤0.945 543)和ATP1A1高表达组(>0.945 543)。COAD组织中ATP1A1的表达与肿瘤大小(χ2=5.537,P=0.019)、浸润深度(χ2=5.326,P=0.021)和远处转移有关(χ2=5.103,P=0.024)。见表1。
2.3 ATP1A1的表达与COAD患者生存的关系ATP1A1低表达组COAD患者的中位生存时间[42.062(95%CI:37.355~46.770)个月]显著低于ATP1A1高表达组COAD患者[52.099(95%CI:48.729~55.470)个月,χ2=9.954,P=0.002]。见图1。
2.4 ATP1A1是COAD的独立预后因素单因素COX回归模型分析显示,年龄、肿瘤大小、肿瘤位置、病理分级、浸润深度、淋巴结转移、远处转移、ATP1A1表达均是COAD患者的预后因素。多因素COX回归模型分析表明,肿瘤位置、病理分级、远处转移、ATP1A1表达是COAD患者的独立预后因素,其中低表达ATP1A1预示着COAD患者的较差预后。见表2、3。
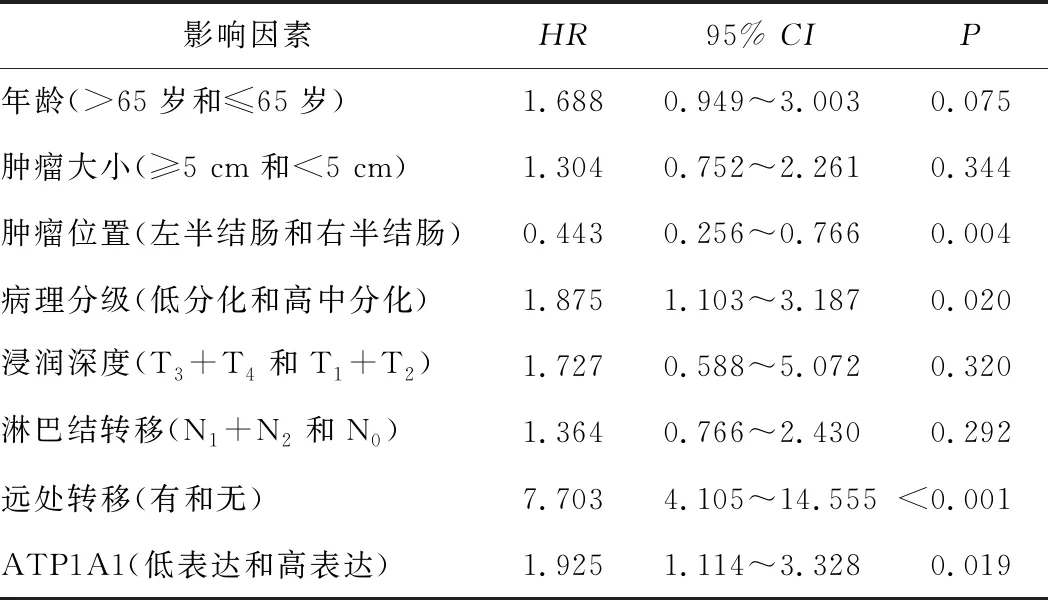
表3 多因素COX回归模型分析结果
3 讨论
Na+/K+转运ATP酶又叫做钠泵,广泛存在于机体的细胞膜上,具有分解ATP进而主动跨膜转运Na+和K+的功能。钠泵由α亚基、β亚基以及FXYD蛋白组成,其中α亚基分为4种亚型,即α1、α2、α3和α4,α1亚基也就是ATP1A1,在真核细胞中的表达最为广泛[8-9]。研究[9-11]表明,ATP1A1参与了多条依赖于酪氨酸激酶的细胞信号转导途径,最终影响了细胞的多种生物学功能。在肿瘤中的研究[9,12-17]发现,ATP1A1在食管鳞癌、肝癌、肺癌及神经胶质瘤中的表达增加,在肾癌中的表达降低,促进了相应的肿瘤细胞的增殖和侵袭转移,参与了肿瘤的发生、发展。但是,ATP1A1在COAD组织中的表达及其作用并不清楚。
我们的研究发现,ATP1A1在COAD癌组织中的表达显著降低,表明ATP1A1在COAD的发生、发展中起到了重要的作用,同ATP1A1在肾癌中的作用相似[17]。临床病理特征相关性的研究发现,我们发现ATP1A1的表达与肿瘤大小、浸润深度和远处转移有关。这一结果表明,ATP1A1的表达降低可能具有促进肿瘤生长和侵袭转移的作用。在肾癌的研究[17]表明,ATP1A1可以抑制肿瘤细胞的增殖和侵袭转移,与本研究的结果相一致。但是,在食管鳞癌、肝癌、肺癌及神经胶质瘤的研究[9,12-16]中发现,ATP1A1在肿瘤组织中的表达增加,并且ATP1A1可以促进相应的肿瘤细胞的增殖和侵袭转移,与本研究的结果完全相反。这种不一致性可能与肿瘤的组织特异性有关。
本研究结果还发现,ATP1A1低表达COAD患者的生存时间较短,ATP1A1是COAD患者的独立预后因素,表明ATP1A1可能是COAD患者预后的潜在标志物。
综上所述,ATP1A1在COAD组织中的表达降低,可能具有促进肿瘤细胞增殖和侵袭转移的作用,从而参与了COAD的发生、发展,缩短了患者的生存时间。因此,ATP1A1不仅是影响COAD患者预后的可能独立因素,也有望成为治疗COAD的潜在靶点。

