液基薄层细胞学检查联合HPV、P16蛋白免疫组化染色检测对宫颈癌的筛查价值
杨晓林
(朝阳市中心医院病理科,辽宁 朝阳 122000)
宫颈癌在我国女性中属于一种较为常见的恶性肿瘤,其发病率在不断增高,且呈现出年轻化趋势,倘若得不到及时有效的治疗,会给患者的身体健康造成严重影响[1-2]。宫颈癌的进展需要经过长时间癌变阶段,为降低宫颈癌的发病率、病死率,通过对宫颈病变患者进行科学的筛查具有重要意义。脱落细胞学检查,尤其是近些年临床推广的液基薄层脱落细胞检查应用于宫颈癌筛查中临床意义显著。但是,单纯根据细胞学检查并不能完善筛查出宫颈癌,仍有少数女性疾病恶化发展为浸润性宫颈癌。高危型人乳头状瘤病毒(HPV)感染是诱发宫颈癌的始动因子,因此加强高危型HPV DNA检测对于宫颈癌疾病筛查也有显著意义[3-4]。P16蛋白异常与宫颈上皮内瘤变、宫颈癌发生密切相关,而且随着病情恶化加重,病情呈动态变化,关于宫颈癌疾病筛查应受到临床重视[5]。为了探讨行之有效的诊断方案,本文以我院近年来收治的宫颈上皮病变患者80例为研究对象,就诊断方案的效果进行了探索,以供参考。
1 资料与方法
1.1 一般资料 2018年2月至2019年3月间,80例进行TCT和HPV检测的患者,仅有一项检查异常患者就进行P16免疫组化染色和阴道镜下宫颈组织活检。80例患者其年龄24~73岁,平均(48.50±3.40)岁,其中宫颈接触性出血25例,宫颈分泌物异常29例,宫颈糜烂、肥大、充血者26例,均为已婚或未婚有性生活史超过3年,全面接受病理学活检以及阴道镜检查,其余细胞学标本重新纸片,用于P16免疫组化染色,剔除合并系统抑制性疾病、妊娠者。
1.2 方法
1.2.1 液基薄层细胞学检查(TCT)使用取材专用毛刷在宫颈口与黏膜交界位置沿同一方向旋转2~5圈,然后对毛刷上的细胞进行洗脱,保存在细胞保存液中备用。采用沉降式制片术及巴氏染色技术染色。对于液基薄层细胞学检测结果的判定,严格按照第三版TBS报告系统分类标准,其中NILM:表示无上皮内病变或恶性病变;ASC包括ASC-US和ASC-H,ASCUS:表示意义不明确的非典型鳞状细胞;ASC-H:非典型鳞状细胞,不除外高级别鳞状上皮内病变;LSIL:表示低级别鳞状上皮内病变;HSIL:表示高级别鳞状上皮内病变;SCC:表示鳞状细胞癌。除NILM外,其他检验结果均视为阳性。癌前病变:CIN(宫颈鳞状上皮内瘤变)。
1.2.2 人乳头状瘤病毒(HPV)检测。采用杂交捕获2代技术(HC-Ⅱ)对细胞学标本进行测试,LV/CO的比值≥1.0,检测结果为阳性。
1.2.3 P16蛋白免疫组化检测。把TCT和HPV检测后剩余标本制成细胞薄片,并采用链霉素抗生物素蛋白—过氧化物酶法(S-P法)对P16蛋白进行检测,使用北京迈新生物技术开发有限公司试剂盒,严格按照说明书进行操作。P16蛋白免疫组织化学检测诊断标准(阳性细胞呈现黄色或棕黄色):细胞染色为单个,阳性细胞百分比<5%,检测结果为阴性;细胞染色为散在或小的细胞团染色,5%≤阳性细胞百分比≤24%,检测结果为弱阳性;细胞染色为片状或簇状细胞染色,25%≤阳性细胞百分比≤50%,检测结果为阳性;细胞染色为弥漫的细胞着色,阳性细胞百分比>50%,检测结果为强阳性。
1.2.4 阴道镜下活检。对受试者宫颈可疑发生病变位置进行活检,倘若镜下没有明显的病灶或者图像不符合,应对宫颈多点组织进行活检。活检标本进行组织学病理诊断。
1.3 观察指标 ①记录TCT检查与阴道镜活检诊断结果。观察HPV检测与阴道镜活检的病理诊断结果。②分析P16蛋白表达与阴道镜活检病理诊断结果。记录TCT检查、HPV检测、P16蛋白表达单独与联合检测效能。
1.4 统计学方法 SPSS21.0软件处理文中数据,无序分类资料经百分比(%)表示,行χ2检验;数值变量资料经()表示,采取t检验;P<0.05为显著差异。
2 结果
2.1 对比液基薄层细胞学检查(TCT)与阴道镜活检诊断结果 TCT鳞状上皮细胞异型越明显,则宫颈病变程度越高。见表1。
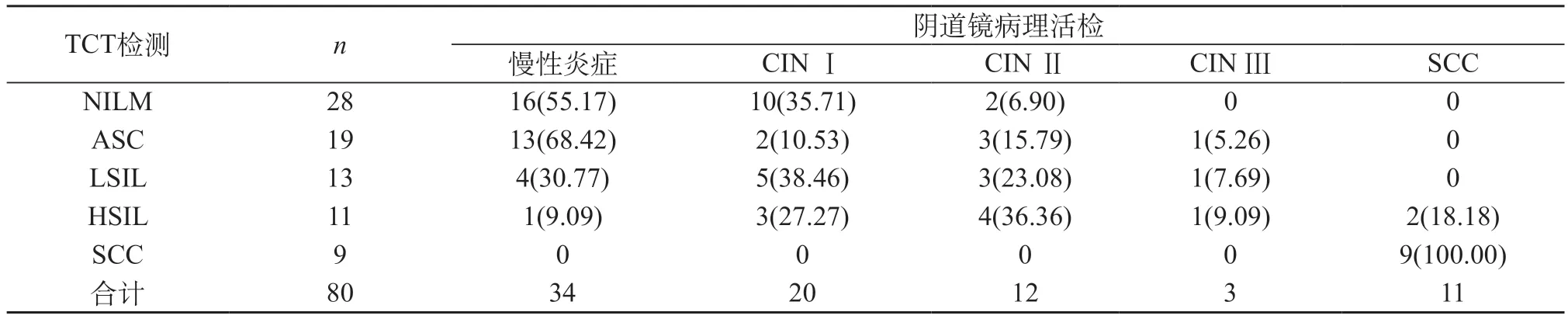
表1 对比液基脱落细胞学检查与阴道镜活检诊断结果[n(%)]
2.2 对比人乳头状瘤病毒(HPV)检测与阴道镜活检诊断结果 宫颈病变程度越高,HPV检测的阳性率越高。见表2。
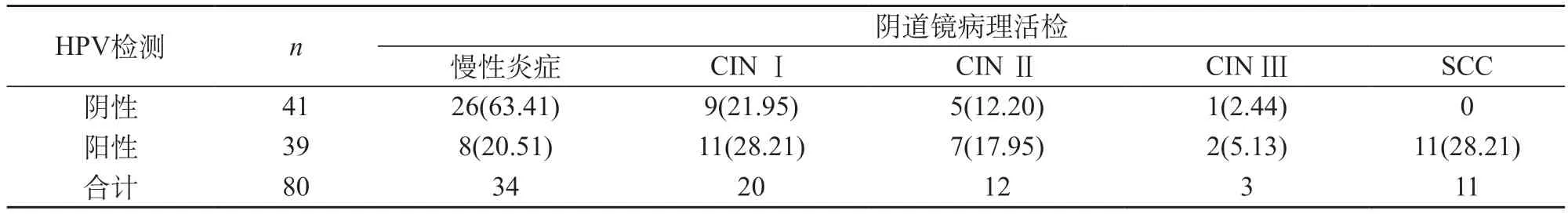
表2 对比人乳头状瘤病毒检测与阴道镜活检诊断结果[n(%)]
2.3 对比P16蛋白与阴道镜活检诊断结果 随着病理活检诊断宫颈病变的程度越高,P16蛋白阳性率越高;同时,把患者进一步分为≤C I N Ⅰ和≥CINⅡ两组,≤CINⅠ组的P16蛋白表达的阳性率明显低于≥CINⅡ组(χ2=20.978;P<0.05),见表3。
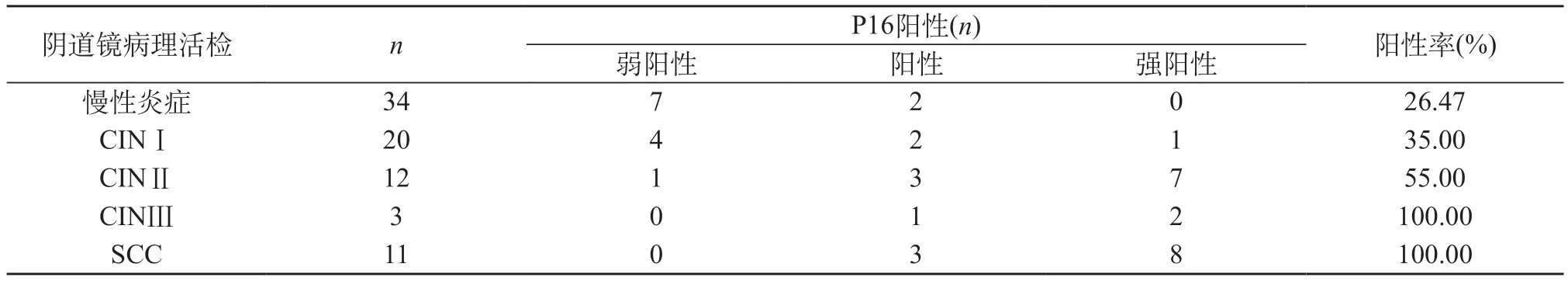
表3 对比P16蛋白与阴道镜活检诊断结果
2.4 对比3种检测方式对宫颈病变的诊断效能 阴道镜组织活检病理诊断结果显示:阳性26例(≥CINⅡ),阴性54例(≤CINⅠ)。HPV、TCT、P16联合检测的灵敏度、特异性、准确性均高于单独HPV检测、TCT检测、P16检测。见表4。
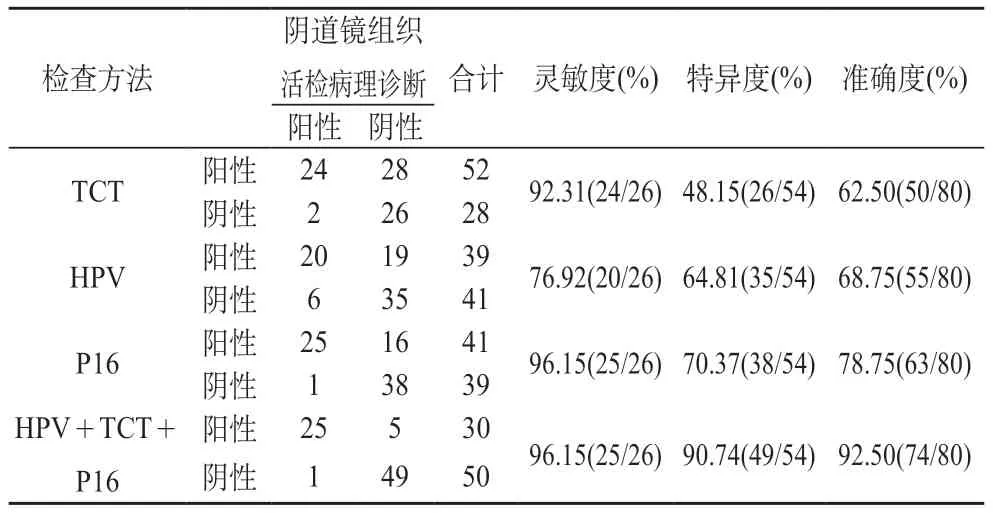
表4 对比3种检测方式对宫颈病变的诊断效能
3 讨论
宫颈癌在我国属于一种较为常见的女性恶性肿瘤,研究表明绝大多数宫颈癌是通过鳞状上皮内瘤变(CIN)发展而来的。宫颈鳞状上皮内瘤变(CIN)又称为宫颈癌前病变,是指患者宫颈鳞状上皮异型增生,然而又不足以诊断为癌的宫颈上皮异常增殖性病变,具有发展成为恶性肿瘤的潜能,倘若长期存在极易转变为宫颈癌。目前由于对于宫颈癌的发病机制尚未完全明确,以至于无法对其进行针对性治疗[6-7],但HPV感染,尤其是高危型HPV感染是引起宫颈癌前病变的主要危险因素。据学者[8]研究表明,在宫颈癌病变前阶段,倘若进行科学的处理,不但能够有效控制病情的进一步恶化,同时还有助于治疗宫颈病变,从而在较大程度上降低了对患者的不良影响。
液基薄层细胞学检查(TCT)在临床上属于一种经典的宫颈癌筛查技术,该技术在筛查宫颈癌时,具有无创、快速等优点,在较大程度上提高了对宫颈癌早期病变的确诊率,所以在临床上得到了广泛的应用[9]。在此次研究过程中,液基薄层细胞学检查与阴道镜活检诊断结果,之所以会产生差异,其原因通常是取材方式及细胞形态学观察两方面,首先是正确规范的取材,保证获得足够有效的细胞;然后是提高细胞形态学观察准确率。形态学观察虽然能够分辨不同时期的宫颈病变,然而由于主观因素的限制,以至于降低了对病变的诊断率[10]。液基薄层细胞学检查属于一种形态学检查,由于取材的位置、深度、制片方式以及染色水平等因素,极易影响诊断的准确性[11]。倘若仅通过液基薄层细胞学检查对早期宫颈癌患者进行筛选,极易导致发生假阴性、假阳性等情况,从而降低了诊断的灵敏度,增大了发生误诊、漏诊情况的概率。据于乐等[12]学者研究发现,在对早期宫颈癌患者进行诊断时,采用TCT及其联合HPV、P16蛋白免疫组化染色检测,能够提高对疾病的诊断效果。
现代分子生物学研究已经证实,高危型HPV DNA检测可作为宫颈癌前病变敏感有效的筛查方法。但是,只有高危型HPV持续性感染才会导致宫颈癌及其癌前病变发生,多数患者未高危型HPV一过性感染,这些与宫颈癌发生关系并不密切[13-14]。因此,HPV DNA检测单独筛查存在特异性过低的不足,因此不能用于初筛工作中。P16基因也可称为多瘤抑制因子(MTS1)基因或CDKN2基因,是NK4家族的中药成员,编码产物为P16单蛋白。P16基因缺失、突变在肿瘤发生发展中起着重要作用,P16表达阳性率会随着病情严重程度而升高,表达强度从弱变强,这表明P16检测可作为宫颈癌前病变、宫颈癌的早期筛查指标[15]。HPV是引起宫颈癌的发生的重要病原微生物,特别是当自身免疫能力处于低水平,人们性生活增加、分娩宫颈受损等情况发生时,加之HPV的持续感染,宫颈上皮病变发生的危险性会随之增加[16]。另外,据何旻等[18]学者调查表明,当机体持续感染高危人乳头状瘤病毒后,会导致增加E7蛋白表达,降低Rb的活性,从而进一步激活了P16蛋白的表达。P16基因在临床上属于一种多肿瘤抑制因子,其蛋白的表达可能与宫颈上皮瘤变的发生存在较大的关系。所以此次研究通过选取P16染色联合其他检测辅助检查宫颈癌及其早期病变。研究结果证实,3种检测方式联合的灵敏性、特异性以及准确性,明显高于单独HPV检测、TCT检测、P16检测(P<0.05)。说明将TCT联合HPV、P16蛋白免疫组化染色检测应用于诊断宫颈癌及其早期病变中有价值,深受人们认同。单独应用TCT检测宫颈病变,一部分患者可能会出现过度诊断情况,而若仅应用HPV-DNA检测、筛查宫颈病变,可能会导致一部分低度病变漏诊,二者联合可一定程度提高宫颈病变筛查的敏感度,降低误诊、漏诊[19]。虽然联合应用诊断宫颈病变可提高检出率,但降低诊断特异度,可能会导致过度诊断治疗。结合P16免疫组化检测,可显著提高检测特异度,尤其是诊断CINⅠ及以上病变的敏感度与特异度高。一般临床中,CINⅠ只需要随访,CINⅠ及以上病变需接受积极治疗,因此临床脱落细胞学P16检测,可提高疾病诊断价值,并用于指导临床治疗[20]。
综上所述,采用TCT联合HPV、P16蛋白免疫组化染色检测,能够提高患者宫颈上皮瘤变的检测灵敏度、特异性以及准确度,降低漏诊或过度诊断情况,对于宫颈癌的筛查有重要意义,其应用前景广阔。

