LXRs/ABCA1调控视网膜色素上皮细胞炎症反应改善脂质过氧化引起的凋亡反应
谢丽蓉 顾青 尹莉莉
年龄相关性黄斑变性(age-related macular degeneration,AMD)是一种进行性中心视力损害性疾病,是发达国家老年人不可逆盲的主要原因。由于经济的发展和人口的老龄化,近年来在国内的发病率也不断攀升[1]。AMD的发病机制错综复杂,流行病学调查显示,多种脂质生物学功能相关的遗传变异与AMD相关[2];代谢组学分析发现脂肪酸代谢通路是AMD发生发展相关通路[3]。此外,干性AMD的重要病理特征-玻璃膜疣内富含脂质,提示脂质代谢紊乱是AMD病理改变的重要因素[4]。脂质代谢失调引起视网膜色素上皮细胞(retinal pigment epithelium,RPE)和Bruch膜内脂质堆积,在黄斑的高氧化应激环境下氧化为氧固醇[5],进一步沉积形成玻璃膜疣[6]。氧固醇具有促炎作用,炎症反之促进玻璃膜疣的形成和RPE细胞变性,加快AMD的发生发展[7]。本课题组前期研究发现氧固醇的一种7-酮胆固醇沉积于视网膜,引起视网膜炎症和感光细胞功能障碍,进而导致AMD样变的发生和发展[8]。
LXR属于核受体超家族,包括LXRα和LXRβ,是哺乳动物脂质稳态的关键调节因子,调控各个组织胆固醇的摄取、转运、外排[9],对炎症的调节也有重要作用[10]。已有研究表明激活LXR可以上调ABCA1、ApoE等载脂蛋白的表达,增加胆固醇外流,促进胆固醇逆向转运[11]。此外,研究发现LXR激活后可抑制肿瘤坏死因子-α、单核细胞趋化蛋白1、一氧化氮合酶等炎症因子表达[12],LXR激动剂可通过NF-κB信号通路减少Amyloid β对视网膜的炎症作用[13]。本研究拟探讨LXR激动剂对视网膜过氧化脂质堆积的调节和炎症改善作用,并探究其机制,为视网膜脂质沉积变性的治疗提供更多可能性。
资料与方法
一、材料
实验研究。(1)ARPE-19细胞:购自美国模式菌种收集中心(ATCC);(2)药物试剂:胎牛血清、抗菌素(Gibco,德国);GW3965(Selleck公司,美国);7-酮胆固醇、油红O、DMSO、Trition X-100(Sigma公司,美国);LXRα、LXRβ、ABCA1抗体(Abcam公司,英国);lipo2000(Thermo公司,美国);7-酮胆固醇抗体(Novus biologics公司,美国);siLXRα、si LXRβ(河马生物,浙江);micro syringe、needle(Hamilton,美国);CY3标记山羊抗兔二抗(Jackson,美国);山羊血清(博士德生物,武汉);DAPI(碧云天);Annexin-V/PI试剂盒(Biosharp,中国);ChamQ Universal SYBR qPCR Master Mix(诺唯赞,中国南京)
二、方法
1.细胞培养:ARPE-19细胞购自ATCC,培养于含有10%胎牛血清、2 mmol / l谷氨酰胺、100 IU / ml青霉素和100 μg/ ml链霉素的DMEM/F12培养基,置于5%CO2的湿润培养箱中。更换培养基并及时传代,取生长状态良好的第5~8代细胞进行后续实验。
2.CCK-8筛选药物最佳浓度:将ARPE-19细胞悬液(100 μl/孔)接种于96孔板中,置入培养箱中培养24 h;分别加入不同浓度激动剂GW3965(1.5 μM、2 μM、2.5 μM、3 μM),将培养板置于培养箱中孵育48 h;取出后,CCK-8作用2 h,用酶标仪测定各组在450 nm处的吸光度。
3.7-酮胆固醇免疫荧光染色:ARPE-19细胞悬液加入24孔板中,分为4组,control、DMSO、GW3965、7 kCh组,待细胞生长融合至70%,更换无血清培养基24 h,然后分别加入GW3965(2 μM)、DMSO(0.2%),除control组以外添加7 kCh(20 μM)培养24 h。弃去培养基,无菌PBS清洗3遍,4%多聚甲醛固定20 min,PBS清洗3遍。10%山羊血清室温封闭2 h,PBS洗3次,孵育7 kCh(1:100)一抗4 ℃过夜。CY3标记荧光二抗(1:500)室温孵育2 h,DAPI复染30 min,莱卡共聚焦荧光显微镜(Leica TCS NT,Wetzlar,Germany)拍照。
4.油红O染色:ARPE-19细胞悬液加入放好爬片的24孔板中,分为4组,control、DMSO、GW3965、7 kCh组,待细胞生长融合至70%,更换无血清培养基24 h,然后分别加入GW3965(2 μM)、DMSO(0.2%),实验组均置于含7 kCh(20 μM)培养24 h。弃去培养基,PBS漂洗3次,4%4 ℃多聚甲醛固定20 min。PBS再次漂洗2次,油红O(0.3 g/mL)37 ℃染色20~30 min。60%异丙醇漂洗5 s,然后立刻PBS漂洗2~3次。苏木素复染40 s,水洗2~3 min,显微镜(Olympus BX53,日本)下观察。
5.siRNA转染分别敲低LXRα、LXRβ表达:ARPE-19分为6组,control、DMSO、GW3965、7 kCh、siLXRα、siLXRβ组,待细胞生长融合至50%,更换无血清培养基,分别加入混有siLXRα或siLXRβ RNA与lipo2000的试剂,转染6 h后更换血清培养基作用24 h,然后分别加入GW3965(2 μM)、DMSO(0.2%),将后四组置于含7 kCh(20 μM)培养基中培养24 h。
6.qPCR检测ARPE-19细胞内IL-1β、Caspase 1的表达:ARPE细胞分为6组,control、DMSO、GW3965、7 kCh、siLXRα、siLXRβ组,如前所述转染,然后分别加入GW3965(2 μM)、DMSO(0.2%),于含7 kCh(20 μM)培养基培养24 h。Trizol提取各组RNA,用HiScript III RT SuperMix for qPCR(+gDNA wiper)和ChamQ Universal SYBR qPCR Master Mix逆转并扩增。检测时每个样品设置两个副孔,并计算平均Ct值作为最终Ct值,以actin作为内参将数据标准化,每组实验重复3次,引物序列见表1。
7.Annexin-V/PI染色检测ARPE-19细胞凋亡:ARPE细胞分为6组,control、DMSO、GW3965、7 kCh、siLXRα、siLXRβ组,如前所述转染,然后分别加入GW3965(2 μM)、DMSO(0.2%),置于7 kCh(20 μM)培养基中培养24 h。胰酶消化得到6组单细胞悬液(106/ml),加入荧光染料37 ℃孵育30 min,流式细胞仪(CYTOFLEX;贝克曼库尔特公司,美国)检测,激发光波长488 nm,515 nm滤器检测FITC荧光,570 nm滤器检测PI。
结 果
一、筛选激动剂最佳浓度
CCK8结果显示:GW3965浓度在1.5、2 μM时对RPE细胞的增殖活力没有明显影响,当浓度大于2.5时细胞增殖活力随浓度上升而下降(图1)。

不同浓度GW3965作用下ARPE-19细胞CCK-8检测
二、LXRs激活减少RPE细胞7-酮胆固醇堆积
C、O:7 kCh染色阴性;G、K:7 kCh染色阳性;D:RPE细胞内无脂滴沉积;H、L:RPE细胞内大量脂滴沉积;P:RPE细胞内几乎无脂滴沉积。
ARPE-19细胞免疫荧光染色显示:与未经 7 kCh处理的control组相比,7 kCh组RPE细胞内免疫阳性细胞增加(图2C、K),表明7 kCh沉积在RPE细胞中;用激动剂GW3965处理的细胞与DMSO处理的对照组相比,细胞内阳性颗粒减少,说明GW3965减少7 kCh在RPE细胞中堆积(图2G、O)。油红染色也证实了这一点:control组细胞内脂滴较7 kCh组少(图2D、L),DMSO组与7 kCh组细胞内脂滴无明显差异(图2H、L),GW3965组细胞内脂滴比7 kCh、DMSO组明显减少(图2H、L、P),表明LXR激动剂处理减少7 kCh在RPE细胞中堆积。
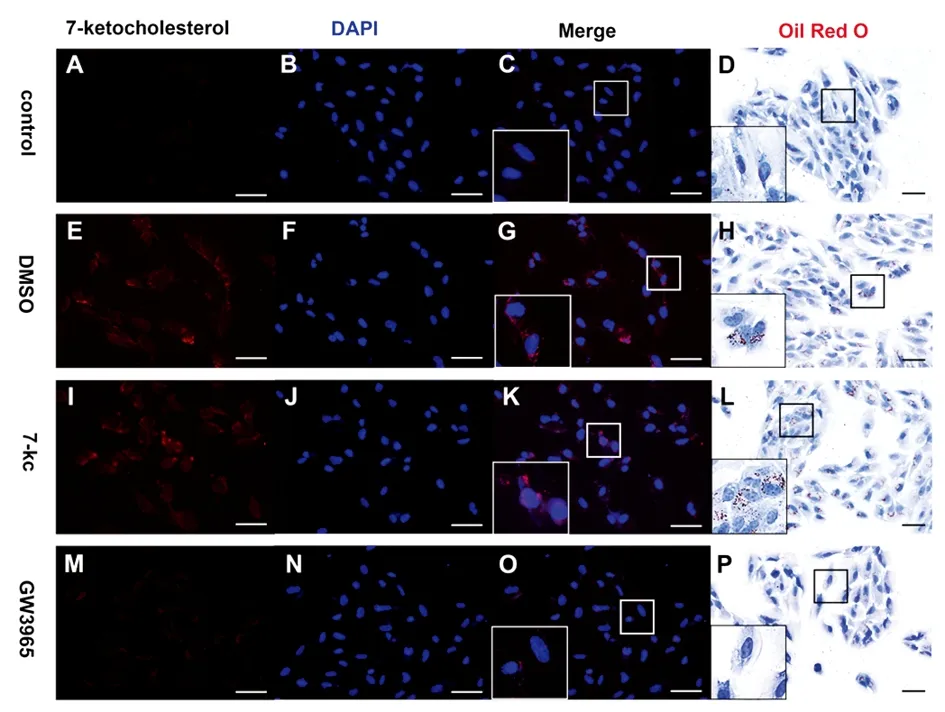
图2 免疫荧光及油红O染色检测RPE细胞内脂质沉积情况
三、LXRs激活减少RPE细胞凋亡
LL,活细胞:Annexin V阴性/PI阳性;LR,早期凋亡细胞:Annexin V阳性/PI阴性;UR,晚期凋亡细胞:Annexin V阳性/PI阳性;UL,坏死细胞:Annexin V阴性/PI阳性。每个象限中的数字代表细胞出现在该象限的百分比。
ARPE-19细胞Annexin V/PI检测显示:与control组相比,7 kCh、DMSO组凋亡细胞分别上调9.94%、9.62%(图3A、B、C);GW3965与7 kCh共同作用RPE细胞后,凋亡细胞较control组仅上调1.92%(图3D),表明GW3965减少7 kCh诱导的RPE细胞早期凋亡;敲低LXRα同时7 kCh培养RPE细胞,早期凋亡细胞增加19.46%(图3E),而敲低LXRβ同时7 kCh培养RPE细胞,早期凋亡细胞与7 kCh组无明显差异,但晚期凋亡细胞明显增加(图3F)。
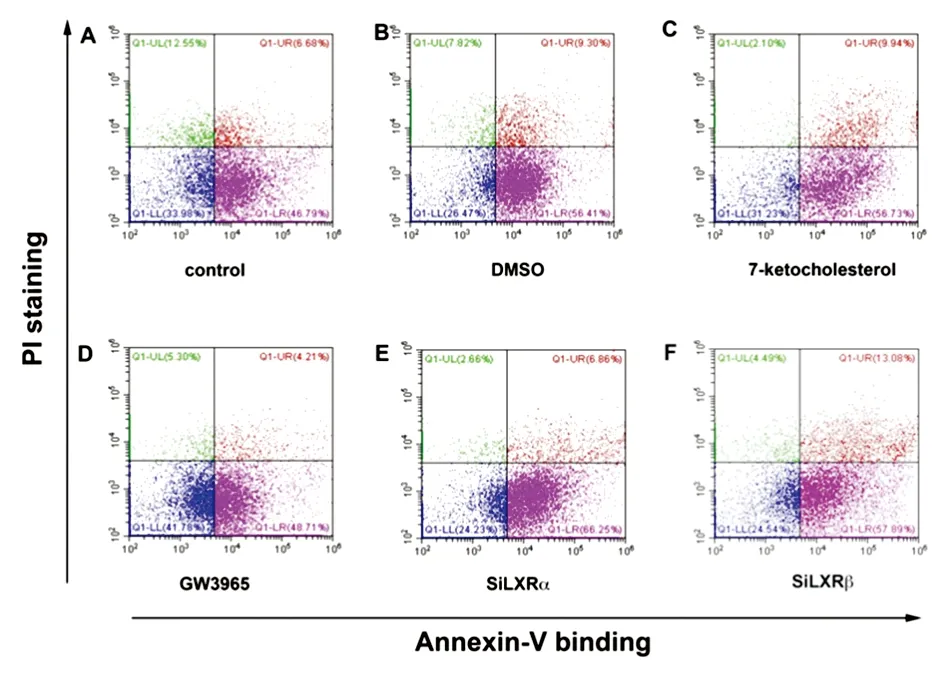
图3 Annexin V/PI染色检测ARPE-19细胞早期凋亡
LXRs激活ABCA1、减少7 kCh引起的IL-1β和Caspase 1上调
A-E:DMSO、7 kCh、GW3965、siLXRα、siLXRβ分别与control组比较
q-PCR结果显示:LXR激动剂增加LXRα、LXRβ、ABCA1表达量(图4A、B、E),说明LXR激动剂可以增加ABCA1的表达;7 kCh作为LXRs的配体,对LXRs同样有激活作用(图4A、B);7 kCh增加RPE细胞内Caspase1、IL-1β表达,而LXR激动剂减少7 kCh引起的这种反应(图4C、D);抑制LXRβ表达后,Caspase1、IL-1β表达量增加,而抑制LXRα后,与7 kCh组相比,Caspase1、IL-1β表达量无明显变化(图4C、D),说明在此炎症通路中LXRβ起主要抑制作用。
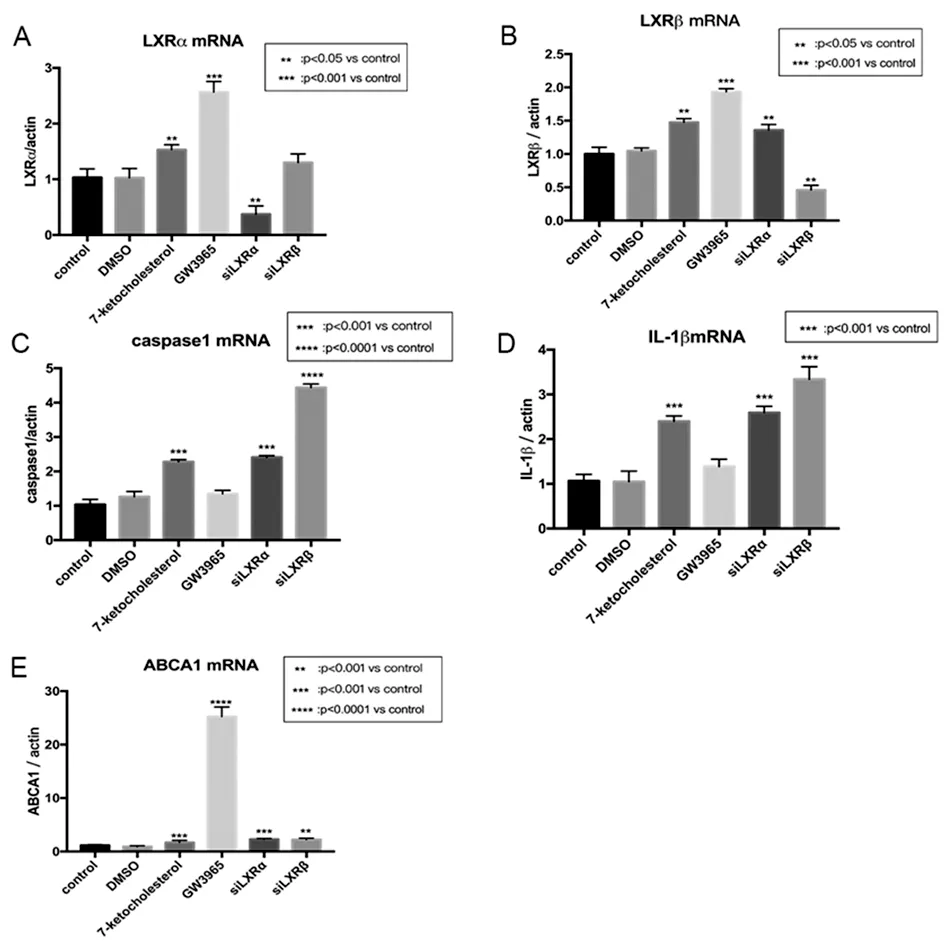
图4 RT-PCR检测ARPE-19细胞LXRα、LXRβ、ABCA1、caspase1、IL-1β表达
讨 论
脂质异常与AMD的发生发展密切相关[14]。脂质代谢在视网膜受到精密的调节,其失调可引起RPE细胞和Bruch膜内脂质蓄积[4]。RPE细胞内氧化脂质累积引起炎症发生,POS吞噬代谢受阻,诱发RPE细胞功能障碍,感光细胞凋亡。黄斑区高氧化环境促进过度蓄积的脂质过氧化,RPE的抗氧化能力随着年龄的增长逐渐降低,进而诱发炎症,导致AMD进展[5]。RPE细胞在眼内脂质代谢调节中起重要作用。RPE细胞表达多种脂蛋白,加工、修饰、降解来自全身和眼内局部的脂质。RPE细胞分泌apoB100,避免脂质积累引起凋亡损伤[15,16]。同时,RPE细胞具备主动胆固醇逆向转运系统,线粒体胆固醇逆向转运蛋白(TPSO)增加胆固醇从RPE细胞到ApoE、ApoI和HDL的流出,并且随年龄增长,TPSO分泌减少[17]。过度蓄积的氧化脂质可以诱导一系列炎症因子合成,包括TNFα、IL-1β、IL-6等[18],并显著增强1-42淀粉样蛋白对人神经元的促凋亡和坏死作用[19]。我们以往报道了玻璃膜疣的重要成分7-酮胆固醇致炎作用并导致感光细胞功能障碍,促进视网膜发生AMD样病理改变[8]。
LXR是一种配体激活的核转录因子,广泛存在于全身各个细胞、器官。研究发现,LXR参与脂质代谢的调节,同时也调控体内多种炎症因子的表达而参与炎症反应,与AMD发生关系密切[20]。LXR调节RPE顶端和基底膜的ABCA1表达,参与RPE脂质代谢的调节,维持RPE脂质代谢稳态,该通路受损可引发视网膜膜脂紊乱[21]。LXRα缺失导致小鼠视功能受损,视网膜外层脂质累积和炎症因子的上调[22]。另外,LXRα-ABCA1轴可缓解Aβ1-40诱导的RPE细胞炎症和衰老反应[13]。过氧化脂质诱导RPE细胞炎症发生,我们推测LXR是RPE细胞脂质代谢与炎症调节的中心,可能成为干性AMD的潜在治疗靶点。
本研究证实,GW3965通过同时激活LXRα、LXRβ,上调ABCA1表达,促进RPE细胞内脂质代谢与清除。LXRs的激活不仅减少过氧化脂质堆积,并减少RPE细胞凋亡。同时,GW3965通过调节LXRβ-Caspase1-IL-1β,导致RPE细胞晚期凋亡、坏死,而LXRα则与RPE细胞早期凋亡关系更密切。综上所述,LXRs通过调节RPE细胞脂质代谢,改善氧化脂质对RPE细胞的损伤,并通过LXRβ-Caspase1-IL-1β通路减少RPE保护RPE细胞。但LXRα通过何种途径减少RPE早期凋亡的机制仍不清楚,两种分型对脂质代谢的调节作用有何异同也暂不清楚,有待进一步观察和研究。

