毛樱桃总黄酮对全身炎症反应小鼠的保护作用
张铮旭,程子豪,陈 曦,张成义
(1.北华大学药学院,吉林 吉林 132013;2.北华大学基础医学院,吉林 吉林 132013)
全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)是机体在受到各种严重感染、创伤、灼伤等感染与非感染刺激时,导致炎症细胞过度激活并释放大量的炎症因子,从而引发的一种难以控制的全身性瀑布式炎症反应综合征,是机体在进行自我修复过程中出现过度应激反应的一种临床过程,严重者可导致多器官功能障碍[1-2].有研究[3-4]表明:SIRS患者存在着严重的炎症反应,部分患者治疗后期病情或出现突然加重情况,并危及生命.
毛樱桃果实中富含维生素、有机酸和黄酮等物质,药用价值较高[5].黄酮是一种广泛存在于植物中的天然物质,具有抗肿瘤、抗真菌和抗炎等作用[6-7].本课题组前期研究[5,8]显示:毛樱桃总黄酮(Prunustomentosathunb total flavones,PTF)具有明确的抗炎作用,但对酵母多糖(zymosan,ZYM)诱导的全身炎症反应综合征小鼠是否具有保护作用尚不清楚.因此,本研究旨在观察PTF对酵母多糖诱导全身炎症反应综合征小鼠的影响,从而为PTF抗SIRS研究奠定基础.
1 材料与方法
1.1 试验动物、主要仪器和试剂
清洁级ICR雄性小鼠(长春市亿斯实验动物技术有限责任公司)60只,6~8周龄,体质量18~22 g.毛樱桃总黄酮(北华大学药学院实验室自制);酵母多糖(Sigma公司,美国);无水乙醇(天津市大茂化学试剂厂);地塞米松磷酸钠注射液(天津药业焦作有限公司);TNF-α、IL-1β及IL-6酶联免疫吸附法试剂盒(北京索莱宝科技有限公司);超氧化物歧化酶(SOD)和丙二醛(MDA)检测试剂盒(南京建成生物科技有限公司);680型酶标仪(Bio-Rad公司,美国).
1.2 SIRS动物模型的建立
将酵母多糖粉剂加入生理盐水(100 mg/mL)中高频振荡30 min,形成均匀悬液,再放入100 ℃水浴锅中消毒灭菌80 min,冷却后置于4 ℃冰箱备用.造模前将酵母多糖混悬液加热至40 ℃,摇晃均匀后使用.末次给药1 h后,采用腹腔注射酵母多糖混悬液法制作小鼠SIRS模型,空白组小鼠腹腔注射等体积的生理盐水.SIRS动物造模成功标准:直肠温度较正常或伤前升高或降低1 ℃;白细胞总数超过对照值的2倍或减少50%;脏器有病理学改变;相关细胞因子发生改变[9-10].
1.3 动物分组与给药
将60只小鼠适应性饲养1周后随机分为6组,即空白组、模型组、地塞米松组(0.125 mg/kg)、PTF低、中、高剂量组(100、200、400 mg/kg),每组10只.地塞米松和PTF各剂量给药组预防性灌胃给药7 d,末次给药前1 d各组动物禁食不禁水.给药1 h后,模型组、地塞米松组及PTF各剂量给药组小鼠腹腔注射酵母多糖混悬液500 mg/kg,空白组小鼠腹腔注射等体积生理盐水.
1.4 小鼠体温与白细胞检测
给药期间及末次给药前测量小鼠肛温,造模24 h后,再次测量小鼠肛温;然后麻醉小鼠并眼球取血,取全血20 μL,置于装有180 μL白细胞稀释液的EP管中,混匀,进行白细胞计数.
1.5 小鼠血清中炎症细胞因子含量检测
取小鼠全血,在室温静置30 min,4 ℃离心,3 000 r/min离心15 min后取血清,按照酶联免疫吸附法检测细胞因子TNF-α、IL-1β及IL-6的含量.取血清,用酶标仪检测SOD活性和MDA的含量.
1.6 HE染色后小鼠病理形态学表现
将小鼠麻醉处死后,取肺组织、肾组织及肝组织固定于10%的甲醛中,石蜡包埋,5 μm切片,HE染色,光学显微镜下观察各组小鼠的肺组织、肾组织和肝组织病理形态学表现.
1.7 统计学分析

2 结 果
2.1 PTF对SIRS模型小鼠体温的影响
与空白组比较,模型组小鼠体温显著降低(P<0.01);与模型组比较,PTF中、高剂量组和地塞米松组小鼠的体温均显著升高(均P<0.01);造模前各组小鼠体温比较差异均无统计学意义(P>0.05).见表1.
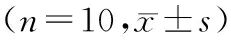
表1 PTF对SIRS小鼠体温的影响Tab.1 Effect of PTF on body temperature in mice with SIRS
2.2 PTF对SIRS模型小鼠白细胞数量的影响
与空白组比较,模型组小鼠白细胞数量显著减少(P<0.001);与模型组比较,PTF中、高剂量组和地塞米松组均可显著提高SIRS模型小鼠白细胞数量(均P<0.05).见图1.
2.3 PTF对SIRS模型小鼠血清中TNF-α、IL-1β及IL-6含量的影响
与空白组比较,模型组小鼠血清中TNF-α、IL-1β及IL-6的含量显著提高(P<0.001);与模型组比较,PTF中、高剂量组和地塞米松组均可显著降低SIRS模型小鼠血清中TNF-α、IL-1β及IL-6的含量(均P<0.05).见图2~4.
注:与空白组比较,###.P<0.001;与模型组比较,*.P<0.05.图1PTF对SIRS小鼠白细胞数量的影响Fig.1Effect of PTF on white blood cell in mice with SIRS注:与空白组比较,###.P<0.001;与模型组比较,***.P<0.001.图2PTF对SIRS小鼠血清中TNF-α含量的影响Fig.2Effect of PTF on the level of TNF-α in peripheral blood of mice with SIRS注:与空白组比较,###.P<0.001;与模型组比较,*.P<0.05,**.P<0.01,***.P<0.001.图3PTF对SIRS小鼠血清中IL-1β含量的影响Fig.3Effect of PTF on the level of IL-1β in peripheral blood of mice with SIRS注:与空白组比较,###.P<0.001;与模型组比较,***.P<0.001.图4PTF对SIRS小鼠血清中IL-6含量的影响Fig.4Effect of PTF on the level of IL-6 in peripheral blood of mice with SIRS
2.4 PTF对SIRS模型小鼠血清中SOD活性和MDA含量的影响
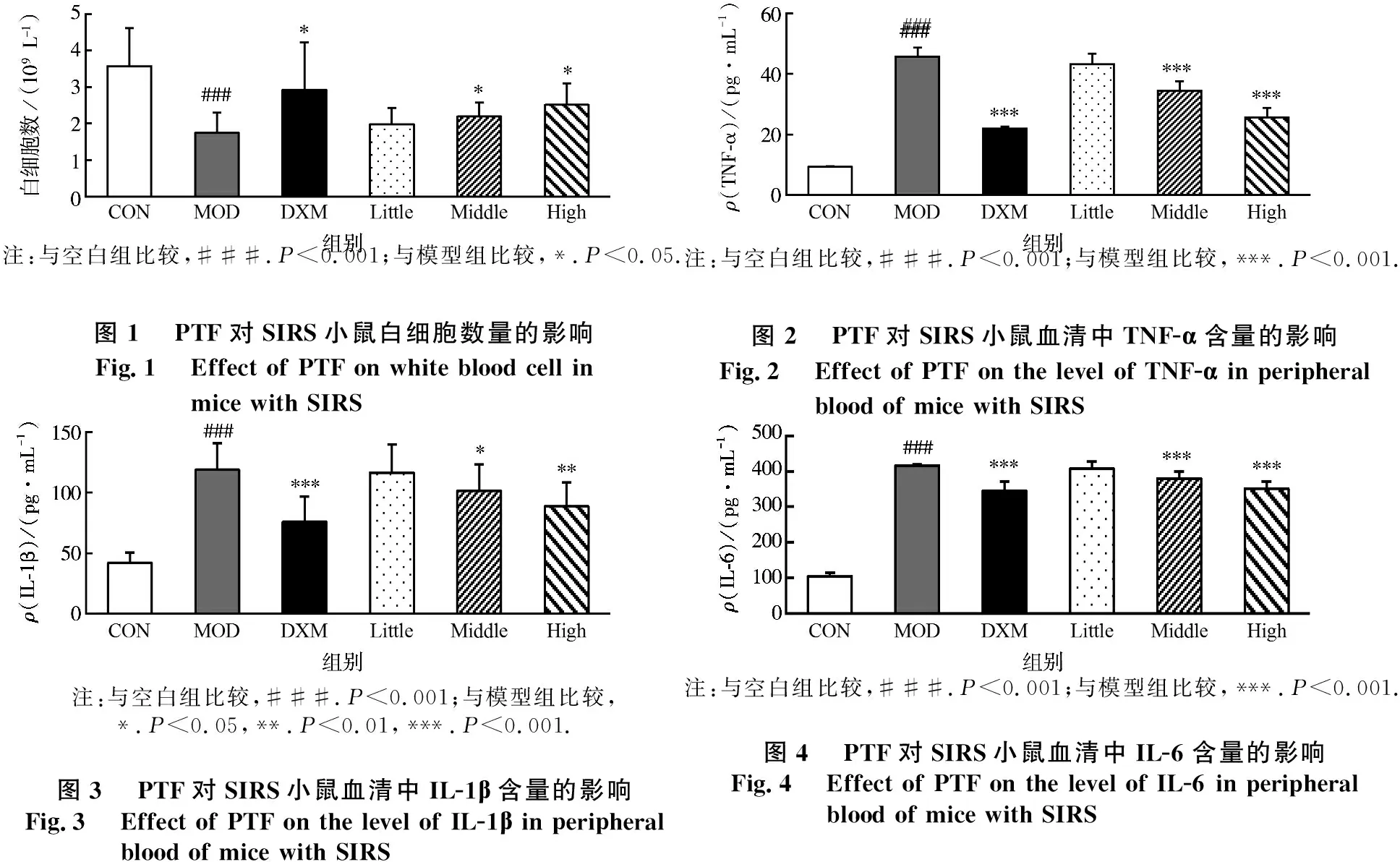
与空白组比较,模型组小鼠血清中SOD活性显著降低,而MDA含量显著升高(P<0.05);与模型组比较,PTF高剂量组和地塞米松组均可显著提高SIRS模型小鼠血清中SOD的活性,且均可显著降低SIRS模型小鼠血清中MDA的含量(均P<0.05).见图5~6.
注:与空白组比较,#.P<0.05;与模型组比较,*.P<0.05.图5PTF对SIRS小鼠血清中SOD含量的影响Fig.5Effect of PTF on the level of SOD in peripheral blood of mice with SIRS注:与空白组比较,##.P<0.01;与模型组比较,*.P<0.05.图6PTF对SIRS小鼠血清中MDA含量的影响Fig.6Effects of PTF on the level of MDA in peripheralblood of mice with SIRS
2.5 PTF对SIRS模型小鼠脏器组织病理学影响
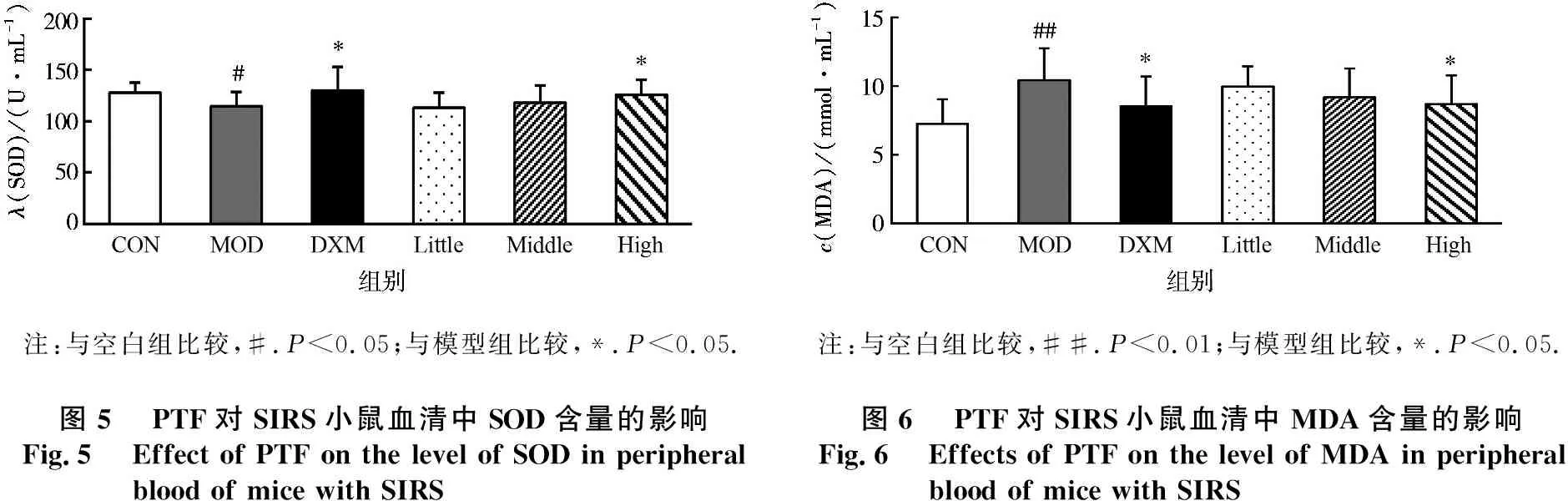
病理学结果显示:空白组肺组织结构清晰,支气管和肺泡的结构完整正常,充气良好;支气管黏膜完整,无明显充血及炎细胞浸润,肺泡壁厚薄一致.见图7 a.模型组肺组织结构紊乱,充气量明显减少;肺泡壁增厚、塌陷融合,肺泡大小不一且少部分肺泡萎陷;大量炎细胞浸润,细支气管管腔狭窄;毛细血管内皮细胞肿胀,肺间质与肺泡腔小片状出血.见图7 b.PTF中、高剂量组和地塞米松组肺组织充气量明显增加,萎陷的肺泡数量减少,肺泡扩张较为广泛,炎细胞浸润减少.见图7 c、e、f.
a.CON;b.MOD;c.DXM;d.PTF(100 mg/kg);e.PTF(200 mg/kg);f.PTF(400 mg/kg).图7 PTF对SIRS小鼠肺组织的影响Fig.7 Effect of PTF on lung issue in mice with SIRS
病理学结果显示:空白组肾组织结构清晰,无细胞肿胀、炎细胞浸润及蛋白渗出.见图8 a.模型组肾组织皮质苍白,肾小球萎缩,肾小管扩张且腔内有时可见脱落的坏死组织;浆细胞和纤维蛋白渗出,间质可见细胞肿胀、出血和散在的淋巴细胞浸润.见图8 b.PTF高剂量组和地塞米松组肾小管上皮细胞肿胀程度减轻,蛋白渗出和炎细胞浸润减少;肾间质轻度充血、水肿,肾小管腔内偶见脱落的坏死组织.见图8 c、f.
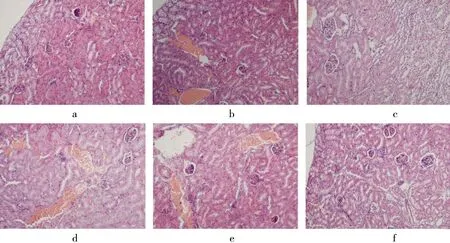
a.CON;b.MOD;c.DXM;d.PTF(100 mg/kg);e.PTF(200 mg/kg);f.PTF(400 mg/kg).图8 PTF对SIRS小鼠肾组织的影响Fig.8 Effect of PTF on kidney issue in mice with SIRS
病理学结果显示:空白组肝小叶结构清晰,肝细胞排列整齐且大小和形态正常,胞质丰富,未见明显的炎症细胞浸润,未见细胞点状坏死和变形.见图9 a.模型组肝小叶结构紊乱,组织中可见肝细胞细胞肿胀,坏死处可见肝血管扩张充血,肝细胞片状坏死及大量炎细胞浸润.见图9 b.PTF高剂量组和地塞米松组肝脏结构较为清晰,肝细胞排列比较整齐;细胞点状坏死程度减轻,细胞肿胀程度明显减轻,仅可见少量炎细胞浸润.见图9 c、f.
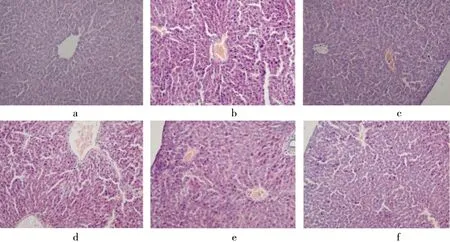
a.CON;b.MOD;c.DXM;d.PTF(100 mg/kg);e.PTF(200 mg/kg);f.PTF(400 mg/kg).图9 PTF对SIRS小鼠肝组织的影响Fig.9 Effect of PTF on liver issue in mice with SIRS
3 讨 论
SIRS是一种危重急症常见的炎症反应,是因机体在遭受感染或外源损伤时引起的过度应激反应,是机体在修复和生存过程中出现的一种病理过程.在出现严重感染时,机体大量释放多种细胞因子与炎症介质,如IL-1β、TNF-α及IL-6等炎症因子,可抑制单核-巨噬细胞活化,最终导致机体发生免疫紊乱和炎症失控,从而产生“瀑布效应”[11-12].SIRS控制不当会引发一系列症状,严重者通常会发展成多器官功能障碍,如肺损伤、肝损伤及肾损伤等,其中肺损伤是SIRS发生后较早出现同时也是最常见的并发症[13].
酵母多糖是大分子多糖成分,来源于酿酒酵母细胞壁的物质,低剂量酵母多糖腹腔注射动物体内可激活酵母多糖-巨噬细胞,诱导大量的炎症介质,造成炎症反应,从而成功构建SIRS模型,广泛应用于SIRS和多器官功能障碍的研究.该炎症模型致病因素简单明确,制备步骤便于复制,无外源性感染因素,具有明显的全身炎症反应表现[14].本研究中,小鼠腹腔注射500 mg/kg酵母多糖混悬液后,小鼠体温下降,白细胞总数减少,血清中炎症因子IL-1β、TNF-α及IL-6含量升高,肺组织、肾组织及肝组织发生病理学改变,均提示小鼠SIRS模型成功建立.
抑制炎症因子的大量释放是降低SIRS病程恶化的关键,其中以IL-1β、TNF-α及IL-6最为重要.IL-1β、TNF-α及IL-6是机体重要的炎症反应指标,参与各种炎症反应,是目前研究较多的炎症因子.IL-1β的生物学效应广泛,是免疫宿主反应的前炎症细胞因子,可激活体内巨噬细胞分泌炎症因子,能够提高其他炎症因子的表达,促进炎症细胞的趋化和游走,引起炎症反应,在炎症和自身免疫性疾病中发挥着重要作用[15];IL-6由巨噬细胞、成纤维细胞及内皮细胞释放,在机体发生炎症反应时,血清或血浆中的IL-6水平会显著上升,被认为是炎症反应的重要指标;TNF-α是SIRS的始发因子,同时也是肿瘤坏死因子家族的重要成员,可激活各种炎症细胞,加剧炎症反应,是一种经典的炎症因子.
炎症是机体在应对各类感染或组织损伤时所产生的以刺激性防御反应为主的过程,而氧化应激也是炎症反应过程中的一个重要组成部分,其中SOD和MDA是评价机体氧化应激水平的重要指标.SOD是机体内清除超氧自由基中重要的抗氧化酶,具有抗炎、抗衰老及抗氧化等作用,其活力的高低反映了机体抗氧化能力;MDA是体内脂质被自由基攻击所产生的过氧化终产物,其含量的高低可反映氧自由基含量变化和体内脂质过氧化程度.本研究结果显示:模型组小鼠腹腔注射酵母多糖混悬液诱导SIRS后,小鼠血清中的IL-1β、IL-6和TNF-α含量显著升高,SOD活性显著下降,MDA含量显著上升;经过PTF预处理后,小鼠血清中炎症因子IL-1β、IL-6和TNF-α含量显著降低,SOD活性显著升高,而MDA含量显著降低,提示PTF可以有效减轻并预防酵母多糖诱导的小鼠SIRS反应.
病理学结果显示:模型组小鼠肺组织结构紊乱,大量炎症细胞浸润,充气量明显减少;肾组织皮质苍白,肾小球萎缩,可见细胞肿胀、出血和散在的淋巴细胞浸润;肝组织结构紊乱,可见肝细胞片状坏死及大量炎症细胞浸润.经PTF预处理后,小鼠肺组织、肾组织及肝组织病理学病变程度均明显减轻,提示PTF可有效减轻酵母多糖诱导的SIRS小鼠肺组织、肾组织及肝组织损伤.
综上所述,PTF可有效预防并降低由酵母多糖导致的小鼠SIRS反应,其作用机制可能是通过降低炎症反应强度、减少氧化应激损伤进而对SIRS起到有效保护作用的.

