贝伐珠单抗联合奥沙利铂和希罗达治疗晚期结直肠癌的临床效果
单桂芹
江苏省南通市通州区人民医院肿瘤科,江苏南通 226300
结直肠癌(CRC)是临床常见病症之一,属于恶性肿瘤的一种,由于早期缺乏特异性症状,多数患者于临床确诊时病情已发展至晚期, 丧失手术根治机会,多采用化疗减缓患者病情进展[1]。 临床用于晚期CRC治疗的一线化疗药物种类较多,包括氟尿嘧啶、伊立替康、奥沙利铂及希罗达等,虽可在一定程度上延长患者生存期,但治疗有效率仅有不到50%[2]。 大量研究发现,在CRC 发生发展过程中,新生血管起到了重要作用, 而贝伐珠单抗作为抗血管内皮生长因子(VEGF)的一种单克隆抗体,与一线化疗药物联合用药,可明显提高疗效,但对于该种治疗方案影响患者免疫功能的研究尚少[3-4]。 故该次研究选取2015 年1月—2020 年6 月该院收治的81 例晚期CRC 患者为研究对象, 研究晚期CRC 应用贝伐珠单抗联合希罗达及奥沙利铂治疗的效果,现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的晚期CRC 患者81 例为研究对象,按随机数字表法分为对照组(40 例)和观察组(41例)。 入组病例中,对照组男26 例,女14 例;年龄36~81 岁,平均(51.65±2.26)岁。观察组男27 例,女14 例;年龄38~80 岁,平均(51.19±2.31)岁。 两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准: ①均经手术或肠镜等检查病理诊断确诊为晚期CRC;②预计生存期>3 个月;③年龄≥18 岁;④患者资料完整;⑤患者知情同意;⑥获医学伦理委员会批准。排除标准:①合并恶性肿瘤者;②对该研究药物过敏者;③处于哺乳期或妊娠期者;④合并其他恶性肿瘤者;⑤合并活动性肠炎及炎性肠病者;⑥脑转移者;⑦中途退出者;⑧合并心肝肾功能严重不全者;⑨合并精神疾病者;⑩合并消化道出血者;合并完全性肠梗阻者。
1.2 方法
对照组给予奥利沙铂(国药准字H20000337;规格:50 mg)联合希罗达(国药准字H20073024;规格:0.5 g)治疗,奥沙利铂剂量为130 mg/m2,静脉滴注给药,时间为90 min;希罗达剂量为1 000 mg/m2,第1~14 天口服给药,2 次/d,21 d 为1 个治疗周期,连续治疗3 个周期。
观察组在对照组基础上加用贝伐珠单抗(注册证号S20170035;规格:100 mg)治疗,剂量为7.5 mg/kg,静脉滴注给药,21 d 为一个治疗周期, 连续治疗3 个周期。 于化疗前,所有患者均给予预防呕吐等治疗。
1.3 观察指标
①近期疗效:以实体瘤疗效评定标准评估患者近期疗效:所有目标病灶均消失,且维持≥4 周为完全缓解(CR);基线病灶最大径之和减少≥30%,且维持≥4 周为部分缓解(PR);基线病灶最大径之和减少<30%或增加<20%为疾病稳定(SD);基线病灶最大径之和增加≥20%或出现新病灶为疾病进展(PD)。疾病控制率 (DCR)=(CR 例数+PR 例数+SD 例数)/总例数×100.00%;有效率(RR)=(CR 例数+PR 例数)/总例数×100.00%。
②免疫功能:治疗前、治疗后1 个月,于清晨空腹状态下采集患者5 mL 肘静脉血,采用流式细胞仪(型号:BDFACSCalibur)测定血清CD3+、CD4+、CD8+水平,并计算CD4+/CD8+。
③肿瘤标志物:治疗前、治疗后1 个月,于清晨空腹状态下采集患者5 mL 肘静脉血,经离心处理(转速3 000 r/min,时间10 min)取血清待检;以双抗体夹心酶联免疫法测定卵巢癌相关抗原(CA125)、肠癌相关抗原(CA199)水平;采用Abbott Axsym 型免疫分析仪, 以电化学发光微粒子免疫分析法测定癌胚抗原(CEA)水平。
④不良反应:记录患者脱发、恶心呕吐、血小板减少、腹泻、肝肾损伤及高血压发生情况。
1.4 统计方法
采用SPSS 19.0 统计学软件处理数据,计量资料以(±s)表示,组间差异比较采用t 检验;计数资料以频数和百分率(%)表示,组间差异比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者近期疗效对比
疾病控制率比较,观察组(85.37%)高于对照组(57.50%),差异有统计学意义(P<0.05);治疗有效率比较,观察组(46.34%)高于对照组(25.00%),差异有统计学意义(P<0.05),见表1。
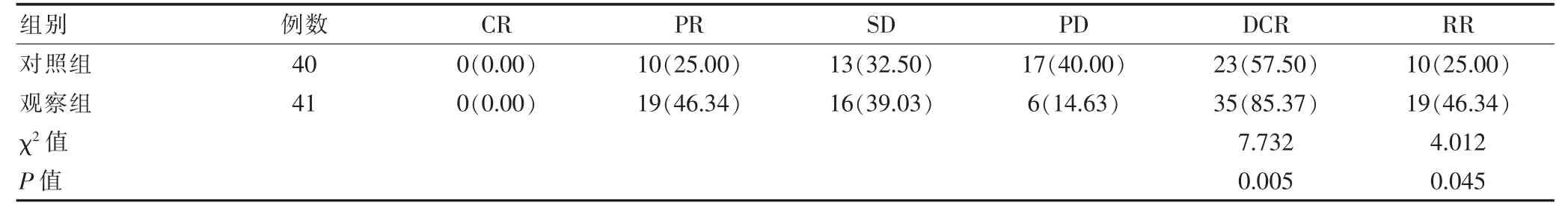
表1 两组患者近期疗效比较[n(%)]
2.2 两组患者免疫功能对比
与对照组比较, 观察组治疗后CD3+、CD4+及CD4+/CD8+水平均更高,CD8+水平更低,差异有统计学意义(P<0.05),见表2。
表2 两组患者免疫功能比较(±s)
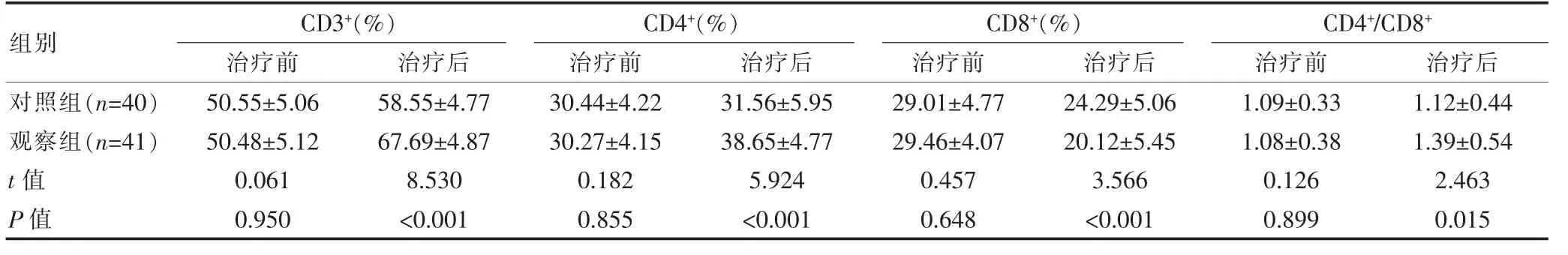
表2 两组患者免疫功能比较(±s)
组别对照组(n=40)观察组(n=41)t 值P 值CD3+(%)治疗前治疗后50.55±5.06 50.48±5.12 0.061 0.950 58.55±4.77 67.69±4.87 8.530<0.001 CD4+(%)治疗前治疗后CD8+(%)治疗前治疗后30.44±4.22 30.27±4.15 0.182 0.855 31.56±5.95 38.65±4.77 5.924<0.001 29.01±4.77 29.46±4.07 0.457 0.648 24.29±5.06 20.12±5.45 3.566<0.001 CD4+/CD8+治疗前治疗后1.09±0.33 1.08±0.38 0.126 0.899 1.12±0.44 1.39±0.54 2.463 0.015
2.3 两组患者肿瘤标志物水平对比
与对照组比较, 观察组治疗后CA125、CA199 及CEA 水平均更低,差异有统计学意义(P<0.05),见表3。
表3 两组患者肿瘤标志物水平比较(±s)
组别CA125(μg/mL)治疗前治疗后CA199(μg/mL)治疗前治疗后CEA(ng/mL)治疗前治疗后对照组(n=40)观察组(n=41)t 值P 值72.88±5.65 72.16±5.74 0.568 0.571 59.55±4.65 41.55±5.46 15.955<0.001 101.55±4.65 101.59±4.51 0.039 0.968 84.66±5.48 67.98±4.48 15.014<0.001 30.66±4.65 29.78±4.69 0.847 0.399 22.44±4.65 15.53±5.09 6.374<0.001
2.4 两组患者不良反应对比
不良反应发生率比较,观察组(26.83%)低于对照组(70.00%),差异有统计学意义(P<0.05),见表4。

表4 两组患者不良反应情况比较[n(%)]
3 讨论
CRC 是消化道一种常见恶性肿瘤, 具有病情严重、进展迅速等特点,包括来自肛管、直肠、降结肠及盲肠等多部位的恶性肿瘤,以直肠最为常见,占比高达70%,其次是乙状结肠,占比为14%[5]。 由于多数CRC 患者早期发病时缺乏特异性症状, 多表现为恶心、腹泻、腹胀及腹痛等症状,无法引起患者重视,使其于临床就诊时病情已发展至晚期,且癌细胞多发生转移,进而错失最佳治疗时机,多采用化疗方案,以延长患者生存期。希罗达联合奥沙利铂是临床治疗晚期CRC 的一线治疗方案,而近年来,贝伐珠单抗作为一种分子靶向药物, 被广泛应用于联合化疗治疗晚期CRC,并成为标准治疗方案[6]。
该研究发现,观察组疾病控制率(85.37%)高于对照组(57.50%)(P<0.05);观察组治疗有效率(46.34%)高于对照组(25.00%)(P<0.05);与对照组比较,观察组治疗后CD3+、CD4+及CD4+/CD8+水平均更高,CD8+水平更低(P<0.05);观察组不良反应发生率,(26.83%)低于对照组(70.00%)(P<0.05)。吕莉等[7]选取82 例晚期CRC 患者, 对其应用奥沙利铂和希罗达联合贝伐珠单抗治疗的疗效进行研究发现, 研究组疾病控制率、总有效率分别为82.93%、46.34%,明显高于对照组的60.98%、21.95%,提示贝伐珠单抗联合奥沙利铂和希罗达治疗晚期CRC,可明显提高疗效,与该研究结果一致。分析原因,贝伐珠单抗联合化疗药物,可发挥出抗VEGF 作用, 通过与VEGF 进行特异性结合,以达到阻碍新生血管生成的目的,促使肿瘤现有血管趋于正常,进而延缓肿瘤生长,并抑制肿瘤转移[8-10]。CA199 属于消化道肿瘤相关抗原的一种, 而CEA、CA125 于多种恶性肿瘤中均存在表达[11]。 既往研究证实, 相较于健康人群, 晚期CRC 患者血清CA199、CA125 及CEA 水平均更高, 且与疾病严重程度有着直接相关性[12-14]。 该研究发现,与对照组比较,观察组治疗后CA125、CA199 及CEA 水平均更低(P<0.05);提示贝伐珠单抗联合化疗药物治疗晚期CRC, 可下调患者肿瘤标志物表达,以改善患者预后。分析原因,贝伐珠单抗可直接作用于肿瘤组织,促使现有血管退化,并抑制新生血管生成,以阻止肿瘤进展,降低血清肿瘤标志物水平[15-17]。 此外,贝伐珠单抗用药后,可提高肿瘤血管壁通透性,有利于化疗药物输送于肿瘤组织,以增强肿瘤细胞对于药物的敏感度,增强抗肿瘤作用[18]。
综上所述,贝伐珠单抗联合奥沙利铂和希罗达治疗晚期CRC 的近期疗效显著,可延长患者生存期,对机体的免疫功能有促进作用。

