两种塞来昔布胶囊在健康受试者中不良事件的比较
张雪娇,左长英,鲍佳春,赵懿清
1.江南大学附属医院药物临床试验机构,江苏无锡 214041;2.四川国为制药有限公司临床研究部,四川眉山 620000
塞来昔布(celecoxib,CXB)是一种用于缓解急性或慢性疼痛的新型环氧合酶-2(COX-2)抑制药,1998年12 月31 日经美国食品及药物管理局批准在美国上市,2000 年8 月4 日经原国家食品药品监督管理局批准在我国上市[1-2]。 该药化学名称为4-[5-(4-甲基苯基)-3-(三氟甲基)-1H-1-吡唑-1-基] 苯磺酰胺,分子式为C17H14F3N3O2S,分子量为381.38 g/mol,其化学结构式,见图1[3]。不良事件(adverse event,AE)是指“受试者接受试验用药品后出现的所有不良医学事件, 但不一定与试验用药品有因果关系”,AE 是评价药物安全性的重要指标之一[4-5]。该研究旨在通过比较2018 年7—10 月84 例健康受试者在空腹或餐后状态下口服受试制剂或参比制剂塞来昔布胶囊0.2 g生物等效性试验中不良事件的发生情况,评价两种药物缓解急性或慢性疼痛的安全性。 现报道如下。
图1 塞来昔布化学结构式
1 材料与方法
1.1 资料来源
收集在无锡市中西医结合医院药物Ⅰ期临床试验研究室开展的一项塞来昔布胶囊随机、开放、两周期、两序列、双交叉、单次给药的健康人体空腹及餐后生物等效性试验中受试者的不良事件。该研究经无锡市中西医结合医院伦理委员会审查批准,所有受试者均在了解研究过程和风险的基础上自愿签署知情同意书。
1.2 方法
1.2.1 纳入与排除标准 纳入标准: ①充分了解试验目的、性质、方法以及可能发生的不良反应,自愿签署知情同意书;②年龄≥18 周岁,男女均有;③体质指数(BMI)在19.0~26.0 kg/m2范围内(包括临界值),男性体质量≥50.0 kg,女性体质量≥45.0 kg;④无心血管、肝脏、肾脏、血液和淋巴、内分泌、免疫、精神、神经、胃肠道系统等慢性疾病史或严重疾病史;⑤生命体征检查、体格检查、实验室检查、胸片、酒精呼气及药物滥用筛查、12 导联心电图结果显示无异常或异常无临床意义者;⑥试验期间无生育计划且自愿采取有效的物理避孕措施,无捐精/捐卵计划者;⑦女性非妊娠或非哺乳者;⑧能够进行良好的沟通,并且理解和遵守该项研究的各项要求。
排除标准:①对塞来昔布胶囊或任意药物成分有过敏史者或过敏体质者;②有吞咽困难或任何影响药物吸收的胃肠道疾病史;③在筛选前3 个月内接受过手术,或者计划在研究期间进行手术者,或接受过会影响药物吸收、分布、代谢、排泄的手术者;④有临床表现异常需排除的疾病; ⑤不能耐受静脉穿刺者,有晕针晕血史者;⑥乳糖不耐受者;⑦筛选前6 个月内有药物滥用史者;⑧在最后一次给药后6 个月内有生育计划或捐精/捐卵计划者, 女性妊娠试验结果为阳性者;⑨筛选前3 个月内参加过其他的药物临床试验或非本人来参加临床试验者;⑩筛选前3 个月内献血包括成分血或大量失血(≥200 mL),接受输血或使用血制品者;筛选前3 个月内每日吸烟量>5 支,或试验期间不能停止使用任何烟草类产品者;筛选前3个月内每周饮酒量>14 单位, 或试验期间不能禁酒者;在筛选前3 个月内每天饮用过量茶、咖啡和/或富含咖啡因的饮料者;筛选前1 个月内使用过任何的药物或接受过疫苗接种者;对饮食有特殊要求,不能接受统一饮食者;生命体征检查异常有临床意义者;实验室检查及辅助检查任何项目异常且有临床意义者;乙肝病毒、丙肝病毒抗体、抗人类免疫缺陷病毒抗体或抗梅毒螺旋体特异性抗体有一项或一项以上有临床意义者;酒精呼气试验或药物滥用筛查阳性者;自筛选至入院前1 天期间食用过巧克力、任何含咖啡因、含高嘌呤的食物或饮料等饮食者;在使用临床试验药物前发生急性疾病者;其他研究者判定不适宜参加的受试者。
1.2.2 药物信息 受试制剂(T):塞来昔布胶囊,规格:0.2 g,国药准字H20203357,产品批号:180203,有效期至2021 年2 月22 日,储存条件:室温,密闭保存。参比制剂(R):塞来昔布胶囊(西乐葆),规格:0.2 g,国药准字J20140072,产品批号:R55872,有效期至:2019 年5 月31 日,储存条件:室温,密闭保存。 以上试验药物均由四川国为制药有限公司提供并出具检验合格报告,江南大学附属医院药物临床试验机构药品库保管。
1.2.3 研究过程 研究开始前, 对所有可能参加研究的受试者进行教育。 随后进行筛选检查,由研究医生根据入选与排除标准进行评估,合格的受试者于入住当天按照筛选号从小到大的顺序获得随机号,根据随机表进入TR 或RT 序列组。 受试者每周期服药前空腹过夜≥10 h,第一周期服药当天应为空腹,TR 序列组的受试者单次口服受试制剂0.2 g (1 片),RT 序列组的受试者单次口服参比制剂0.2 g(1 片),在规定的时间点采集受试者血样。 第二周期服药当天,两序列组受试者进行交叉服药, 其他研究程序同第一周期。临床研究期间,研究医生或护士对受试者进行全程监护,观察所有受试者发生的任何不良事件,包括临床症状及生命体征异常、 实验室检查中出现的异常,记录其临床表现特征、严重程度、发生时间、结束时间、持续时间、处理措施及转归,并判定其与研究药物之间的相关性。 再重复1、2、3 的研究过程,区别在于第一周期高脂高热量餐后进行服药,其他步骤同1、2、3研究过程。
1.3 统计方法
采用SPSS 18.0 统计学软件对数据进行分析,计数资料以频数和百分比(%)表示,组间差异比较采用χ2检验。 P<0.05 为差异有统计学意义。
2 结果
2.1 空腹受试者完成情况
该研究空腹组共筛选130 例受试者,入组42 例,筛选成功率32.3%,完成41 例,见表1。

表1 受试制剂及参比制剂服用情况
2.2 餐后受试者完成情况
餐后组共筛选150 例受试者,入组42 例,筛选成功率28.0%, 完成40 例,2 例受试者第二周期入住当日因不良事件提前退出,未服用药物。 受试制剂及参比制剂具体服用情况,见表2。

表2 受试制剂及参比制剂餐后服用情况
2.3 生物等效性评价
健康受试者在空腹或餐后状态下口服0.2 g 塞来昔布胶囊后,其主要药代动力学参数Cmax、AUC0-t、AUC0-∞受试制剂相对参比制剂几何均值比的90%置信区间均在80.00%~125.00%等效区间内。 故在空腹及餐后条件下,受试制剂与参比制剂具有平均生物等效性。
2.4 两组受试者不良事件发生率比较
在空腹与餐后两组参与者中,83 例服用受试制剂的健康受试者发生不良事件9 例, 其中空腹组5例,餐后组4 例,占10.8%;82 例服用参比制剂的健康受试者发生不良事件12 例,其中空腹组5 例,餐后组7 例,占14.6%。 两者相比,差异无统计学意义(χ2=0.000、0.916,P>0.05),见表3。
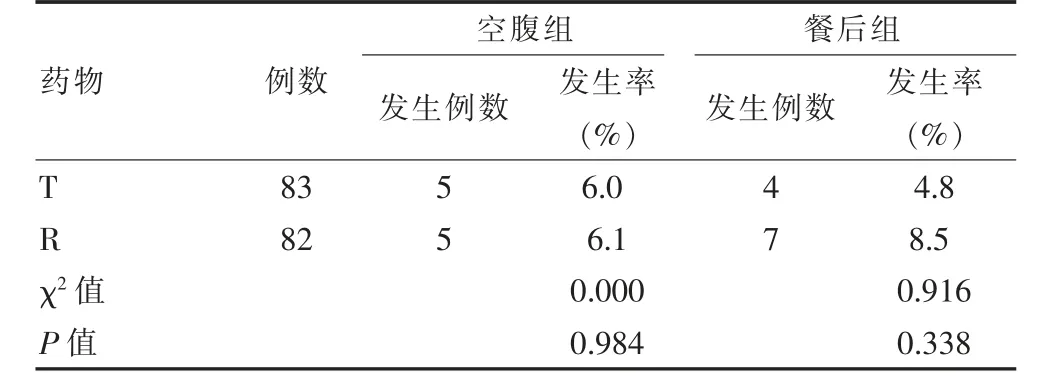
表3 两组受试者不良事件发生率比较
2.5 不良事件类型的分析
该研究使用 《监管活动医学词典》(MedDRA)术语进行编码,SOC/PT 进行分类分析,并参照《药品不良反应报告和监测工作手册》进行药物关系相关性判断[6-7]。 研究结果显示,共发生28 例次不良事件,其中高尿酸血症5 例次,高三酰甘油血症3 例次,丙氨酸氨基转移酶升高3 例次,尿路感染5 例次,血纤维蛋白原降低、血小板计数降低、白细胞计数升高、人绒毛膜促性腺激素增加、 天门冬氨酸氨基转移酶升高、血肌酸磷酸激酶升高、血乳酸脱氢酶升高、窦性心动过速、视网膜变性、发热、血尿症以及腹痛各1 例次。 在与研究药物相关性以及严重程度判断方面,研究过程中发生1 例次与研究药物很可能有关,13 例次与研究药物可能有关,12 例次与研究药物可能无关,2 例次与研究药物无关, 除3 例次严重程度为中度 (Ⅱ级),其余严重程度均为轻度(Ⅰ级),无严重不良事件。 所有不良事件均在停药后恢复正常或趋于平稳,未见有其他临床意义的症状、体征。 各系统不良事件统计列表,见表4。
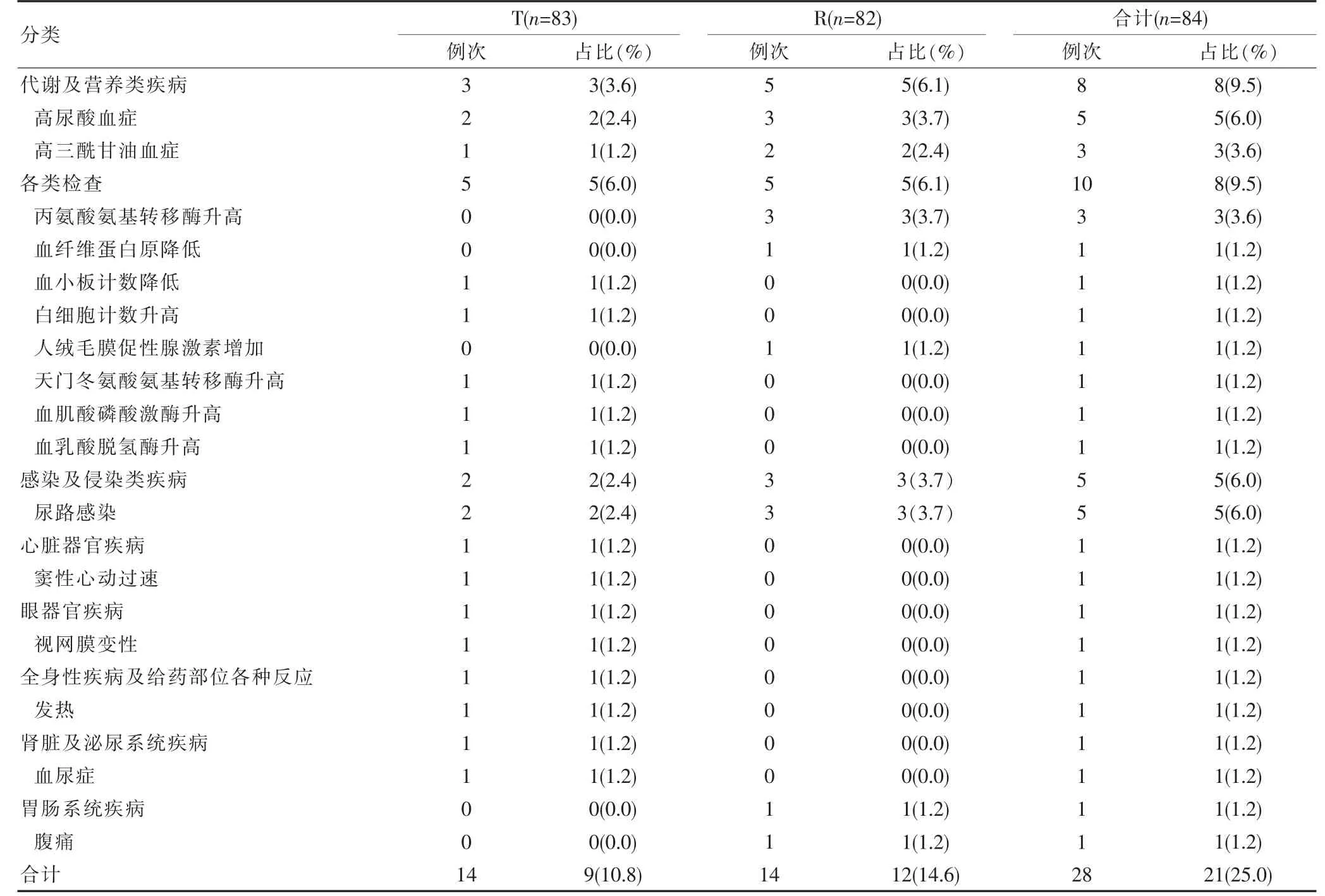
表4 各系统不良事件统计
3 讨论
塞来昔布作为一种新型非甾体抗炎药(NSAID),临床主要用于治疗急性期或慢性期骨关节炎(osteoarthritis,OA)和类风湿关节炎(rheumatoid arthrits,RA)的症状和体征[8]。此外,越来越多的学者开始关注塞来昔布在多种肿瘤如肺癌、乳腺癌、消化道恶性肿瘤防治过程中的重要作用[9-12]。 与其他非甾体类抗炎药相比, 塞来昔布能选择性抑制COX-2 阻止性前列腺素类物质的产生,达到抗炎、镇痛及退热作用,降低抑制COX-1 产生的胃肠道反应[13-14]。 王颖等[15]通过对塞来昔布不良反应文献回顾性分析57 例患者后发现, 塞来昔布所致不良反应主要累及皮肤、 消化、神经、呼吸、泌尿、心血管、血液等系统,与该研究不良事件类型基本一致。
该研究在评估受试制剂与参比制剂塞来昔布胶囊生物等效性的同时,收集并分析两种药物的不良事件发生率。 结果表明,两组药物均出现不同程度的不良事件, 受试制剂塞来昔布胶囊0.2 g 组不良事件发生率为10.84%,参比制剂塞来昔布胶囊0.2 g 组不良事件发生率为14.64%。 所有发生的28 例次不良事件程度均为轻中度,其中轻度(Ⅰ级)不良事件所占比例为89.3%,中度(Ⅱ级)不良事件所占比例为10.7%,无严重不良事件发生,这与胡梁深等[16]的研究中受试制剂塞来昔布胶囊组不良事件发生率为11.48%,参比制剂塞来昔布胶囊组不良事件发生率为13.68%,不良事件程度均为轻中度的结果一致。两种药物不良事件的类型相似, 主要临床表现为血小板计数降低、丙氨酸氨基转移酶升高、窦性心动过速、腹痛等。 此外,除临床报道常见的不良事件外,该研究还发现塞来昔布可能会引起天门冬氨酸氨基转移酶升高、血乳酸脱氢酶升高、血尿症以及尿路感染等,由于该研究样本量较少,出现以上症状与研究药物的相关性以及作用机制,有待进一步研究[17-18]。
综上所述, 受试者服用两种塞来昔布胶囊0.2 g的耐受性良好,两种药物均具有较好的安全性,但由于药物本身不良事件较多,故服用过程中应密切监测药物不良反应,及时调整临床给药方案,确保临床安全用药。

