人工智能辅助下三维可视化定位在早期非小细胞肺癌手术中的临床应用
杨景伟,刘萌,赵泽玉,郭明涛
山东第一医科大学附属青州医院(青州市人民医院)胸外科,山东潍坊 262500
肺癌的发病率及病死率均居恶性肿瘤第1 位[1]。可是肺癌的早期症状通常不明显,导致很多肺癌患者发现患病时已经到了中晚期,增加了治疗难度,明显缩短了患者的生存周期。但由于早期肺癌患者病灶通常较小,并且常位于肺实质内,胸腔镜手术时难以肉眼观察或使用手术器械探查到,手术者手指也不易触及病灶部位,经常给手术带来一定的困难和困扰[2]。早期肺癌由于病灶较小且通常位于肺实质内,胸腔镜手术时术者手指一般不能触及,手术器械探也难以发现[3]。临床常用CT 引导下乳腺穿刺定位针穿刺定位或者Hook-wire 定位等方法,有助于肺部病灶手术切除,但这些方法均有一定的创伤性及局限性,如肺内靠近纵隔面的病灶,定位就比较困难。
借助人工智能手段,通过三维可视化重建,可以对早期肺癌患者的病灶进行精准定位和辅助诊断,此方法为无创性操作,避免了穿刺定位的相关风险,可以做到精准定位及精准手术[4]。 该研究选择该院在2018年1 月—2020 年12 月收治的70例早期非小细胞肺癌患者,探讨了人工智能辅助下的三维可视化重建定位在早期非小细胞肺癌手术中的临床应用及效果,现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的70例早期非小细胞肺癌患者,观察组37例,对照组33例。 观察组37例,男17例,女20例;年龄28~70 岁,平均(50.06±7.26)岁;腺癌:21例,鳞癌16例,肺野外周型18例,肺野内侧型19例。 对照组33例,男15例,女18例;年龄26~71 岁,平均(51.71±6.83)岁;腺癌:19例,鳞癌14例,肺野外周型16例,肺野内侧型17例。 两组患者基线资料如年龄、性别、病理类型、病变位置等差异无统计学意义(P>0.05),具有可比性。 该研究通过医院医学伦理委员会批准同意,患者或家属对研究内容知情同意并签署同意书。
纳入标准:①早期非小细胞肺癌,术前或术后病理确诊;②心肺功能正常或能耐受肺部手术;③临床资料完整。
排除标准:①中晚期肺癌者;②全身状况差,不能耐受手术者;③严重心肺功能不全者;④临床资料不完整者。
1.2 方法
对照组:患者手术前进行CT 引导下乳腺穿刺定位针穿刺定位或者CT 引导下Hook-wire 定位等;根据患者肺部病灶的位置,采取相应合适的体位,进行肺部薄层CT 扫描,确定穿刺路径进行穿刺定位,定位针尖端最终位置位于肺部病灶深部肺组织周围5 mm 范围以内,确认为术前病灶定位成功,病灶定位完成后,需将患者胸部剩余外露定位钢丝用无菌敷贴固定[5]。
观察组: 患者手术前进行人工智能系统(Mimics Medical 21.0)辅助下的三维可视化重建定位。
早期非小细胞肺癌病灶在人工智能系统辅助下的三维可视化重建定位[6]:患者术前常规进行肺部薄层CT 扫描,将薄层扫描CT 影像数据导入人工智能系统,对拟行手术切除的早期肺癌患者病灶,通过人工智能三维可视化技术,对病灶及其周围靶段支气管、肺动静脉及其分支进行三维重建,以明确病灶所在的肺叶、肺段或亚段位置,明确病灶的大小、形态和分布,明确肺部病灶与靶段支气管、肺动静脉及其分支的解剖毗邻关系和可能存在的解剖变异,做到对肺部病灶的精准定位[4]。
1.3 观察指标
手术病灶定位准确率[8]:根据术中寻找病灶的难易程度及切除肺组织中病灶的位置与定位针或三维可视化重建定位确定病灶的位置予以对比、判断。
手术方式选择:包括肺叶切除手术、肺段切除手术及楔形切除手术等。
手术不良事件发生率:包括术前气胸、术前咯血、定位钩脱落或移位及结节定位困难等。
1.4 统计方法
采用SPSS 20.0 统计学软件进行数据分析,计数资料采用[n(%)]表示,组间比较进行χ2检验或Fisher精确概率法,P<0.05 为差异有统计学意义。
2 结果
2.1 两组肺癌患者手术病灶定位准确率比较
肺野外周型病灶,观察组与对照组肺癌患者的手术病灶定位准确率均较高,差异无统计学意义(P>0.05);肺野内侧型病灶,观察组肺癌患者的手术病灶定位准确率明显优于对照组,差异有统计学意义(P<0.05)。 见表1。
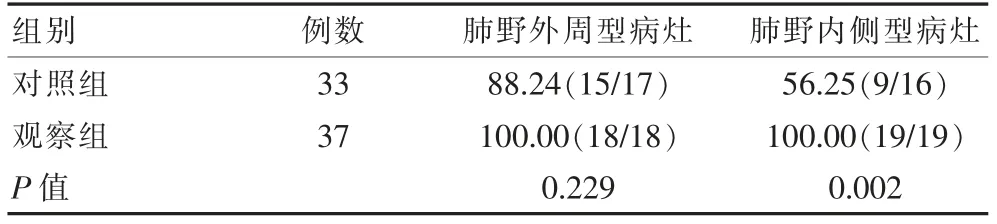
表1 两组肺癌患者手术病灶定位准确率比较(%)
2.2 两组患者手术方式选择比较
观察组肺癌患者的手术方式选择(楔形切除手术)和对照组相比差异无统计学意义(P>0.05);观察组肺癌患者的手术方式选择(肺叶切除手术、肺段切除手术)明显优于对照组,差异有统计学意义(P<0.05)。见表2。
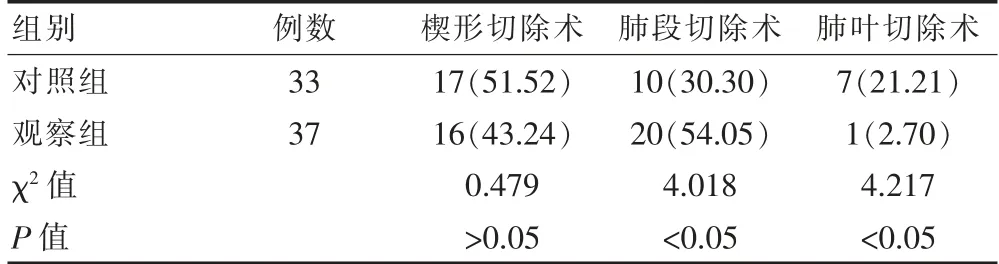
表2 两组患者手术方式选择比较[n(%)]
2.3 两组患者手术不良事件发生率比较
观察组肺癌患者的手术不良事件发生率(术前气胸、术前咯血、定位钩脱落或移位及结节定位困难)明显低于对照组,差异有统计学意义(P<0.05)。 见表3。

表3 两组肺癌患者手术不良事件发生率比较[n(%)]
3 讨论
肺癌是最常见的肺原发性恶性肿瘤,多数肺癌起源于支气管黏膜上皮。 肺癌起初发病较为隐匿,于早期常无明显的症状和体征,若缺乏有效的诊断措施,极易导致患者的病情被延误[8]。 国际上通常主张将原位癌和TNM 分期1a 期的NSCLC 称为早期NSCLC,外科手术是早期NSCLC 的首选治疗方法[9]。
人工智能(artificial intelligence,AI)是指智能机器依托计算机应用技术,模拟人类智能,以提高人类工作的能力和效率[10]。 使用人工智能系统(Mimics Medical 21.0)对薄层CT 影像进行三维可视化定位重建,实现图像了从二维到三维的转换,可以全方位、直观、准确地展示肺部病灶的立体情况,安全、有效、无创,为精准手术治疗提供了一个 “智能定位地图”[11]。 并且完美解决了传统手术中肺部结节探查、触摸、确认、定位及手术切除的困难和困扰[12]。
通过人工智能辅助下三维可视化重建,可以辨别肺部病灶的位置,分析病灶与肺动脉、肺静脉、支气管的解剖关系和可能存在的解剖变异[13],并充分利用胸腔内的解剖标志(肺裂、水平裂和斜裂交汇处等)和术中病灶的实际解剖情况,对肺部病灶进行精准定位,包括病灶所在的肺段和(或)亚段,从而进行精准地肺叶切除、肺段切除或肺楔形切除手术[14]。 在保证病灶切缘足够安全后,最大程度保存健康的肺组织,提高肺部手术的安全性和准确性,缩短术中手术时间,减小患者损伤,提高患者远期疗效[15]。
肺野外周型病灶,观察组与对照组肺癌患者的手术病灶定位准确率均较高,但差异无统计学意义(P>0.05);肺野内侧型病灶,观察组肺癌患者的手术病灶定位准确率(100.00%)明显优于对照组(56.25%)(P<0.05);借助人工智能手段,通过三维可视化重建,对早期肺癌患者的肺部病灶进行定位,可达100%定位准确,观察组患者术中只有1例定位困难。 张楼乾等[16]研究表明,40例患者共46 枚结节,通过进行术前三维重建,术中均成功定位找到结节,患者结节手术切除率为100%,无相关肺穿刺定位并发症,与该次研究结果一致,定位准确率100%。观察组肺癌患者的手术方式选择(楔形切除手术)和对照组相比差异无统计学意义(χ2=0.479,P>0.05);观察组肺癌患者的手术方式选择(肺段切除手术、肺叶切除手术)明显优于对照组(P<0.05);观察组肺癌患者的手术不良事件发生率(结节定位困难2.70%) 明显低于对照组(术前气胸63.64%、术前咯血48.48%例、定位钩脱落或移位24.24%及结节定位困难21.21%)(P<0.05)。 陈学瑜等[17]研究显示,有48例患者(47.1%)在定位后出现穿刺定位区域肺组织内的出血,53例患者(51.9%)定位后出现穿刺侧少量气胸,16例患者(15.7%)在随后进行的手术中发现定位针或定位钩完全从肺组织上脱落。穿刺并发症结果与该研究相一致。
术者可以根据术前重建的三维图像,顺利进行拟定的手术方案,精准切除病灶,避免术中病灶不能及时发现和精准定位,造成手术困扰和困难[18];观察组肺癌患者的手术不良事件发生率明显低于对照组(P<0.05),对照组患者术前有创操作并发症和不确定性因素较多,对患者及家属造成一定心理压力。 彭明政等[19]研究显示,人工智能辅助下的三维可视化重建有利于肺部病灶手术的精准定位,可以真正做到无创,与该研究结果一致。通过三维可视化重建技术和解剖标志相结合,可以更精确地进行手术,有效提高手术切除率,不仅能够完全切除病灶,达到根治的手术效果,而且能有效改善患者术后身体应激水平及保护心肺功能[20]。
综上所述,早期非小细胞肺癌患者手术前进行人工智能辅助下的三维可视化重建定位,可以帮助明确早期肺癌患者的病灶位置、靶段血管、支气管等结构的形态和空间分布,有利于手术前精准诊断和个体化手术方案的精准实施,明显提高手术病灶定位准确率,降低手术难度,提高肺段切除手术成功率,降低手术不良事件的发生,对提高早期非小细胞肺癌患者的手术治疗效果和保护肺功能具有重要临床价值。

