老年COPD 并发骨质疏松及骨量减少的相关风险因素分析
陆志杰
南京南钢医院呼吸内科,江苏南京 210035
慢性阻塞性肺疾病为持续存在的气流受限、不完全可逆及进行性发展为特征的疾病,发病之后可累及肺脏,也会引发全身不良反应。近年随着研究深入,发现慢阻肺患者常会合并心血管疾病、焦虑及骨质疏松等问题,且可直接影响患者疾病治疗。 骨质疏松作为慢阻肺患者常见并发症可直接影响患者活动能力,降低生活质量,由于患者肺部功能差,活动能力降低,合并骨质疏松后可极大提升跌倒以骨折风险[1]。 现阶段虽然对于慢阻肺骨代谢研究较多,但对于合并骨质疏松患者具体影响因素分析却较少。为帮助患者早期控制疾病发展,有效提升患者预后生活质量,该研究选取该院2019 年9 月—2020 年8 月老年慢性阻塞性肺疾病(chronic obstructivepulmonary disease,COPD)患者100例,分析老年COPD 并发骨质疏松及骨量减少的相关风险因素,从而为之后临床针对COPD 并发骨质疏松及骨量减少的治疗手段进行优化提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的老年COPD 患者100例为研究对象。 纳入标准:①患者完全符合中华医学会慢性阻塞性肺疾病诊治指征内判定标准[2];②患者年龄均为60 岁以上;③患者慢阻肺疾病并未急性加重;④患者均签署知情同意书。 排除标准:①合并肝肾功能不全患者;②合并全身免疫性疾病患者;③合并继发性骨质疏松患者;④合并甲状旁腺功能亢进或者皮质醇增多症患者。慢阻肺合并骨质疏松患者30例,男16例,女14例;病程4~30 年,平均(9.86±0.16)年。慢阻肺合并骨量减少患者30例,男17例,女13例;病程4~28年,平均(9.79±0.23)年。 正常COPD 患者40例,男23例,女17例;病程4~29 年,平均(9.77±0.21)年。 3 组患者病程、性别差异无统计学意义(P>0.05),具有可比性。 该次研究通过医学伦理委员会批准。
1.2 方法
收集患者基础性信息,其中主要包括患者年龄、体质指数(body mass index,BMI)、吸烟指数等状况。测量患者骨密度,主要使用Prodiqy primo 型X 射线骨密度检测仪测量患者腰椎骨密度和股骨颈骨密度T 值,其中T≥-1SD 属于骨量正常;-2.5SD<T<-1SD属于骨量减少,T≤-2.5SD 则为骨质疏松。
一秒用力呼气容积(forced expiratory volume in one second,FEV1) 测量。 主要使用德国耶格JAEGER TOENNIES 型肺功能检测仪,检测患者FEV1。
对比患者甲状腺旁腺素(parathyroid hormone,PTH)、骨钙素(osteocalcin,OC)、25-羟维生素D3(25 hydroxy microbial D3,25-OH-D3)水平。 主要使用全自用电化学发光分析仪e601。
1.3 统计方法
采用SPSS 23.0 统计学软件进行数据分析,计量资料采用(±s)表示,进行F 检验;计数资料采用[n (%)]表示,进行χ2检验。 P<0.05 为差异有统计学意义。
2 结果
2.1 3 组患者临床资料对比
慢阻肺正常患者、慢阻肺合并骨量减少、慢阻肺合并骨质疏松患者的腰椎骨密度、股骨颈骨密度、FEV1、吸烟指数、BMI、25-OH-D3 等指标比较,差异有统计学意义(P<0.05),见表1。
表1 3 组患者临床指标对比(±s)
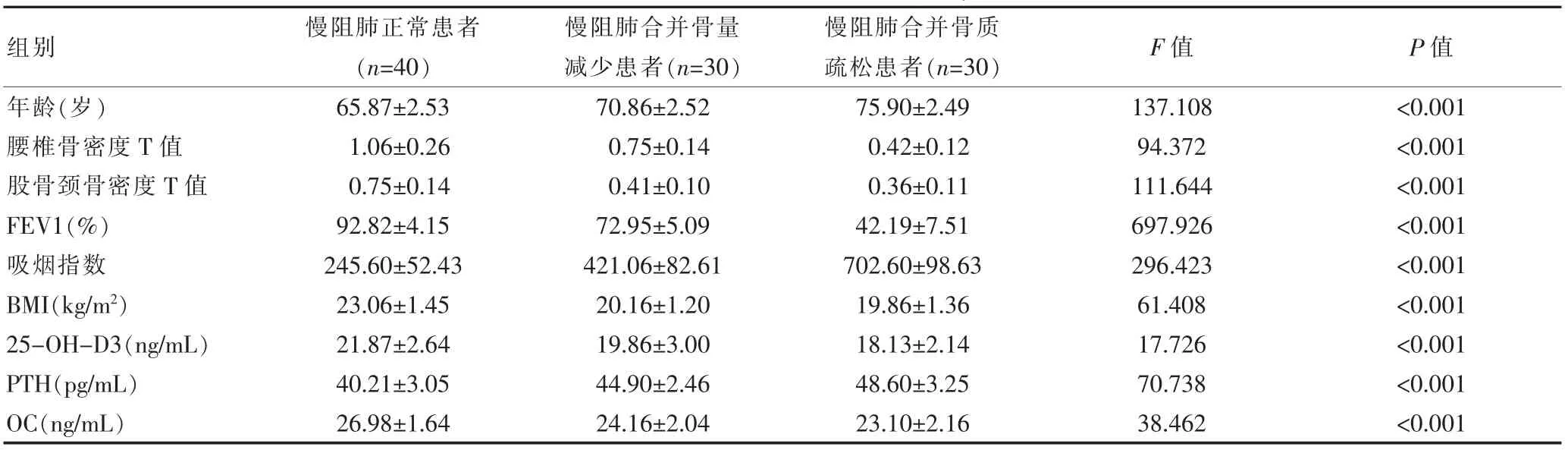
表1 3 组患者临床指标对比(±s)
组别年龄(岁)腰椎骨密度T 值股骨颈骨密度T 值FEV1(%)吸烟指数BMI(kg/m2)25-OH-D3(ng/mL)PTH(pg/mL)OC(ng/mL)慢阻肺正常患者(n=40)65.87±2.53 1.06±0.26 0.75±0.14 92.82±4.15 245.60±52.43 23.06±1.45 21.87±2.64 40.21±3.05 26.98±1.64慢阻肺合并骨量减少患者(n=30)慢阻肺合并骨质疏松患者(n=30)70.86±2.52 0.75±0.14 0.41±0.10 72.95±5.09 421.06±82.61 20.16±1.20 19.86±3.00 44.90±2.46 24.16±2.04 75.90±2.49 0.42±0.12 0.36±0.11 42.19±7.51 702.60±98.63 19.86±1.36 18.13±2.14 48.60±3.25 23.10±2.16 F 值 P 值137.108 94.372 111.644 697.926 296.423 61.408 17.726 70.738 38.462<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001
2.2 各影响因素相关性分析
老年COPD 并发骨质疏松及骨量减少的相关因素为年龄、吸烟指数、FEV1、体质指数、25-OH-D3,见表2。
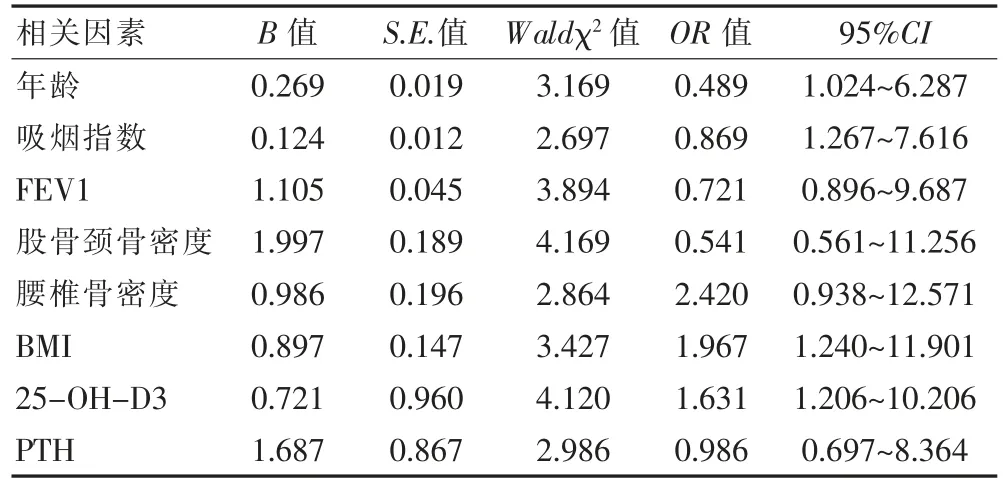
表2 影响因素分析
3 讨论
慢阻肺为老年患者常见疾病,男性患者为主要发病人群,患者常会合并骨质疏松,可直接影响患者正常生活。对于慢阻肺患者合并骨质疏松的原因进行分析时发现,慢阻肺患者由于长期呼吸道感染、肺泡壁破坏,血流比例失调,会影响胶原合成酶功能,降低骨钙含量[2]。 患者由于长期服用糖皮质激素药物进行治疗,可直接影响患者骨钙代谢水平,进而增加患者骨质疏松风险。也有研究认为患者长期缺氧会使胃肠道淤血,影响蛋白质、维生素物质吸收,与直接破坏骨细胞活性有关,但对于具体影响因素却并未得到广泛认知[3-4]。
为有效控制患者骨质疏松发生率,深入分析各种影响因素,提出有效控制措施便十分重要。 该次研究结果发现,慢阻肺合并骨质疏松患者腰椎骨密度T 值(0.42±0.12)、股骨颈骨密度T 值(0.36±0.11)均会降低,其主要原因为,随着患者年龄提升,骨代谢问题逐步加剧,同时也会随着患者疾病严重程度提升使得骨密度指标逐步恶化。 分析3 组患者年龄发现,合并骨质疏松患者平均年龄最大,主要原因在于,患者年龄越大,身体素质逐步降低,各种合并疾病严重程度逐步增高,使得骨流失和钙吸收问题加剧,因此可知年龄为独立影响因素。居旭等[5]研究显示,患者腰椎骨股骨颈位置骨密度T 值(0.41±0.14)变化相比于健康人员各指标水平更低,和该研究结果一致。
25-羟维生素D3(25-OH-D3)属于维生素D 活化最终产物,生物学作用在于有效提升小肠钙磷吸收,同时也可有效调节患者骨钙释放[5],但由于患者血清内25-OH-D3 水平降低,且半衰期较短,因此较难准确测定。该研究发现合并骨质疏松以及骨量减少的患者维生素D 水平持续降低[6-7]。 对患者维生素D 缺乏的原因进行分析时发现,随着患者肺部功能降低,活动耐力也会逐步减少,诱发维生素D 减少。 也有部分患者25-OH-D3 水平降低的原因为低氧血症,发病后会减弱1-α 羟化酶活性,进而使得体内25-OHD3 活性被抑制,直接影响患者胃肠道钙吸收能力,使患者骨量出现异常[8]。 有研究认为维生素D 不仅可影响患者骨代谢,也可影响肺部树突细胞和单核细胞生长,进而直接影响患者炎症反应、免疫功能[9-10]。
PTH 为甲状腺旁腺主细胞分泌的单联多肽类激素,可有效帮助患者调节自身钙磷代谢,也可有效促使患者血鳞水平降低[11]。 该研究结果显示,合并骨质疏松患者PTH 水平显著提升,对具体作用机制进行分析时发现: 慢阻肺患者维生素D 水平降低之后会使自身血钙水平降低,进而使甲状旁腺素水平升高,也可快速加快骨转换,加速患者骨丢失。 慢阻肺患者随着疾病严重程度升高,可长期存在高碳酸血症,患者肾小管排酸功能也会受到抑制,大量钙离子和镁离子会从尿内排出体外,持续加重血钙降低,使骨钙含量减少[12-14]。
有研究提出FEV1 降低和骨质疏松之间有重要关系,且为骨质疏松重要危险因素[15]。 该研究结果表示FEV1 属于慢阻肺患者骨量减少独立危险因素。 该研究中3 组患者FEV1 比较差异较大,说明随着患者炎症水平提升,炎症介质可直接破坏骨细胞刺激因子,也可影响肾脏基底膜及肾小管钙吸收,使钙磷代谢失衡,骨量丢失[16]。 因此在为慢阻肺患者进行疾病治疗时需选取有效方式帮助患者恢复呼吸功能,改善肺部指标。
吸烟指数和体质指数也是骨质疏松影响因素,随着患者自身体质指数降低,会使机体素质和免疫能力降低,直接影响患者胃肠道吸收,也会使患者钙吸收减少进而诱发疾病[17]。 由于烟草内含有较多尼古丁等有害物质,长期吸烟可直接抑制患者胃肠道钙吸收,同时也会抑制骨细胞活性,加速骨溶解作用,引发骨质疏松[18]。 为有效控制该因素,需重视患者饮食干预,帮助患者建立健康食谱,适当增加体质量,确保体质量处于健康水平,且必须要求患者禁止抽烟,可要求患者家属共同参与护理,在饮食护理和运动干预、戒烟过程中承担监督和辅助的作用[19]。
对于各种影响因素进行分析后发现,鼓励确诊患者多进行身体锻炼,适当改善肺部功能,每天摄入一定剂量的钙剂、维生素,必要情况下为其进行吸氧治疗,可有效帮助患者纠正缺氧问题。 对于吸烟患者叮嘱其尽早戒烟,多进行户外活动,可促进钙离子吸收。患者进行活动时必须保证有人陪同,且活动场所需进行防跌倒设施建设。 对于慢性病症突然加重患者,需适当为其采用糖皮质激素进行治疗,而病程较短患者不可长期用药。
综上所述,慢阻肺合并骨质疏松患者主要危险因素为年龄、吸烟指数、体质指数及25-OH-D、PTH 等指标,均可影响患者骨质流失。

