初始不可切除肝癌转化治疗后行肝切除术九例临床特征分析
韩福洲,钱红纲,胡越,赵炳善,曲军,王德仲
(1.航天中心医院 普外科,北京 100049;2.北京大学肿瘤医院 裕和肿瘤中心,北京 100039)
原发性肝癌是最常见的消化系统恶性肿瘤之一,2020年全球新发病例数超过90.6万人,死亡83.0万人,分别居恶性肿瘤新发病率和病死率的第6 位和第3位[1]。现阶段,肝癌患者获得长期生存最重要的手段为包括肝切除和肝移植在内的外科手术[2];但肝癌患者多在中晚期确诊,已失去手术机会。因此,将不可手术的中晚期肝癌通过降期治疗转化为可手术是提高肝癌治疗效果的重要手段,经过转化后行手术治疗的肝癌患者,其术后5年生存率可达50%~60%,与早期肝癌切除后的生存率相当[3]。既往研究多通过动脉栓塞化疗等局部治疗手段来控制病情进展或使肿瘤降期转化,但结果并不理想,近期靶向药物及免疫药物的发展使得初始不可切除肝癌的转化治疗有了新的选择[3-5]。本研究团队近期对9例初始不可切除的肝癌患者经免疫治疗联合靶向治疗成功转化后行肝切除术,效果较好,现报道如下。
1 资料和方法
1.1 一般资料
回顾性收集2019 年1 月至2021 年4 月间航天中心医院普外科及北京大学肿瘤医院裕和肿瘤中心收治的39例初始不可切除的肝癌患者。初始不可切除肝癌的标准:(1)巴塞罗那分期(BCLC)B期或C期,肝硬化者预计残肝体积<40%,无肝硬化者预计残肝体积<30%,肿瘤无肝外侵犯;(2)肝脏体积由增强CT等影像学检查评估。39例中,因疾病进展或不良反应停药者18例;疾病稳定、缓解共21例,符合手术指征者11例,成功行肝切除手术且切缘阴性者共9例,本研究因此对这9例患者临床特征进行分析。
9 例患者均为男性,中位年龄48(33~61)岁,均合并乙肝肝硬化,治疗前肝功能Child-Pugh A级4例,B级5例;BCLC分期B期4例,C期5例;PS评分均≤1分;治疗前行穿刺活检2例。
1.2 转化治疗方案
6例为帕博利珠单抗200 mg q3W联合仑伐替尼8 mg qd方案(方案1);1 例为卡瑞利珠单抗200 mg q3W联合仑伐替尼8 mg qd方案(方案2);1例为卡瑞利珠单抗200 mg q3W联合阿帕替尼250 mg qd方案(方案3);1例为信迪利单抗单抗200 mg q3W联合仑伐替尼8 mg qd方案(方案4);治疗周期数均以PD-1应用次数记,3周为1个周期;病例9于术前1月行肝左叶病灶介入治疗(TACE)。具体见表1。
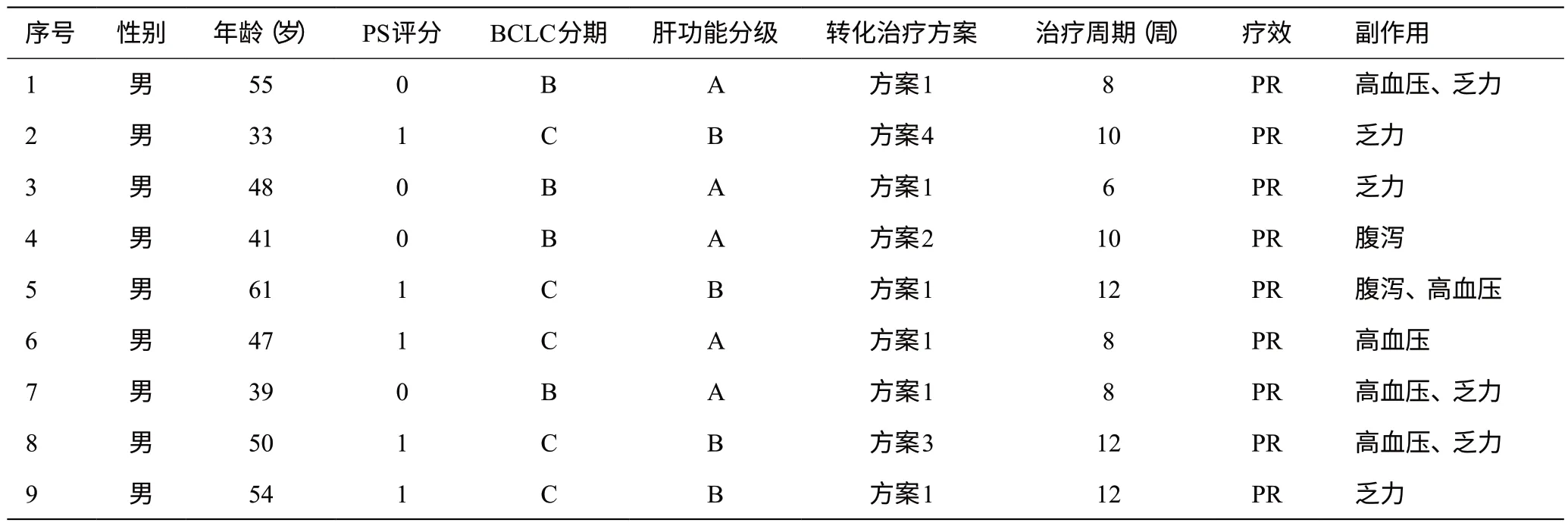
表1 9例初始不可切除肝癌患者基本资料及转化治疗方案
1.3 转化治疗效果评价
治疗前均行腹部增强CT检查及AFP等肿瘤标志物以作为基线;每6周复查,依据实体肿瘤免疫疗效评价标准(iRECIST)评效。
1.4 肝切除术
取上腹部正中或右侧肋缘下反L切口进腹,切除胆囊后解剖肝门板,游离并整束阻断肿瘤所在肝叶的Glisson蒂,解剖第二肝门,阻断回流相应肝段的肝静脉(根据需要决定是否结扎切断),沿着缺血区域的标记线断肝。
2 结果
2.1 转化治疗情况
2.2 肝切除术情况
全部9例患者转化成功后开腹行规则肝切除术,术前均停药4 周,并行肝脏三维重建协助手术方案制定;术后病理提示均为R0切除,病理学完全缓解(pCR)1 例。具体手术范围为:左半肝切除术5 例;右半肝切除术3例,左半肝联合尾状叶切除术1例;1例患者因术后腹腔出血行再次手术,余患者无明显手术相关并发症发生;术后住院时间(12.9±2.1)d。附病例9 诊治过程中影像学变化(图1)及术中操作(图2)、大体标本(图3)。

图1 转化治疗过程中影像学改变:箭头处为肿瘤,三角处为新发病灶

图2 右半肝切除术中图片:箭头所指处为肿瘤

图3 手术切除标本:箭头处为肿瘤
术前治疗周期数为(9.6±2.2)周期,治疗过程中5 例患者出现高血压,予以降压药物对症治疗后血压均控制良好;乏力6例,腹泻2例;均为2级或以下不良反应,对症处理后好转,无中断用药病例;出现假性进展1例。
2.3 随访情况
9例患者均建议术后2年内每3个月复查腹部增强CT及AFP等肿瘤标志物。9例患者均随访至2021年4月,术后中位随访时间10.1个月;术后复发2例,余7 例患者生存状态良好,随访期间无死亡病例出现。见表2。
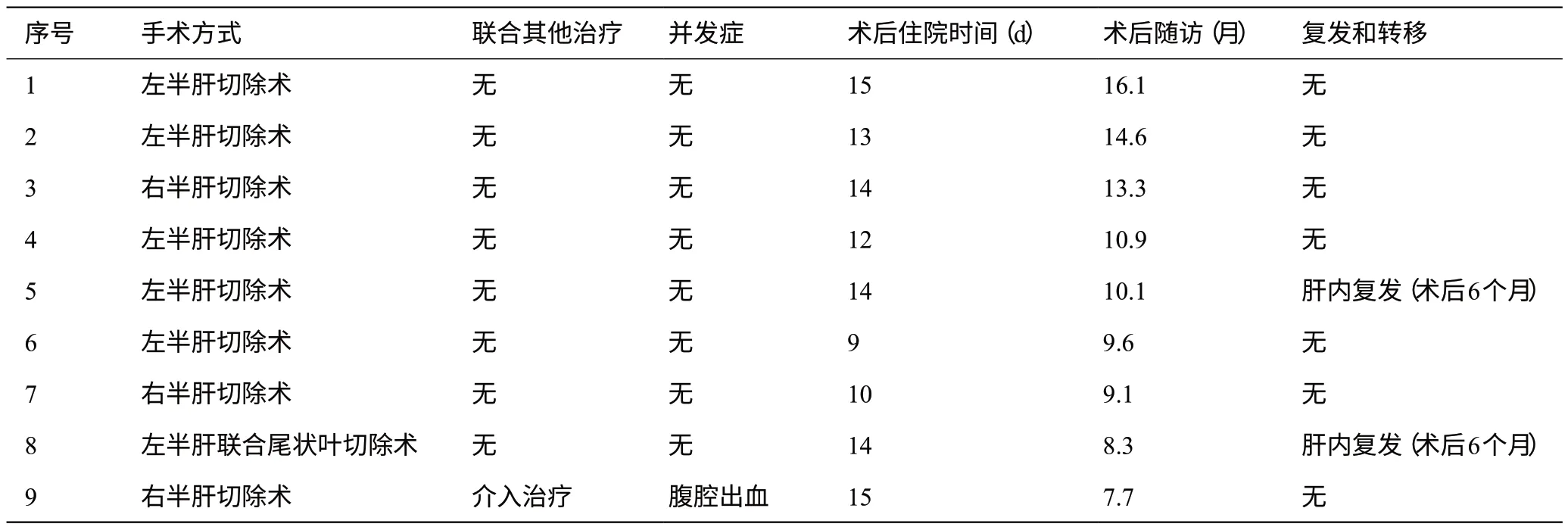
表2 9例患者转化治疗后肝切除术治疗和随访情况
3 讨论
外科手术治疗仍是目前肝癌患者获得长期生存的最重要治疗手段,但初始可切除肝癌患者占比仅为20%~30%[2];不可切除肝癌的降期转化为可手术可改善肝癌患者预后。既往针对晚期肿瘤本身的治疗手段主要为经肝动脉栓塞(TAE)、经肝动脉栓塞化疗(TACE)、经肝动脉栓塞放疗(TARE)、经肝动脉灌注化疗(HAIC)、立体定向放射治疗(SBRT)、局部同步放化疗(CCRT)等局部治疗;对于残肝体积不足的潜在可切除病例可选择术前门静脉栓塞(PVE)或行联合肝实质离断和门静脉结扎的二步肝切除(ALPPS)术[3]。TACE和TARE等介入治疗是降期治疗常用手段,约有9.8%~12.0%的患者可成功降期[6],但患者对TACE的治疗反应随介入次数增加而下降,且多次TACE可能导致肝损害,影响转化后的手术安全性。而TARE是将90Y微球经肝动脉置入肿瘤内部,阻断肿瘤血供的同时发挥放疗作用,目前已有研究证实该疗法确切有效,但在转化治疗中的应用尚未获得足够数据支持[3]。近年来,HAIC在中晚期肝癌中的应用取得了较多进展,有多项临床研究证实HAIC效果优于TACE及索拉非尼,当HAIC联合放疗时可使患者获得更高的转化率[7]。针对残余肝体积不足,目前采用的较多手段为PVE,但剩余肝体积增长较慢,治疗过程中存在肿瘤进展导致治疗失败的风险,有研究报道PVE联合TACE等治疗可控制等待期间肿瘤进展发生率[8],ALPPS手术可在短时间内增加剩余肝体积,减少等待过程中的肿瘤进展风险,但其围手术期的并发症较高[3]。
相较上述治疗方法,靶向及免疫治疗无创、用药简单、严重不良反应发生率低,客观反应率高[5]。靶向治疗方面,仑伐替尼在Kudo等[9]研究中的中位生存时间(mOS)及所有的次要终点均显著优于索拉非尼组;阿帕替尼可显著延长一线耐药的晚期HCC患者的OS时间和无进展生存(PFS)时间,患者耐受性好,安全可控[10];多纳非尼对比索拉非尼的ZGDH3 研究也报道了阳性结果[11];但单药靶向治疗仍需经进一步研究来筛选靶向药物的优势人群[12]。免疫方面,纳武利尤单抗(O药)在2017 年被美国批准用于索拉非尼耐药进展期肝癌的二线治疗。CheckMate040 研究显示:O药的一线客观缓解率(ORR)约为20%~23%,二线治疗ORR为16%~19%;一线初治患者mOS达28.6 个月,二线患者mOS分别达到了15.6 个月(扩展组)和15 个月(递增组)[13];帕博利珠单抗(K药)二线II期临床研究KEYNOTE224试验也获得了阳性结果[14];但由于试验设计问题,O药及K药治疗晚期肝癌的III期临床试验均未达到预期[15-16]。相较于免疫及靶向单药治疗的不尽人意,多项有关免疫联合靶向治疗晚期肝癌的临床研究获得阳性结果。IMbrave150 研究显示:阿替利株单抗联合贝伐珠单抗组患者的PFS、ORR等均显著优于索拉非尼[17]。KEYNOTE-524 研究结果显示:仑伐替尼联合K药联合组的ORR高达46%;mOS达22个月,mPFS达9.3个月[18]。信迪利单抗联合贝伐珠单抗类似物的ORIENT-32的研究结果显示中,联合组mOS时间显著延长、ORR显著升高[19]。除上述组合外,阿帕替尼联合卡瑞利珠单抗、仑伐替尼联合CS1003、信迪利单抗联合安罗替尼等组合也获得了较好的有效性和安全性[20]。
本研究中9 例患者分期为巴塞罗那B期或C期,治疗前不可手术,经转化治疗术后病理显示切缘均为阴性,其中pCR一例,提示靶向联合免疫治疗确切有效;共有4种药物组合方案入组,提示有效的免疫及靶向药物组合可有多种。转化治疗需(9.6±2.2)周期,用时较长且个体间差异较大,可能与药物的选择、肿瘤负荷及手术时机的选择等因素有关。成功转化病例占所有初始不可手术病例的比例约为23.1%,低于国内张雯雯等[21]报道的30.3%,考虑为采用不同肿瘤分期系统及评效标准所致。治疗过程中9 例均出现不良反应发生,其中5 例高血压,6 例乏力,2 例腹泻;4 例出现两种不良反应,均为1、2级不良反应,未观察到3级及以上不良反应,无不良反应导致停药病例,提示可耐受的不良反应与患者获得足够的治疗周期数相关,进而提高患者转化成功的几率。9例患者术后住院时间为(12.9±2.1)d;1例患者围手术期因腹腔出血行非计划再次手术,考虑为术后拔管过程中患者反应剧烈及首次手术时创面止血不彻底有关,与术前治疗并无明显因果关系;余8 例患者并无明显围手术期并发症发生,提示转化成功后行手术治疗是安全的。病例9 治疗两周期后复查发现病灶增大,肝左叶出现新发病灶,结合患者肝区疼痛等症状明显缓解及AFP明显下降,考虑为假性进展,继续原方案治疗后病灶明显缩小;AFP逐渐降至正常;为达根治效果,术前对肝左叶新发病灶进行介入治疗,术前影像学检查及三维重建未提示肝左叶占位性病变,术中彩超也未提示肝左叶恶性占位,遂未行肝左叶病灶切除,该病例术后随访7个月余,未发现复发或转移征象,印证了该病例为R0 切除;该病例术后病理为pCR,假进展与pCR之间的相关性尚需进一步证据支持。所有转化成功患者均为男性,考虑与男性在肝癌病例中占比较高及此样本量较小有关。2例患者于术后第二次复查时发现肝内复发,可能与肿瘤细胞的异质性所致残肝内影像学未发现的微小肿瘤病灶残留有关。此2例患者治疗前均为巴塞罗那C期、肝功能B级、均经历12 周期治疗,治疗过程中均出现了1 种以上不良反应,这些临床特征是否与术后早期复发直接相关尚需更多证据支持。余7例患者生存状况良好,未观察到复发及转移;也尚未观察到死亡病例出现,可能与样本量小、随访时间过短有关。本研究结果提示:对于初始不可切除肝癌,免疫联合靶向治疗可使部分肿瘤成功降期,让患者获得手术机会,且不增加手术相关风险。
现阶段中晚期肝癌的免疫联合靶向治疗仍有较多问题如肿瘤分期和评效标准的选择、手术时机、术后是否继续治疗及治疗周期等尚无定论,但该治疗方式在中晚期肝癌中的有效性和安全性已经得到了认可;相信可通过进一步的研究可筛选出获益人群,精准施策,从而使更多患者获益。

