重视可切除胰腺癌的新辅助治疗
徐有耀,陈益臻,张宇华,吴嘉,韩方
(中国科学院大学附属肿瘤医院/浙江省肿瘤医院 肝胆胰外科,浙江 杭州 310022)
胰腺癌高度恶性,在我国发病率居所有恶性肿瘤第10位,病死率居第6位[1]。仅有20%的患者在确诊时属于可切除胰腺癌(resectable pancreatic cancer,RPC),早期行手术切除后联合辅助化疗是治疗胰腺癌的既定方法,然而术后5 年生存率仍低于20%[2]。近年来RPC的临床治疗模式逐渐从单纯依靠手术转向多学科综合治疗协作组(multi-disciplinary term,MDT)模式。新辅助治疗最初用于降低肿瘤大小,现在更多地用于控制潜在的微转移。虽然新辅助治疗最先应用于局部进展期胰腺癌(local advanced pancreatic cancer,LAPC),但从美国国家综合癌症网络(NCCN)历年发布的指南中可以看到,在各类型胰腺癌的推荐治疗中,新辅助治疗正逐渐前移,这无疑凸显了新辅助治疗在非转移性胰腺癌治疗中的重要性[3]。然而,到目前为止,新辅助治疗对于RPC患者的应用也仅限于临床试验,其能否给患者带来获益,目前仍然存在很大争议。因此,本文对RPC新辅助治疗的现状进行评述,以期进一步提升RPC综合诊治水平。
1 胰腺癌可切除性评价
目前对于胰腺癌可切除性的评价,主要基于NCCN指南,美国肝胆胰腺协会/外科肿瘤协会/消化道外科协会(AHPBA/SSO/SSAT)和胰腺癌综合诊治指南。表1列出了上述机构对于RPC的定义,从中可以看出,胰腺癌可切除性的评价标准主要基于术前形态学即影像学检查表现,是否合并有肿瘤周围血管侵犯、侵犯血管是否可以重建以及是否合并有远处转移。近年来,通过对肿瘤学的不断探索,胰腺外科医师认识到生物学因素对胰腺癌的治疗策略存在重要影响。国际胰腺病协会(IAP)将生物学参数纳入可切除评价标准,这其中包括:CA199 是否大于500 U/mL,临床结果疑似(但未证实)远处转移,通过活检或PET-CT诊断的局部淋巴结转移[4]。与此同时,美国东部肿瘤协作组(ECOG)将体能状态评分也纳入了可切除评价标准,该评分可反映患者的一般状况。以上评价指南的更新表明胰腺癌的治疗理念已从形态学根治转向生物学获益,这也凸显了新辅助治疗在RPC患者综合治疗中潜在的作用。
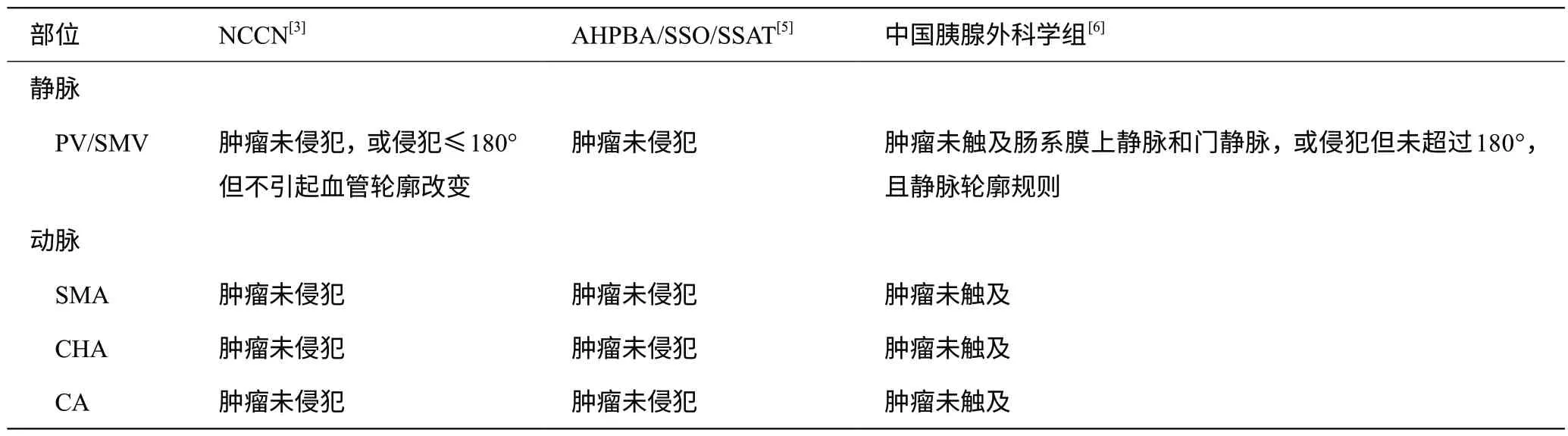
表1 不同机构对可切除胰腺癌的定义
2 胰腺癌新辅助治疗提出的理论依据及主要争议
胰腺癌属于高度侵袭性恶性肿瘤,手术切除被认为是具有潜在治愈机会的唯一治疗方法。然而在首诊时仅有极少数患者存在外科手术机会,而且术后的高局部复发率和远处转移率导致5 年生存率仍较低。因此,越来越多的胰腺外科医师认为胰腺癌是一种全身系统性疾病。NCCN指南较早就已明确提出对LAPC和可能切除胰腺癌(borderline resectable pancreatic cancer,BRPC)患者应优先进行新辅助治疗,而从2018年开始也提出对于有高危因素(高水平CA199、巨大肿瘤、区域淋巴结肿大、体重显著减轻和剧烈疼痛)的RPC患者推荐新辅助治疗。
关于RPC患者能否从新辅助治疗中获益,目前仍存在较大争议。新辅助治疗的主要优势[7-8]在于:(1)消除胰腺癌的微转移灶,减少复发转移,延长生存期;(2)筛选出预后较差的患者,减少不必要的手术创伤;(3)因为新辅助治疗在治疗过程中保存了原有的解剖学和血管系统状态,且剂量强度也更高,所以认为新辅助治疗可能比术后辅助治疗更有效。而新辅助治疗的主要争议[9-10]在于:(1)患者在新辅助治疗期间存在肿瘤进展的可能,从而使原本可以达到R0切除的患者失去根治性切除的机会。然而,理论上在2~3个月的新辅助化疗下,肿瘤迅速进展的患者不太可能通过前期手术治愈。因为在许多情况下,并不是由于原发肿瘤的进展,而是因为发生了远处转移。(2)RPC患者的手术可以在没有事先组织病理学证实的情况下进行,但新辅助治疗的应用必须首先进行穿刺活检等有创操作,操作难度大且风险较高。
3 新辅助治疗方案的选择及应用
在BRPC和LAPC中使用新辅助治疗取得了令人鼓舞的结果之后,胰腺外科医师对新辅助治疗用于RPC的兴趣也与日俱增。RPC的新辅助治疗方案可参考BRPC和LAPC,目前大多数指南推荐的化疗药物主要分为三种:(1)FOLFIRINOX或mFOLFIRINOX方案;(2)吉西他滨联合白蛋白紫杉醇方案;(3)吉西他滨联合替吉奥方案。
2017 年美国国家癌症数据库按照1:3 匹配了2 005例接受新辅助治疗和6 015例优先手术的RPC患者并对其进行比较,结果发现新辅助治疗能够降低手术切缘阳性率(17%vs24%,P<0.01),提高总体生存时间(26个月vs21个月,P<0.01)[11]。2019年一项Meta分析纳入了11篇文献9 386例RPC患者,其中2 508 例接受了新辅助治疗,与直接手术相比,新辅助治疗组R0 切除率增加,阳性淋巴结转移率降低,但总体生存时间并没有显著增加(HR=0.91,95%CI0.79~1.05)[12]。笔者认为,RPC的新辅助治疗仍处于实验阶段,部分原因可能是早期的研究以回顾性研究居多并且时间跨度大,存在选择偏倚,证据等级不高。因此迫切需要前瞻性随机对照试验的数据支持(表2):在德国的第一个II期临床试验中,Golcher等[13]计划将254例RPC患者随机分成直接手术组和以吉西他滨为主要治疗方案的新辅助治疗组,但这项研究在6年内入组至73例患者时即提前终止,因为两组R0切除率(48%vs52%,P=0.81)和总体生存时间(14.4个月vs17.4个月,P=0.96)均无统计学差异。意大利的Casadei等[14]也得出了类似的结论。但最新的多个临床研究在一定程度上肯定了新辅助治疗的生存获益且安全可行。2018年意大利的Reni等[15]将88例RPC患者随机分为3组:(1)先行PEXG新辅助治疗(顺铂30 mg/m2,表阿霉素30 mg/m2,吉西他滨800 mg/m2,口服卡培他滨1 250 mg/m2),手术切除联合PEXG辅助化疗;(2)直接手术切除联合PEXG辅助化疗;(3)直接手术切除联合吉西他滨辅助化疗。结果表明,接受新辅助治疗的RPC患者总体生存时间为38.2个月,远高于后两组的20.4个月与26.2个月。一项来自日本的II/III期随机对照试验[16-17]纳入了364例RPC患者,随机分为新辅助治疗组(吉西他滨联合替吉奥)和直接手术组,主要终点是II期患者的切除率和III期患者的总存活率。II期试验结果表明新辅助治疗组切除率为93%,而直接手术组的切除率为82%。III期临床试验结果表明新辅助治疗组的总体生存时间明显优于直接手术组(36.7个月vs26.6个月,P=0.015)。此外,新辅助治疗组提高了2年总体生存率,分别为63.7%和52.5%。
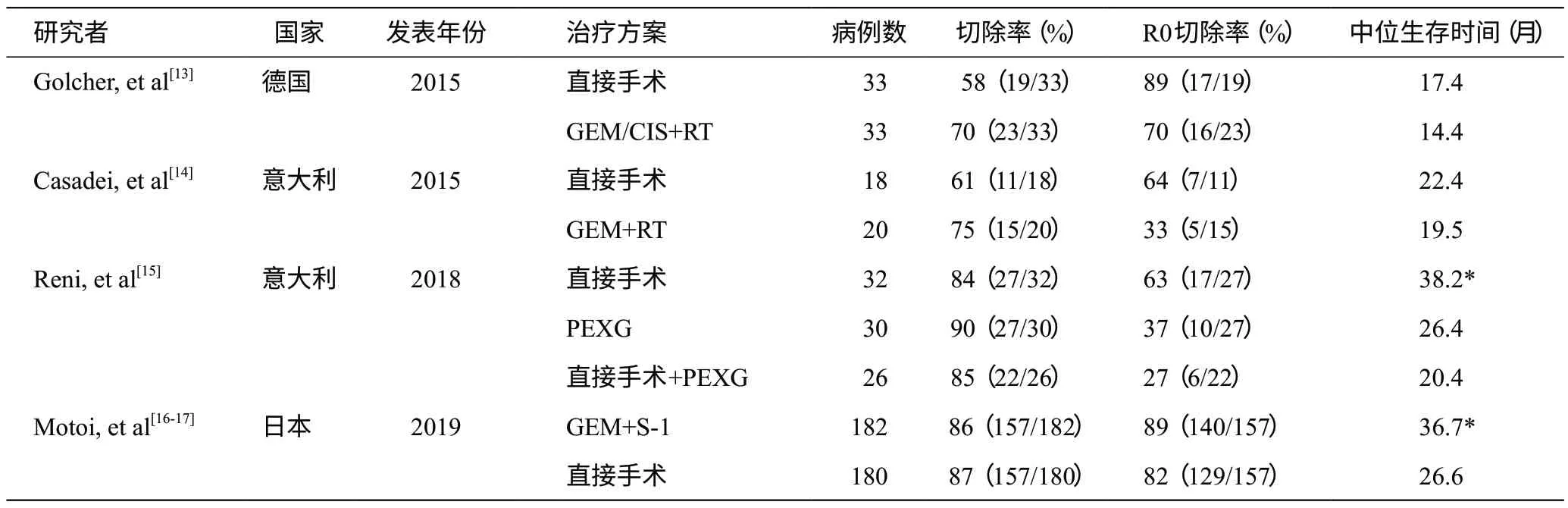
表2 可切除胰腺癌新辅助治疗与直接手术治疗的随机对照试验
以上研究结果表明新辅助治疗对于RPC患者能否获益仍有争议。笔者认为各研究结果存在差异的原因在于:(1)不同中心对于胰腺癌可切除性的评价存在差异,势必造成入组标准不统一,存在较大的异质性;(2)治疗方案差异导致可比性不强。早期试验以吉西他滨单药为主,其治疗效果明显弱于多药联合方案。最新指南虽未推荐所有RPC患者行新辅助治疗,但笔者认为随着正在进行的多项前瞻性随机对照实验结果的展露,RPC患者同样可以从新辅助治疗中获益。
4 新辅助治疗的策略及手术时机
最新NCCN推荐具有高危因素的RPC患者优先进行新辅助治疗,但这些临床相关特征在实际临床工作中均无明确的量化标准。笔者所在的中心推荐新辅助治疗的临床标准是:(1)原发肿瘤最大径>3 cm;(2)CA199>1 000 U/mL;(3)胰腺周围淋巴结受累或影像学特征不明确提示有更晚期疾病;(4)6个月内体重下降>10%;(5)疼痛数字评分法NRS>6分。
新辅助治疗过程中及结束后需及时对患者进行疗效评估,重新确定肿瘤的分期,以及时地调整治疗方案或进入下一阶段治疗。临床上以影像学检查的实体瘤疗效评价标准(RECIST)应用较为常见,然而有文献表明CT对于接受新辅助治疗胰腺癌患者的评估能力大大下降[18]。因为胰腺癌富含大量胶原等纤维间质,新辅助治疗在短时间内很难使肿瘤缩小,而且可能出现炎症反应和严重的纤维化,在影像学上表现为肿瘤进展[19]。如前所述,胰腺癌的治疗理念已从形态学根治转向生物学获益。笔者所在中心认为对于新辅助治疗后的再评估应从以下三个方面进行评估:(1)肿瘤形态学,即腹部增强CT、MRI灌注成像、PET-CT和超声内镜(EUS)的联合使用。有文献指出,在BRPC和LAPC应用新辅助治疗后,PET-CT上肿瘤最大标准摄取值(SUVmax)降低和EUS上的肿瘤回声强度降低可能是新辅助治疗起效和可切除性的潜在标志[20]。(2)肿瘤生物学,即CA199、CA125与CEA。CA199在新辅助治疗前后的改变也可以预测组织病理学反应和生存获益,CA199 中度下降和显著下降的患者4 年生存率分别为34.1%和58.9%[21]。最新研究表明,CA125与CEA对胰腺癌的可切除性的预测具有重要价值[22]。因此,所有胰腺癌患者应该对CA125与CEA进行常规检测,特别是Lewis阴性患者。(3)患者的全身状况及营养情况。当满足以上3个条件后即可进入下一步治疗。毫无疑问,根治性手术是治愈胰腺癌的唯一途径。然而关于手术时机和手术方式的选择目前尚无统一的标准。临床实践中对于新辅助治疗的具体疗程大多依据疗效及患者的身体状况决定,一般在2~8疗程[23-24]。结合笔者中心多年来对新辅助治疗的经验,建议在2~4个月内完成新辅助治疗4~8个疗程。随后一般在完成新辅助治疗4~6周进行手术治疗。对于手术方式,一般选择开放或腹腔镜行直接手术切除。如前所述,新辅助治疗会使肿瘤周围组织出现炎症反应和严重的纤维化,这势必增加了手术的难度。然而一项意大利的研究比较了新辅助治疗组和直接手术组在术后并发症的差异,结果表明新辅助治疗组胰瘘发生率和术后出血的发生率均低于直接手术组(9.1%vs15.6%,9.1%vs14.6%)[25],说明新辅助治疗虽然给胰腺外科医师增加了手术难度,但并不会增加手术风险,反而可以降低术后并发症。
5 新辅助治疗的热点问题和展望
外科手术治疗RPC已有100 多年的历史,高容量胰腺医疗中心治疗的推广和动脉优先入路的普及,在提高了R0切除率的同时也降低了并发症的发生率及围手术期病死率。但通过提高手术技术改善RPC预后的空间相对有限。所以RPC的临床研究方向逐渐从提高手术技术转向新辅助治疗,临床治疗模式逐渐从手术优先转向MDT。然而,新辅助治疗仍然存在许多问题。
放疗作为胰腺癌治疗的常用方法之一,可以有效地控制局部肿瘤,但放疗是否存在生存改善作用还存在争议。Cloyd等[26]回顾性纳入1999 年至2014 年间258 例RPC患者,依据倾向性评分调整后分为31 例术前化疗组和227 例术前放化疗组(chemoradiotherapy,CRT),结果发现放化疗组R0切除率更高(91%vs79%,P<0.01),淋巴结阳性率和术后局部复发比例更低,但总体生存时间并无差异。Versteijne等[27]2020 年报道,与直接手术相比,119例接受术前联合放化疗的RPC/BRPC患者所在组别的R0切除率更高(71%vs40%,P<0.01),提高了总体生存时间(35.2个月vs19.8个月,P=0.029),并且显著降低了患者的阳性淋巴结、神经周围浸润和静脉浸润的发生率。然而,随着放疗进入了精准时代,大分割、立体定向放射治疗(SBRT)和强调适形放疗(IMRT)也常规应用于胰腺癌领域,我们相信放疗也许会取得令人惊喜的效果。建立健全新辅助疗效的评价体系。近年来循环肿瘤细胞及其基因(ctDNA)检测已用于临床,该方法可在CA199正常的胰腺癌患者中评估早期诊断、疾病复发转移及预后等[28-29]。而且对于KRAS突变的胰腺癌患者,ctDNA也被认为是接受化疗胰腺癌患者早期反应预测和治疗监测的有力且高度特异性的工具[30]。在临床实践中,动态监测ctDNA可与CA199 优势互补,对评价新辅助疗效和实现精准治疗提供强有力的参考。
近年来,免疫治疗被越来越多地应用于实体肿瘤,通过细胞毒性T淋巴细胞相关抗原4(CTLA-4)、程序性细胞死亡蛋白1(PD-1)和程序性细胞死亡配体1(PD-L1)来提高肿瘤的免疫杀伤作用。但胰腺癌被认为是“冷”肿瘤,多数I期和II期临床研究都以失败告终,未展示出对胰腺癌的临床疗效[31-32]。美国的一项II期临床研究应用Ipilimumab单药治疗27 例局部晚期或转移性胰腺癌患者,结果显示:缓解率为0,总体生存时间仅为4.5 个月,并且毒副作用严重[33]。然而,免疫治疗与放疗和/或化疗的联合治疗展示出了令人鼓舞的研究结果[34]。一项Ib/II期研究评估了Pembrolizumab联合吉西他滨和白蛋白紫杉醇治疗晚期或转移性胰腺癌的疗效和安全性,入组12 例患者,结果显示25%的患者达到部分缓解(PR),67%的患者疾病稳定(SD);无进展生存期(PFS)和总体生存时间分别为9.1 个月和15.0 个月,展示出了可期的疗效[31]。然而,目前仍缺乏高质量的随机对照试验,已报道的临床试验结果尚不支持新辅助免疫治疗。但在免疫治疗飞速发展的背景下,国际上已有3 项新辅助免疫治疗临床试验正在进行(NCT02305186,NCT02930902,NCT03153410),新辅助免疫治疗有待于进一步的探索和验证,我们相信免疫治疗能给胰腺癌的治疗带来新的希望。
近期,笔者团队对1 例胰体部恶性肿瘤行新辅助治疗。患者男性,64 岁,主诉“发现胰尾占位1周”于2020年11月入我院。增强CT检查提示:胰体尾恶性肿瘤伴肝脏血管瘤,胸部CT检查无异常发现,PET-CT检查提示胰体尾部结节伴高代谢,考虑胰腺癌可能性大。实验室检查CA199为676.03 U/mL,行内镜超声+细针穿刺(EUS+FNA)检查证实为胰腺癌,依据NCCN指南术前可切除性评估属于RPC。经我院MDT讨论后决定先后经过新辅助治疗、手术切除及术后辅助治疗。随后对患者进行了三个周期AG联合Atezolizumab的新辅助治疗。疗效评估:(1)肿瘤形态学:基于实体瘤免疫治疗疗效评价标准(iRECIST)评估,患者肿瘤原发灶对新辅助治疗方案存在一定的反应性,已达到部分缓解(iPR);(2)肿瘤生物学评估:CA199显著下降(676.03 U/mLvs91.68 U/mL),CEA和CA125 下降(35.8 U/mLvs34.8 U/mL,9.48 U/mLvs4.13 U/mL);(3)患者全身状况及营养情况正常。新辅助治疗后于2021年3月行动脉优先胰体尾切除术,术后病理学检查结果:胰体尾中分化导管腺癌(瘤体5.0 cm×3.0 cm×2.5 cm),可见脉管瘤栓及神经侵犯,累犯胰腺被膜纤维脂肪组织,转移或浸润至(胰腺周)3/8、(8组)1/1、(10组)1/4淋巴结。术后恢复顺利,术后2周出院。术后继续行原方案AG联合Atezolizumab的新辅助治疗,定期复查CA199、CEA、CA125,增强CT及PET-CT未见明显异常,复查期间定期随访,目前随访时间4个月,肿瘤无复发、无转移征象。
综上所述,胰腺癌新辅助治疗已开始被一部分胰腺外科医师所接受,这势必将为RPC的综合治疗提供新的方向。胰腺癌治疗理念与目标应该从“可切除的形态学根治”转向“可治愈的生物学获益”,临床治疗模式应该从“手术优先”转向“MDT模式”。根治性手术正面临着前所未有的挑战,胰腺外科医师应顺应时代的潮流,积极拥抱新辅助治疗。

