连草泻痢胶囊对溃疡性结肠炎小鼠模型肠黏膜炎症因子及TLR4/PI3K/Akt/mTOR 信号通路的影响
战晶玉,袁星星,王炳予,刘长发,张雅丽
(黑龙江省中医药科学院南岗分院,黑龙江哈尔滨 150036)
溃疡性结肠炎(ulcerative colitis,UC)是一种以直结肠黏膜及黏膜下层弥漫性、连续性炎症改变为主要特征的非特异性的炎症性肠病[1]。近几十年来,随着工业化和城市化进程,UC 的发病率呈现逐年增加的趋势[2]。作为炎症性肠病的常见类型之一,UC 好发于乙状结肠及直肠部位,通常以腹泻、腹痛和黏液脓血便为主要临床表现,并呈现发作-缓解反复交替的特征[3]。不仅如此,UC 患者总体癌变率为3.7%,约占UC 死亡原因的15%,从UC-肠癌的发病呈现“炎症—不典型增生—癌变”的模式[4]。因此有效抑制肠道黏膜炎症是治疗UC 和预防结直肠癌的重要途径。
连草泻痢胶囊是张雅丽教授治疗UC 的经验方,具有清热解毒、渗湿排脓、行气止痛的功效。前期的研究结果表明,连草泻痢胶囊能够显著改善肠道黏膜屏障功能和降低炎症因子IL-17 和TNF-α 的水平,对于大肠湿热证UC 具有较好的临床疗效[5]。因此,本研究通过观察连草泻痢胶囊对UC 小鼠模型肠道黏膜炎症因子及toll 样受体4/磷脂酰肌醇激酶/蛋白激酶B/雷帕霉素的哺乳动物靶标(TLR4/PI3K/Akt/mTOR)TLR4/PI3K/Akt/mTOR 信号通路的影响,以期进一步明确其治疗UC 的分子机制。
1 材料与方法
1.1 实验动物
清洁级C57BL/6N 小鼠(雄性,8~10 周龄),体质量约20~26 g,购于北京Charles River 公司(实验动物生产许可证:SCXK(京)2016-0011)。实验动物饲养条件:温度:21~24℃,湿度:44%~55%,自由饮水及摄食,同时给予循环光照。本实验严格按照《关于善待实验动物的指导性意见》中相关标准执行[6]。
1.2 药物与试剂
连草泻痢胶囊(0.5 g/粒,黑药制字:Z20180005)购于黑龙江省中医药科学院南岗分院成药局;美沙拉嗪肠溶片(美莎欣,800 mg/片,国药准字:H20103359)购于黑龙江天宏药业有限公司;葡聚糖硫酸钠(dextran sulfate sodium,DSS)购于MP Biomedicals 公司;TLR4、PI3K、Akt、p-Akt(Thr308)、mTOR、p-mTOR(Ser2448)及β-actin 兔单抗购于美国Cell Signaling Technology 公司;山羊抗兔IgG 二抗购于美国Abcam 公司;Western Blot ECL 化学发光液购于美国Millipore 公司;小鼠肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-1β(IL-1β)、白介素-8(IL-8)、白介素-17(IL-17)和γ-干扰素(INF-γ)酶联免疫检测试剂盒(ELISA)购于江苏酶免实业有限公司。苏木素伊红(HE)染色试剂盒购于北京Solarbio 公司。
1.3 方法
1.3.1 药物制备 造模开始前取3 g DSS 溶于蒸馏水100 mL 中配置成终浓度为3%的DSS 溶液;同时分别取适量连草泻痢胶囊和粉碎后的美沙拉嗪肠溶片溶于蒸馏水500 mL 配置成16.1 g/L 和15.6 g/L 的混悬液。
1.3.2 分组与动物造模 小鼠按照体质量随机分为空白组、模型组、连草泻痢组和美沙拉嗪组,每组10 只。适应性饲养1 周后参照文献中方法进行造模[7]:除空白组外,余下3 组小鼠给予3%DSS 溶液自由饮用,空白组小鼠予以自由饮水,每日记录各小鼠饮水量并补充新鲜DSS 溶液,连续7 d。造模期间,各组给予相应的药物治疗(参照人和动物药物等效剂量进行换算),其中连草泻痢组给予0.77 g/kg 连草泻痢水溶液灌胃,美沙拉嗪组给予0.68 g/kg 美沙拉嗪混悬液进行灌胃,而空白组和模型组小鼠则给予等体积的生理盐水进行灌胃,每日1 次,每次1 mL,连续7 d。各组小鼠末次给药后24 h,以1%戊巴比妥钠40 mg/kg 腹腔注射麻醉后眼球取血,采血后以1%戊巴比妥钠800 mg/kg 腹腔注射处死小鼠后分离结肠组织,并测定各组小鼠结肠长度。随后取1 cm 中段结肠组织以磷酸盐缓冲盐溶液冲洗干净后置于4%多聚甲醛中的固定,余下组织置于-80℃保存。
1.3.3 结肠组织病理学观察 取固定于4%多聚甲醛中的结肠组织,梯度乙醇脱水后置于二甲苯中进行透明处理,石蜡包埋后以中性树脂进行封片,置于切片机上进行切片,切片厚度设定为4 μm。参照HE 染色试剂盒说明书进行染色,光学显微镜下观察结肠组织病理形态的改变,并参照文献中评分标准进行组织病理学评分[8]。
1.3.4 EILSA 检测 取适量结肠组织并加入预冷的磷酸盐缓冲盐溶液中冲洗,玻璃匀浆器于冰浴中充分匀浆。于4 ℃环境下3 500 r/min 离心10 min,取上清。此外,取眼球血,静置后4 ℃环境下3 500 r/min 离心10 min,取上清。参照ELISA 试剂盒说明书测定组织及血清中TNF-α、IL-6、IL-1β、IL-8、IL-17、INF-γ 的含量。
1.3.5 Western blot 检测 取适量结肠组织剪碎,加裂解液冰上裂解,离心取上清,以BCA 法测定总蛋白浓度;加入15 μL 蛋白样品进行电泳,转膜至PVDF 膜,5%脱脂牛奶封闭2 h;分别加入稀释后的TLR4、PI3K、Akt、p-Akt(Thr308) 、mTOR、p-mTOR(Ser2448)及β-actin 兔单抗(1∶1 000),4 ℃条件孵育过夜;TBST 缓冲液洗膜5 次,加入适量稀释后的山羊抗兔后室温下继续孵育1 h,TBST 缓冲液洗膜5 次。滴加ECL 显影液,凝胶成像系统分析,计算目的蛋白条带的相对表达量。
1.4 统计学处理
通过SPSS 23.0 统计软件对数据进行分析,数据采用均数±标准差(±s)的形式表示。多组间数据的比较以单因素方差(ANOVA)进行分析,组间两两的比较采用LSD 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 连草泻痢胶囊对小鼠结肠长度的影响
实验过程中,模型组小鼠死亡2 只,连草泻痢组和美沙拉嗪组小鼠各死亡1 只。模型组结肠长度较空白组明显缩短,差异具有统计学意义(P<0.01);与模型组相比,连草泻痢胶囊和美沙拉嗪均能明显增加UC 小鼠结肠长度,组间比较差异均具有统计学意义(P<0.05)。见表1。
2.2 连草泻痢胶囊对小鼠结肠病理组织学的影响
空白组小鼠结肠组织结构正常,而模型组小鼠结肠组织中可见局部溃疡、糜烂,黏膜下层可见大量的炎性细胞存在及肉芽组织形成,其中组织病理学评分与空白组相比显著增加,差异具有统计学意义(P<0.01)。连草泻痢胶囊及美沙拉嗪均能够显著改善结肠组织结构及炎性细胞的浸润,尤其是组织水肿和黏膜溃疡、糜烂明显得到改善。两组组织病理学评分与模型组比较均显著降低,差异具有统计学意义(P<0.01)。见图1 和表1。
表1 连草泻痢胶囊对小鼠结肠长度的影响(±s)Tab 1 Effect of Liancao Xieli capsule on colon length in mice(±s)
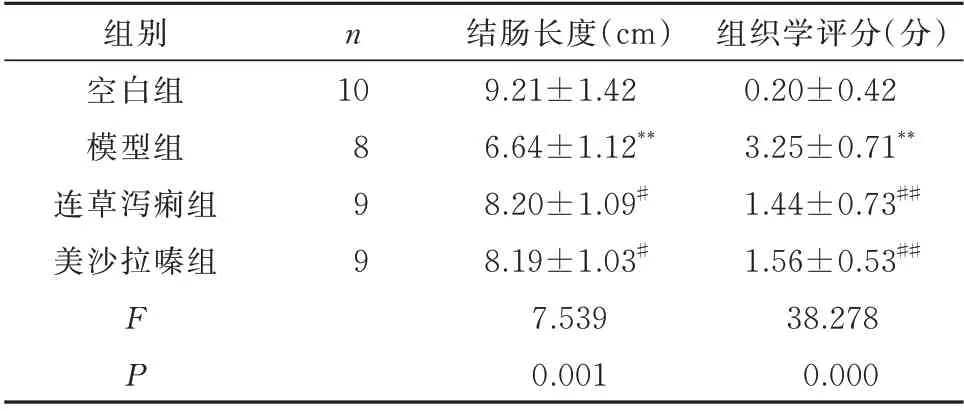
表1 连草泻痢胶囊对小鼠结肠长度的影响(±s)Tab 1 Effect of Liancao Xieli capsule on colon length in mice(±s)
注:与空白组比较,*P<0.05,**P<0.01,与模型组比较,#P<0.05,##P<0.01。
组织学评分(分)0.20±0.42 3.25±0.71**1.44±0.73##1.56±0.53##38.278 0.000组别空白组模型组连草泻痢组美沙拉嗪组n 10 899 FP结肠长度(cm)9.21±1.42 6.64±1.12**8.20±1.09#8.19±1.03#7.539 0.001
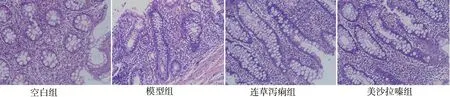
图1 各组小鼠结肠HE 染色(×400)Fig 1 HE staining of colon of mice in each group(×400)
2.3 连草泻痢胶囊对血清及结肠组织炎症因子的影响
ELISA 结果显示,与空白组相比,模型组血清及结肠组织中TNF-α、IL-6、IL-1β、IL-8、IL-17 和INF-γ 的含量均明显增加,差异均具有统计学意义(P<0.01)。与模型组相比,连草泻痢组和美沙拉嗪组血清及结肠组织中炎性因子TNF-α、IL-6、IL-1β、IL-8、IL-17 和INF-γ 的含量均明显减少,差异均具有统计学意义(P<0.01)。见表2、3。
表2 连草泻痢胶囊对血清炎症因子的影响(pg/mL,±s)Tab 2 Effect of Liancao Xieli capsule on serum inflammatory factors(pg/mL,±s)
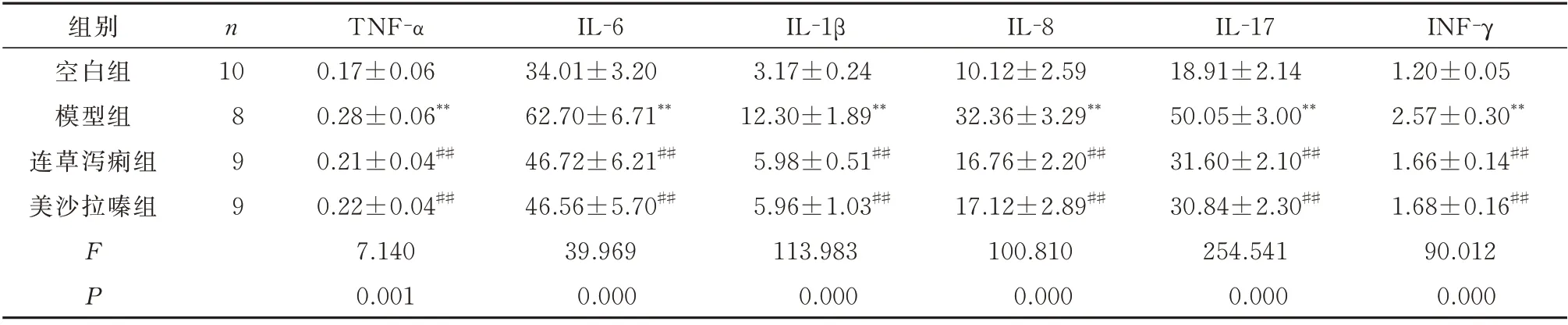
表2 连草泻痢胶囊对血清炎症因子的影响(pg/mL,±s)Tab 2 Effect of Liancao Xieli capsule on serum inflammatory factors(pg/mL,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白组模型组连草泻痢组美沙拉嗪组INF-γ 1.20±0.05 2.57±0.30**1.66±0.14##1.68±0.16##90.012 0.000 n 10 899 FP TNF-α 0.17±0.06 0.28±0.06**0.21±0.04##0.22±0.04##7.140 0.001 IL-6 34.01±3.20 62.70±6.71**46.72±6.21##46.56±5.70##39.969 0.000 IL-1β 3.17±0.24 12.30±1.89**5.98±0.51##5.96±1.03##113.983 0.000 IL-8 10.12±2.59 32.36±3.29**16.76±2.20##17.12±2.89##100.810 0.000 IL-17 18.91±2.14 50.05±3.00**31.60±2.10##30.84±2.30##254.541 0.000
表3 连草泻痢胶囊对结肠组织中炎症因子的影响(pg/mg,±s)Tab 3 Effect of Liancao Xieli capsule on serum inflammatory factors(pg/mg,±s)
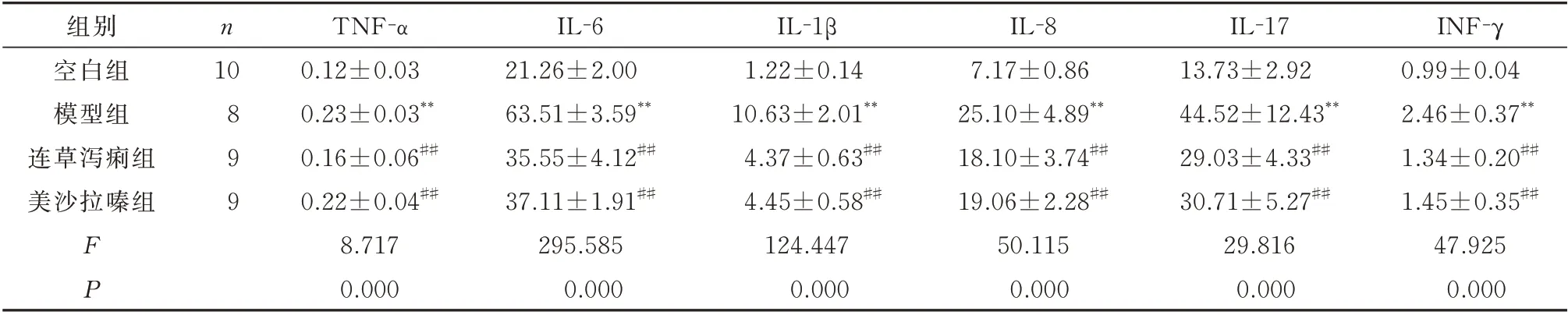
表3 连草泻痢胶囊对结肠组织中炎症因子的影响(pg/mg,±s)Tab 3 Effect of Liancao Xieli capsule on serum inflammatory factors(pg/mg,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白组模型组连草泻痢组美沙拉嗪组INF-γ 0.99±0.04 2.46±0.37**1.34±0.20##1.45±0.35##47.925 0.000 n 10 899 FP TNF-α 0.12±0.03 0.23±0.03**0.16±0.06##0.22±0.04##8.717 0.000 IL-6 21.26±2.00 63.51±3.59**35.55±4.12##37.11±1.91##295.585 0.000 IL-1β 1.22±0.14 10.63±2.01**4.37±0.63##4.45±0.58##124.447 0.000 IL-8 7.17±0.86 25.10±4.89**18.10±3.74##19.06±2.28##50.115 0.000 IL-17 13.73±2.92 44.52±12.43**29.03±4.33##30.71±5.27##29.816 0.000
2.4 连草泻痢胶囊对TLR4/PI3K/Akt/mTOR 信号通路的影响
由图2 可见,与空白组相比,模型组结肠组织中TLR4、PI3K、p-Akt 和p-mTOR 蛋白的表达水平显著上调,差异均具有统计学意义(P<0.01),而Akt和mTOR 蛋白的表达水平无明显变化,差异均无统计学意义(P>0.05)。与模型组相比,连草泻痢组和美沙拉嗪组结肠组织中TLR4、PI3K、p-Akt 和p-mTOR 蛋白的表达显著下调,差异均具有统计学意义(P<0.01),而连草泻痢胶囊及美沙拉嗪对结肠组织中Akt 和mTOR 蛋白的的表达水平无明显影响,差异均无统计学意义(P>0.05)。见表4。
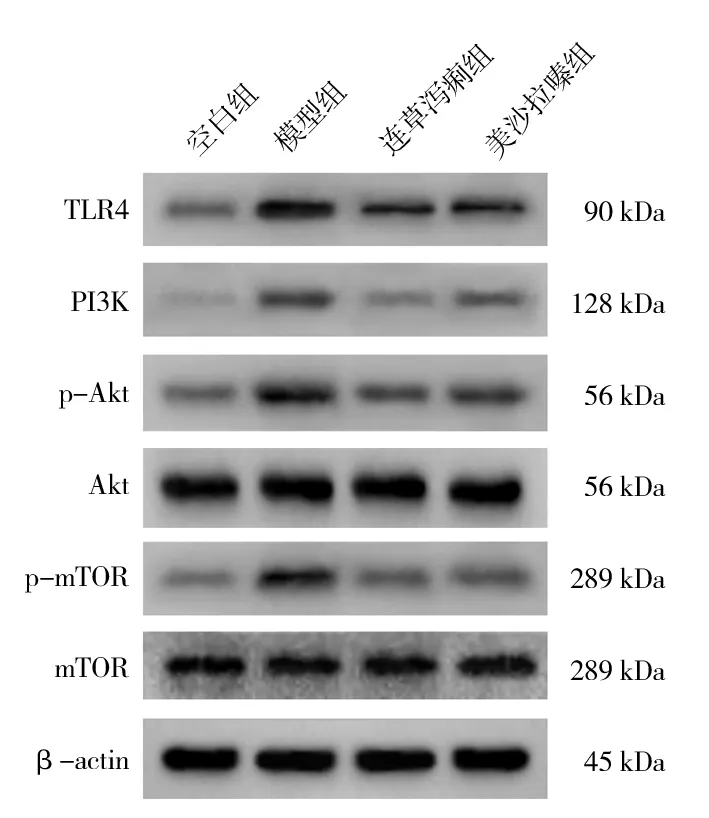
图2 各组小鼠结肠组织中TLR4/PI3K/Akt/mTOR 信号通路相关蛋白的表达Fig 2 Expression of TLR4 /PI3K /Akt/mTOR signal pathway related proteins in colon tissues of mice in each group
表4 连草泻痢胶囊对TLR4/PI3K/Akt/mTOR 信号通路的影响(pg/mg,±s)Tab 4 Effect of Liancao Xieli Capsule on TLR4/PI3K/Akt/mTOR signal pathway(pg/mg,±s)
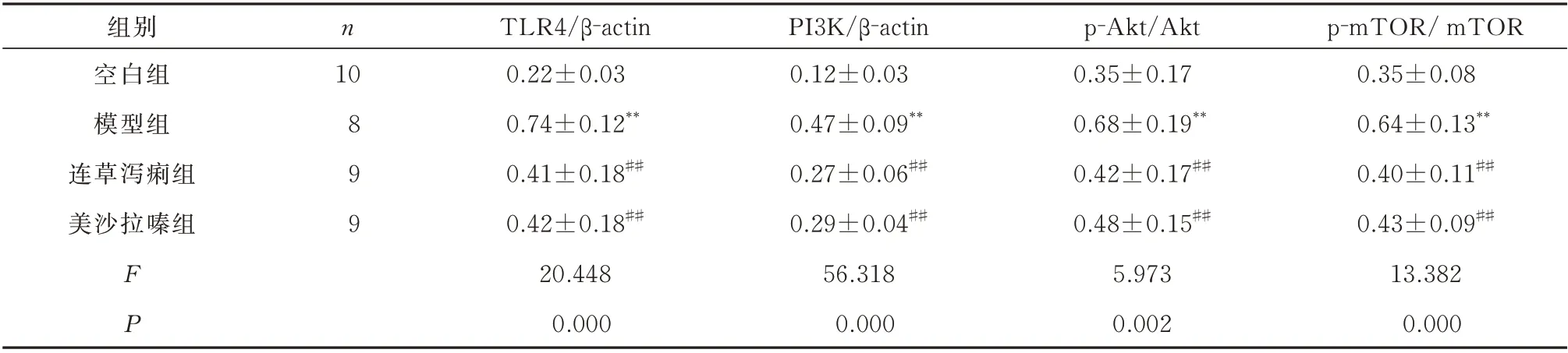
表4 连草泻痢胶囊对TLR4/PI3K/Akt/mTOR 信号通路的影响(pg/mg,±s)Tab 4 Effect of Liancao Xieli Capsule on TLR4/PI3K/Akt/mTOR signal pathway(pg/mg,±s)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
p-mTOR/ mTOR 0.35±0.08 0.64±0.13**0.40±0.11##0.43±0.09##13.382 0.000组别空白组模型组连草泻痢组美沙拉嗪组n 10 899 FP TLR4/β-actin 0.22±0.03 0.74±0.12**0.41±0.18##0.42±0.18##20.448 0.000 PI3K/β-actin 0.12±0.03 0.47±0.09**0.27±0.06##0.29±0.04##56.318 0.000 p-Akt/Akt 0.35±0.17 0.68±0.19**0.42±0.17##0.48±0.15##5.973 0.002
3 结论
UC 的发病是由多种因素共同参与的结果,主要包括饮食环境因素、心理因素及遗传易感性等。有研究显示,蛋奶制品和高动物脂肪饮食能够增加UC 发病的风险,这可能是因为蛋奶制品和高动物脂肪饮食能够对肠道菌群及肠道免疫产生影响,从而损伤肠道黏膜屏障[9]。此外根据流行病学调查结果显示,UC 的发病因地域而异,表现为欧美地区高,亚非地区低发病率,农村低于城市的特点[10]。除此之外,UC 还具有复杂的病理机制,目前尚未完全阐明。目前的研究普遍认为肠道黏膜屏障功能受损出现在UC 发病的早期,进而导致肠道黏膜上皮通透性的改变诱导肠道神经内分泌功能的紊乱[11]。此外,一旦结肠黏膜的完整性和功能受到破坏,来源于肠道内的病原菌及其代谢产物通过侵入结肠黏膜,加重或诱发肠道局部炎症反应,从而导致UC 的形成[12]。
炎症反应是UC 病理机制的核心,而细胞因子作为炎症介质调控肠道黏膜的病理性损伤,在UC的发病过程中发挥着重要的作用[13]。TNF-α、IL-6、IL-1β、IL-8、IL-17 和INF-γ 是重要的促炎因子,介导UC 的发病。TNF-α 由活化的巨噬细胞产生,能够促进巨噬细胞的增殖、分化和募集中性粒细胞,促进肠道黏膜的局部炎症。不仅如此,TNF-α 还可以促进IL-1 和IL-6 的分泌,并与之协同作用,参与细胞的炎症和凋亡[14]。IL-8 是由TNF-α 和IL-6 促进生成的炎性细胞因子,通过对嗜碱性粒细胞及T细胞的趋化作用和促进中性粒细胞的黏附与活化,参与肠道炎症反应[15]。同时,临床研究显示UC 患者TNF-α、IL-6、IL-1β 和IL-8 的水平增加,并且与UC 的疾病活动指数呈明显正相关[16]。IL-17 主要由辅助性T 细胞17 分泌,不仅可以诱导内皮细胞和上皮细胞分析IL-6 和IL-8 等炎症因子,还可以通过增加肠道黏膜的通透性并募集中性粒细胞,诱导UC 肠道黏膜的炎症反应,引起腹泻和黏液脓血便的发生[17]。
TLR4 是TLRs 家族的一员,通过识别病原体表面的相关分子模式诱导下游信号通路的活化,从而激活炎症因袭的表达,诱导肠道炎症反应[18]。TLR4 信号是促炎细胞因子释放的主要通路之一,通过激活下游PI3K/Akt/mTOR 信号通路的活化,参与UC 肠道炎症反应和癌变过程[19-21]。PI3K 是细胞内磷脂酰肌醇的激酶,激活后的PI3K 通过质膜上产生的第二信使磷脂酰肌醇三磷酸与细胞内含有PH 结构域的信号蛋白Akt 结合,从Akt 转移至细胞膜并改变其构象。作为Akt 下游重要的效应分子之一,Akt 的活化常伴随着m TOR 的磷酸化,而mTOR 的活化对于细胞的增殖、凋亡和炎症反应的调节方面具有重要的作用[22]。课题组前期的研究结果显示,连草泻痢胶囊能够有效改善UC 肠道黏膜屏障功能。在此基础上本研究结果显示,连草泻痢胶囊可以抑制UC 小鼠肠组织中TLR4 蛋白的表达,进而抑制PI3K/Akt/mTOR 信号通路的活化,从而减少炎症因子的分泌和肠道炎症反应。
综上所述,连草泻痢胶囊可以有效改善UC 肠道炎症反应,其作用机制主要是通过抑制TLR4/PI3K/Akt/mTOR 信号通路的活化实现的。
作者贡献度说明:
战晶玉:实验设计,指标检测,撰写论文;袁星星、王炳予:实验造模、药物干预;刘长发:指标检测;张雅丽:实验数据审核及统计分析,审阅。

