基于ERK/NF⁃κB 通路探讨益肾散结化瘀复方对IgA 肾病大鼠肾内小动脉病变的防治作用
刘 璐,张晓东,田 耘
(1. 陕西中医药大学第一临床医学院,陕西咸阳 712046;2. 宝鸡市第三医院肾内科,陕西宝鸡 721000;3. 陕西省中医医院肾病一科,陕西西安 710003)
IgA 肾病(IgAN)是以IgA 为主的循环免疫复合物在肾脏沉积的疾病[1],是我国最常见的原发性肾脏病之一,约1/3 的患者于10~20 年发展为终末期肾脏病[2],对我国人民身心健康造成极大负担,因此积极防治IgA 肾病成为研究重点之一。目前,研究发现肾内小动脉病变与IgA 肾病预后密切相关,其中细胞外调节蛋白激酶/核转录因子-κB(ERK/NF-κB)信号通路可通过介导血小板源性生长因子、胰岛素样生长因子等细胞因子及白介素-6、肿瘤坏死因子-α 等炎症因子的细胞内信号转导,引起血管内皮功能受损、内皮细胞增殖及外基质增加,导致血管壁增厚[3-7]。同时可调控转化生长因子-β1 对平滑肌的刺激,产生人基质金属蛋白酶-9(MMP-9)进而引起肾间质损伤[8]。因此阻断ERK/NF-κB 信号通路可减轻IgA 肾病肾内动脉及肾组织的病变,进而延缓IgAN 的进展。
益肾散结化瘀复方(肾复康Ⅱ号胶囊)是我院自产药剂[批准文号:陕药管字(2001)第1168 号,陕西省中医医院制剂中心提供],主要由山萸肉、菟丝子、熟地黄、金樱子、淫羊藿、丹参、赤芍、姜黄、黄芪、山药、王不留行、鳖甲(醋)等组成,具有补肾散结,活血化瘀的功效,目前已广泛应用于慢性肾小球肾炎等疾病。既往的动物实验证明[9-11]其可介导白介素1(IL-1)、血管紧张素Ⅱ(AngⅡ)及Ⅳ型胶原的表达,抑制系膜细胞的增殖,同时还能够缓解免疫复合型肾炎大鼠的高凝状态,减少TGF-β1 在肾组织的表达,抑制肾脏纤维化。故本研究以IgAN大鼠为模型,通过研究益肾散结化瘀复方干预ERK/NF-κB 信号通路,探讨该方防治IgAN 肾内小动脉病变的机制,为进一步治疗IgAN 提供依据。
1 材料与方法
1.1 实验动物
SD 健康清洁雄性大鼠55 只,6~8 周龄,体重180~200 g,购买于西安交通大学动物实验中心。本研究所有方案和操作手段已获得陕西省中医医院伦理委员会的批准。
1.2 实验药物
肾复康Ⅱ号胶囊为陕西省中医医院院内制剂[批准文号:陕药管字(2001)第1168 号,陕西省中医医院制剂中心提供];氯沙坦钾,50 mg (批准文号:H20000371,杭州默沙东制药有限公司生产)。
1.3 试剂
四氯化碳(CCl4,天津富宇精细化工有限公司)、10%盐酸(国药集团)、蓖麻油(天津富宇精细化工有限公司)、脂多糖(LPS,北京索莱宝公司)、牛血清白蛋白(BSA,北京索莱宝公司)、10%水合氯醛溶液(上海山浦化工有限公司)、MMP-9 抗体(小鼠抗人)(英国Abcam)、ERK1/2 抗体(兔抗大鼠,武汉三鹰生物技术有限公司)、血管内皮生长因子(VEGF)抗体(兔抗人,Santa)、增殖细胞核抗原(PCNA)抗体(兔抗人,博士德)、NF-κB 抗体(兔抗大鼠,武汉三鹰生物技术有限公司)、浓缩型正常山羊血清(封闭)(武汉博士德生物工程有限公司)、荧光(FITC)标记羊抗小鼠IgG(武汉博士德生物工程有限公司)、抗荧光淬灭封片剂(southernbiotech)。
1.4 仪器
OlympusCX 41 荧光显微镜及光学显微镜(日本奥林巴斯公司)、HMIAS-2000 图像采集分析系统(北京中科)、全自动凝胶成像系统(美国伯乐公司)、酶标仪(美国伯乐公司)YABO 石蜡自动包埋机(江苏常州)医用离心机(江苏康捷医疗器械有限公司)、RM2235 轮转式切片机(德国徕卡公司)医用离心机(江苏康捷医疗器械有限公司)恒温水浴锅(金坛市城东新瑞仪器厂)超低温冰箱(日本三洋)。
1.5 实验方法
1.5.1 动物模型的建立及分组 将55 只雄性SD 大鼠用苦味酸标记,适应性饲养1 周,然后按照随机数字表法分为4 组,即空白组、模型组、肾复康Ⅱ号胶囊组、氯沙坦钾片组,其中空白组10 只大鼠,其余各组15 只大鼠。造模方法按照BSA+ CCl4+ LPS 联合方案[12]并加以改进,在实验第2 周除空白组其余各组大鼠予牛血清白蛋白盐酸酸化水2 mL/只(约400 mg/kg)隔日灌胃,持续12 周;同时用CCl4皮下注射(剂量:0.5 mL 蓖麻油+0.1 mL CCl4/只),1 次/周,连续12 周;并联合应用LPS(分别在第6、8、10周,0.05 mg/只)尾静脉注射,共3 次。以造模大鼠肾小球系膜区检测出以IgA 为主的免疫荧光颗粒或团块状为造模成功的标准。
1.5.2 给药方案 将肾复康Ⅱ号胶囊及氯沙坦钾片碾成粉末并分别溶解为1.12 g/kg 及25 mg/kg 的混悬液,于实验第3 周开始进行灌胃治疗,治疗共持续11 周。肾复康Ⅱ号胶囊组:造模成功后,肾复康Ⅱ号胶囊混悬液每天2 mL/只灌胃;氯沙坦钾片组:造模成功后,氯沙坦钾混悬液每天2 mL/只灌胃;空白组及模型组均以等量蒸馏水灌胃。
1.6 指标检测
1.6.1 24 h 尿蛋白检测 分别于实验第4、8、12 周采集大鼠24 h 尿量,并进行记录,应用全自动生化分析仪测定24 h 尿蛋白水平。
1.6.2 血清生化指标检测 在12 周末用10%水合氯醛腹腔注射麻醉大鼠,腹主动脉取血5 mL 至促凝管中,4 ℃冰箱冷藏,3 000 r/min,离心10 min 后分离上清液,采用全自动生化分析仪用酶法检测血肌酐(SCr)及尿素氮(BUN),采用放射免疫分析法检测醛固酮(ADS)、AngⅡ。
1.6.3 肾小球及肾小管病变程度观察 12 周末将大鼠处死,迅速摘取大鼠肾皮质与肾髓质,然后切片放入3 个清洁的离心管中,分别为光镜5 mL 清洁小管[装有FFA 固定液(配方为10%甲醛10 mL+冰醋酸5 mL+90%乙醇溶液85 mL)]、荧光5 mL清洁小管(装有5 mL 生理盐水,并用无菌纱布进行包裹),电镜1 mL 清洁小管(装有2%戊二醛液),其中光镜小管和电镜小管放在4 ℃水箱冷藏;荧光小管-70 ℃放在冰箱冷冻。然后取0.5 μm 肾组织切片进行梯浓度酒精脱水、透明、浸蜡、包埋,做HE、Massion 及PASM 染色,放置在光镜下观察病变程度。
1.6.4 肾组织及小动脉相关因子的表达 将石蜡切片依次放入二甲苯,无水乙醇,蒸馏水浸洗2 min进行脱蜡;然后用微波进行抗原修复,用磷酸盐缓冲液(pH7.4)冲洗3 遍;在切片组织滴入过氧化氢进行孵育,随后用磷酸盐缓冲液再次冲洗3 次,每次3 min,接着进行血清封闭并加入一抗(VEGF 抗体1∶100、PCNA 抗体1∶100、MMP-9 抗体1∶50、ERK1/2 抗体1∶100、NF-κB 抗体1∶100)、二抗(过氧化物酶标记羊抗小鼠IgG,原液不稀释)、显色剂,上述步骤完成后在进行复染、脱水及封片,最后在多功能显微镜下进行拍照,对肾组织及小动脉区域VEGF、MMP-9、PCNA、ERK 1/2、NF-κB 的灰度值(以阳性单位表示)进行测量。
1.6.5 肾脏动脉厚度的检测 将Masson 染色的大鼠肾脏病理标本放置在电子显微镜下,截取肾动脉近正中矢状位横截面,使用医学图像分析管理系统依次检测内膜厚度/血管外径、中膜厚度/血管外径、管壁厚度/血管外径,分别反映内膜、中膜及管壁增厚程度。
1.7 统计学处理
使用SPSS23.0 软件进行数据分析。正态分布数据用(±s)表示,组间比较方差齐性时采用单因素分析(one-way ANOVA),方差不齐时采用非参数秩和检验进行组间比较,组间两两比较时采用LSD检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠24 h 尿蛋白定量
各组24 h 尿蛋白定量检测结果显示:与同时期空白组比较,模型组大鼠24 h 尿蛋白定量明显升高,差异有统计学意义(P<0.01),在4、8、12 周时,肾复康Ⅱ号胶囊组与模型组相比,24 h 尿蛋水平明显降低,差异有统计学意义(P<0.05);在4、8 周时,肾复康Ⅱ号胶囊组与氯沙坦钾片组相比,差异明显(P<0.05);但12 周时,肾复康Ⅱ号胶囊组与氯沙坦钾片组相比,24 h 尿蛋白水平无明显差异(P>0.05),见表1。
表1 各组尿蛋白定量的比较(mg/24 h,±s)Tab1 Quantification of urine protein in each group(m g/2 4 h,±s)
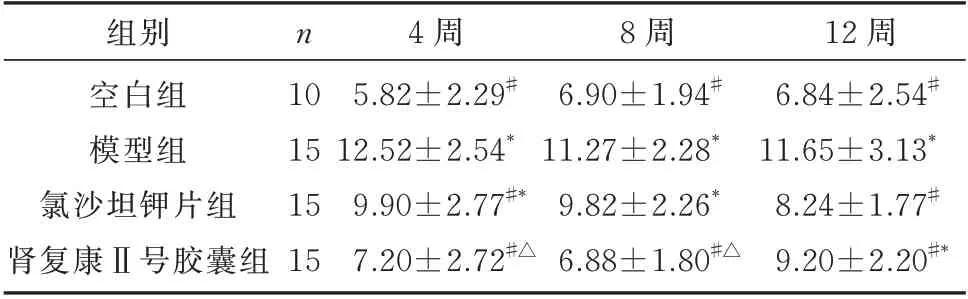
表1 各组尿蛋白定量的比较(mg/24 h,±s)Tab1 Quantification of urine protein in each group(m g/2 4 h,±s)
注:与同时期空白组比较,*P<0.05;与同时期模型组比较,#P<0.01;与同时期氯沙坦钾片组比较,△P<0.05。
12 周6.84±2.54#11.65±3.13*8.24±1.77#9.20±2.20#*组别空白组模型组氯沙坦钾片组肾复康Ⅱ号胶囊组n 10 15 15 15 4 周5.82±2.29#12.52±2.54*9.90±2.77#*7.20±2.72#△8 周6.90±1.94#11.27±2.28*9.82±2.26*6.88±1.80#△
2.2 各组大鼠ADS、AngⅡ、Cr、BUN
肾复康Ⅱ号胶囊组与氯沙坦钾片组ADS 相比,无明显差异(P<0.05);肾复康Ⅱ号胶囊组与氯沙坦钾片组AngⅡ相比,差异有统计学意义(P<0.05)。BUN 方面,与模型组相比,肾复康Ⅱ号胶囊组和氯沙坦钾片组两组数值均明显下降(P均<0.05),Scr方面,肾复康Ⅱ号胶囊组与氯沙坦钾片组相比,无明显差异(P>0.05),两组与空白组相比无明显差异(P>0.05)。见表2。
表2 各组ADS、AngⅡ、BUN、Scr 比较(±s)Tab 2 Comparison of ADS,AngⅡ,BUN,Scr among rats in each group(±s)
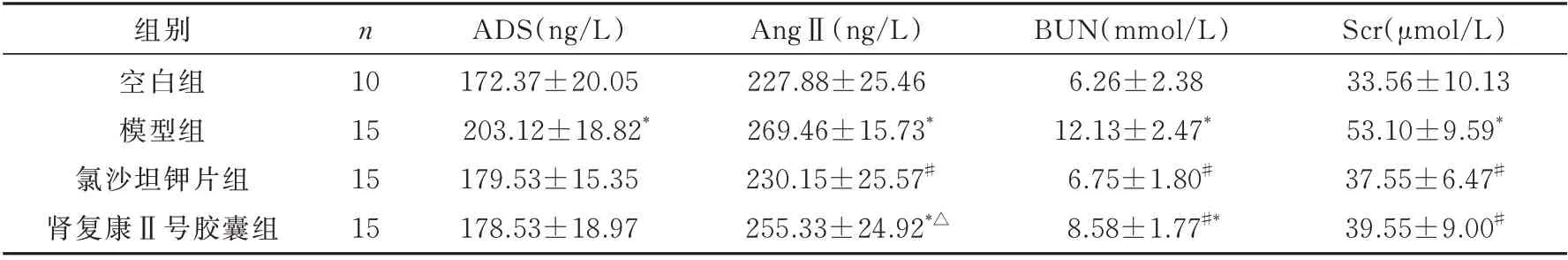
表2 各组ADS、AngⅡ、BUN、Scr 比较(±s)Tab 2 Comparison of ADS,AngⅡ,BUN,Scr among rats in each group(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.01;与氯沙坦钾片组比较,△P<0.05。
Scr(μmol/L)33.56±10.13 53.10±9.59*37.55±6.47#39.55±9.00#组别空白组模型组氯沙坦钾片组肾复康Ⅱ号胶囊组n 10 15 15 15 ADS(ng/L)172.37±20.05 203.12±18.82*179.53±15.35 178.53±18.97 AngⅡ(ng/L)227.88±25.46 269.46±15.73*230.15±25.57#255.33±24.92*△BUN(mmol/L)6.26±2.38 12.13±2.47*6.75±1.80#8.58±1.77#*
2.3 肾小球及肾小管病变程度评价
空白组大鼠肾小球形态基本正常,肾间质未见增宽,系膜基质基本正常,系膜细胞未见增殖;模型组大鼠肾小球系膜细胞弥漫性增生,基质增多,部分肾小球皱缩。氯沙坦钾片组大鼠可见中度系膜细胞增殖和基质硬化,少数肾小球硬化,系膜细胞增殖,基质增多,肾小球局灶节段性增生。肾复康Ⅱ号胶囊组大鼠多数肾小球基本正常,轻度系膜基质增宽。各组肾脏病理学PAS、H & E 及Masson染色表现见图1~3。
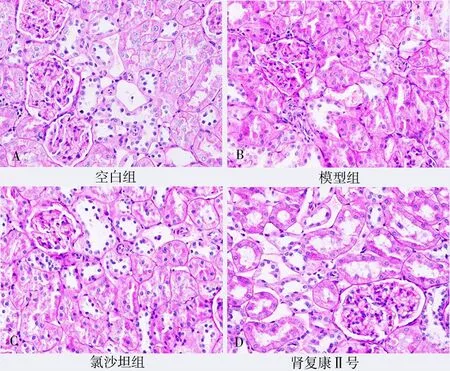
图1 PAS 染色各组大鼠肾组织变化(×400)Fig 1 Changes of rat kidney tissues in each group by PAS staining(×400)
2.4 肾组织及小动脉VEGF、MMP-9、PCNA、ERK1/2、NF-κB 的表达
与模型组比较,肾复康Ⅱ号胶囊组及氯沙坦钾片组的VEGF、MMP-9、PCNA、ERK1/2、NF-κB 表达均有明显减少,差异有统计学意义(P均<0.05)。但肾复康Ⅱ号胶囊组与氯沙坦钾片组进行组间比较,差异无统计学意义(P>0.05)。见表3 及图4~8。
表3 各组肾内VEGF、MMP⁃9、PCNA、ERK1/2、NF⁃κB 表达(±s)Tab 3 Expression of VEGF,MMP⁃9,PCNA,ERK1/2,NF⁃κB in the kidney of each group of rats(±s)
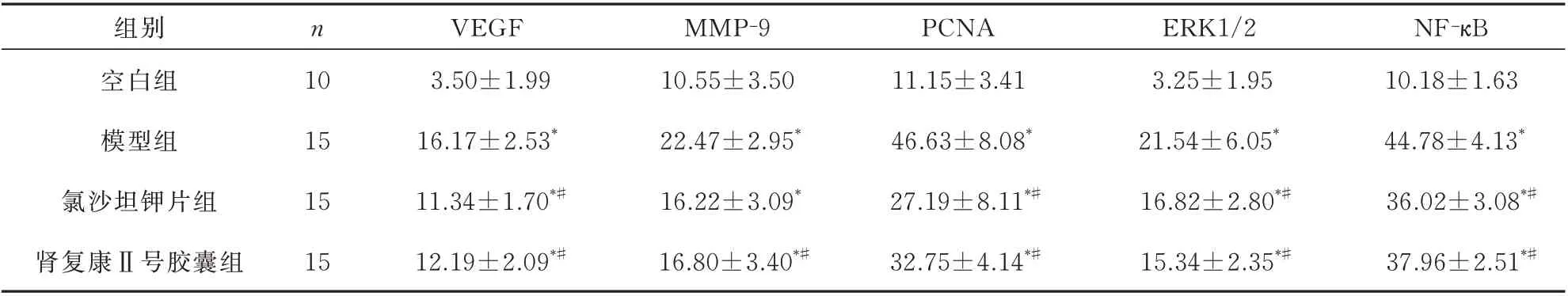
表3 各组肾内VEGF、MMP⁃9、PCNA、ERK1/2、NF⁃κB 表达(±s)Tab 3 Expression of VEGF,MMP⁃9,PCNA,ERK1/2,NF⁃κB in the kidney of each group of rats(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
组别空白组模型组氯沙坦钾片组肾复康Ⅱ号胶囊组NF-κB 10.18±1.63 44.78±4.13*36.02±3.08*#37.96±2.51*#n 10 15 15 15 VEGF 3.50±1.99 16.17±2.53*11.34±1.70*#12.19±2.09*#MMP-9 10.55±3.50 22.47±2.95*16.22±3.09*16.80±3.40*#PCNA 11.15±3.41 46.63±8.08*27.19±8.11*#32.75±4.14*#ERK1/2 3.25±1.95 21.54±6.05*16.82±2.80*#15.34±2.35*#
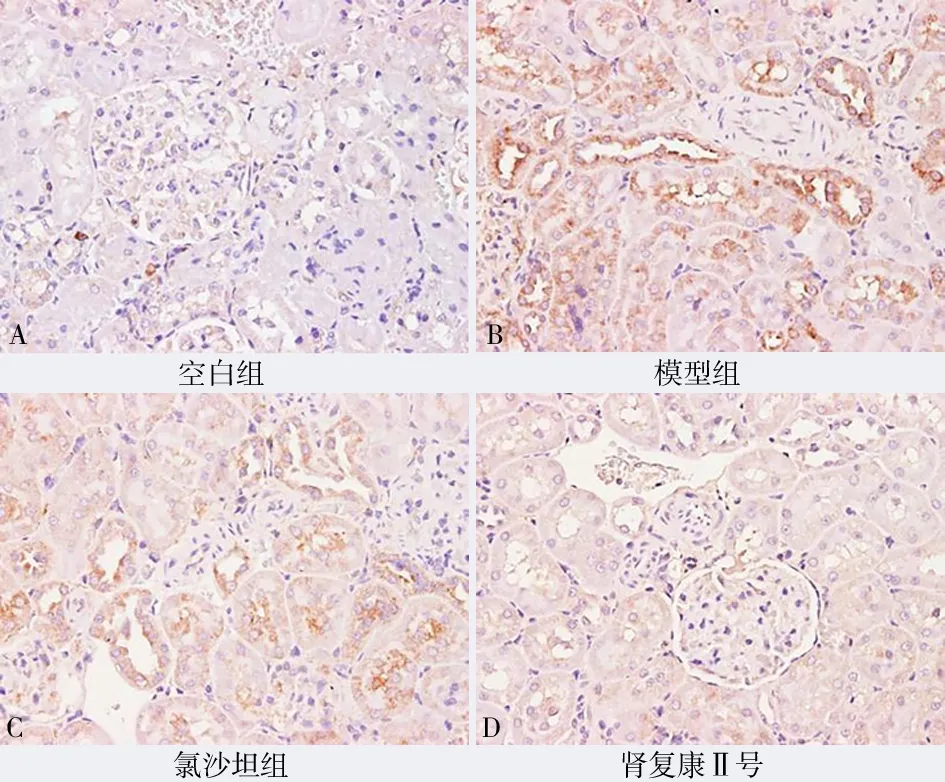
图4 各组VEGF 表达(免疫组化染色,×200)Fig 4 VEGF expression in each group(IHC,×200)
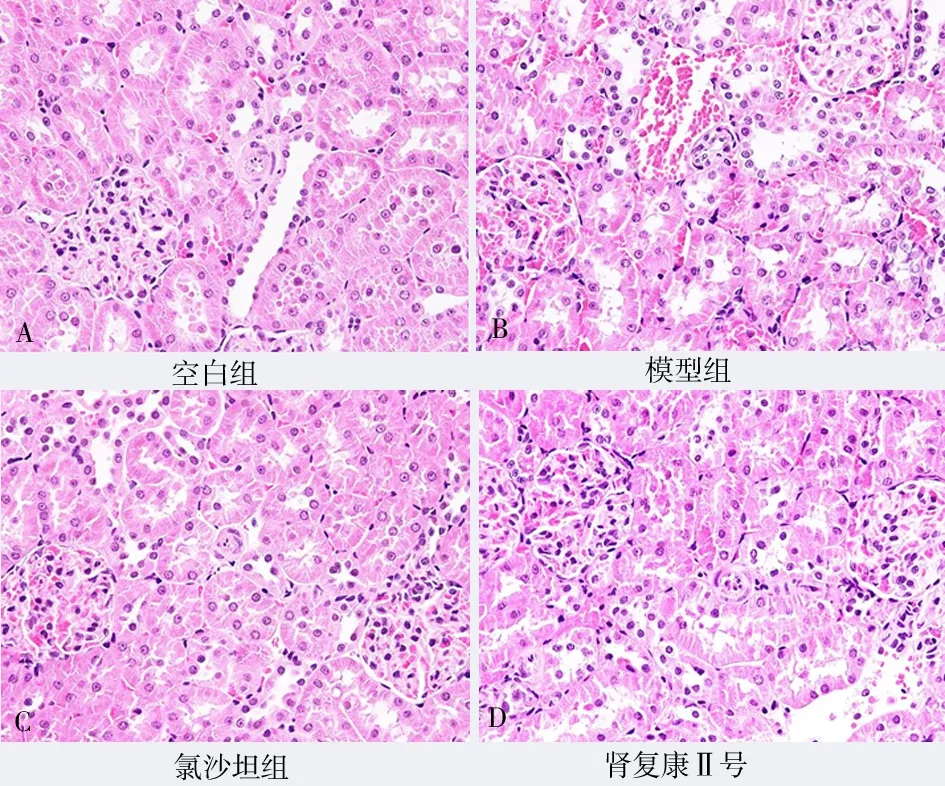
图2 H & E 染色各组大鼠肾组织变化(×400)Fig 2 Changes of rat kidney tissues in each group by H &E staining(×400)
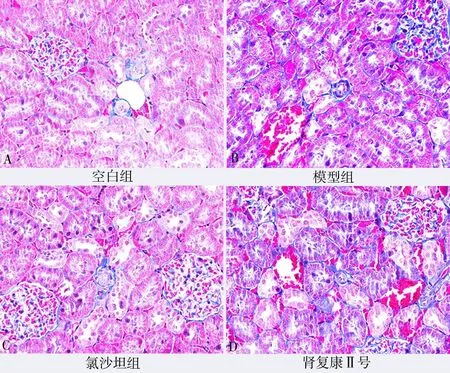
图3 Masson 染色各组大鼠肾组织变化(×400)Fig 3 Changes of rat kidney tissues in each group by Masson staining(×400)
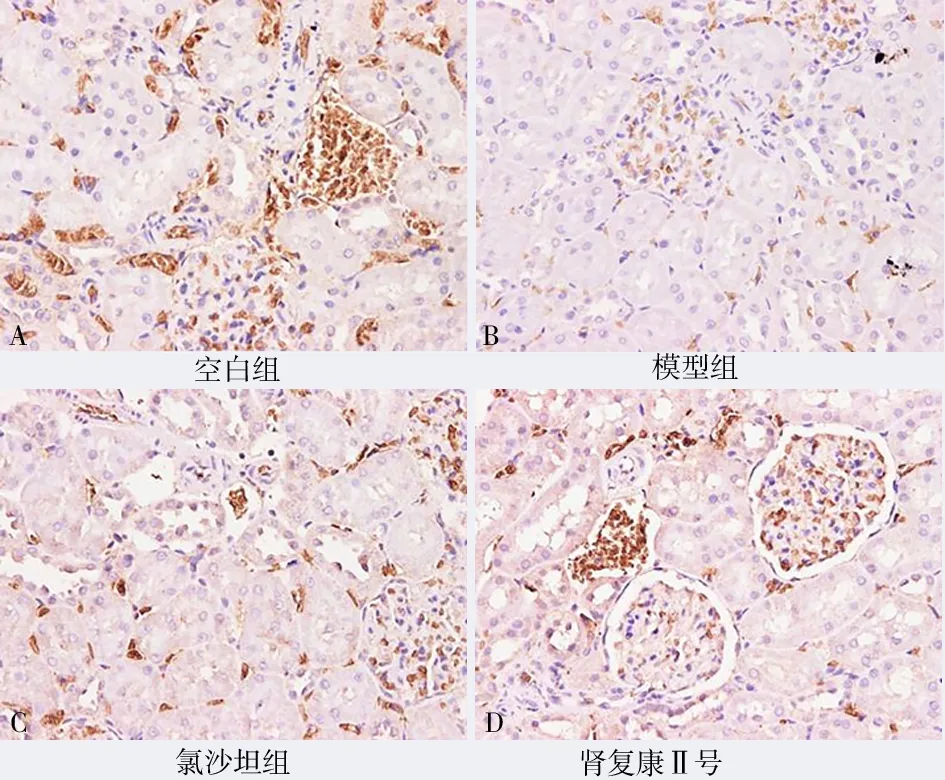
图5 各组MMP-9 表达(免疫组化染色,×200)Fig 5 MMP⁃9 expression in each group(IHC,×200)
2.5 肾内小动脉的病变
与模型组相比,肾复康Ⅱ号胶囊组及氯沙坦钾片组的内膜/血管外径、管壁/血管外径有明显差异(P<0.05),而中膜/血管外径与模型组相比较,两组无明显差异(P>0.05),见表4。
表4 各组肾内小血管厚度值(mm,±s)Tab 4 The thickness of small blood vessels in the kidney of each group(mm,±s)
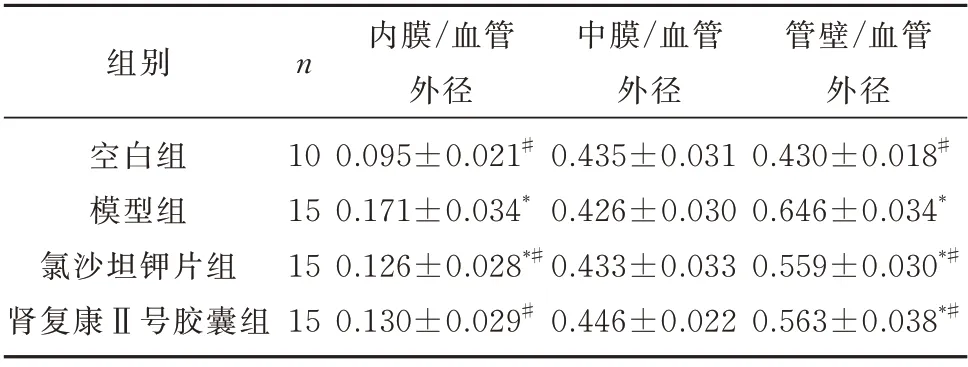
表4 各组肾内小血管厚度值(mm,±s)Tab 4 The thickness of small blood vessels in the kidney of each group(mm,±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
n组别空白组模型组氯沙坦钾片组肾复康Ⅱ号胶囊组管壁/血管外径0.430±0.018#0.646±0.034*0.559±0.030*#0.563±0.038*#10 15 15 15内膜/血管外径0.095±0.021#0.171±0.034*0.126±0.028*#0.130±0.029#中膜/血管外径0.435±0.031 0.426±0.030 0.433±0.033 0.446±0.022
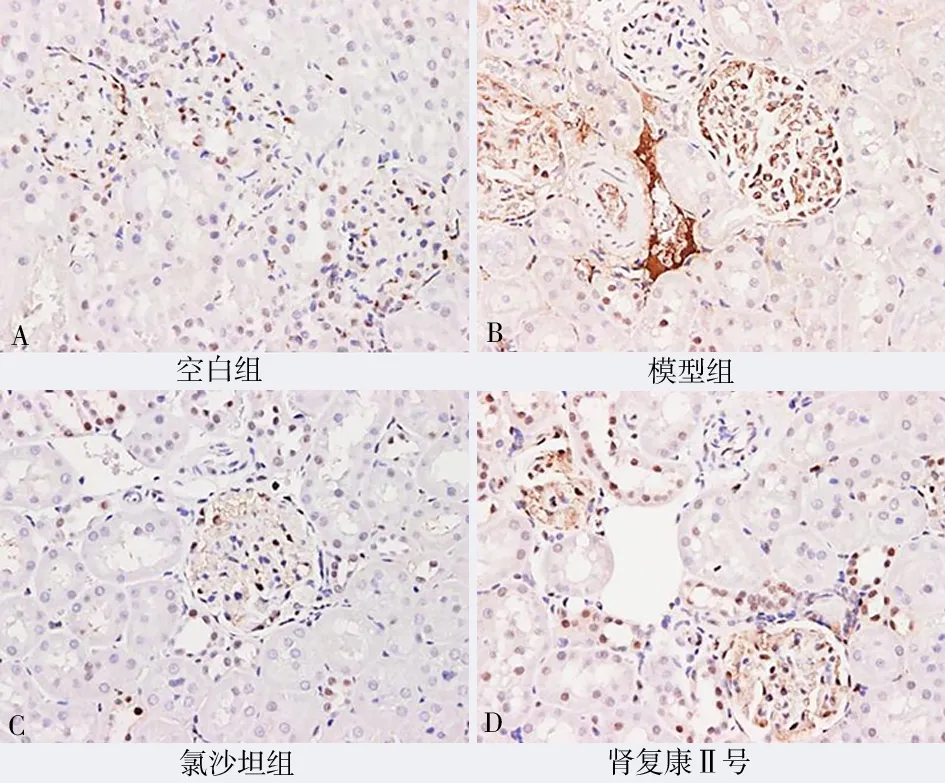
图6 各组PCNA 表达(免疫组化染色,×200)Fig 6 PCNA expression in each group(IHC,×200)
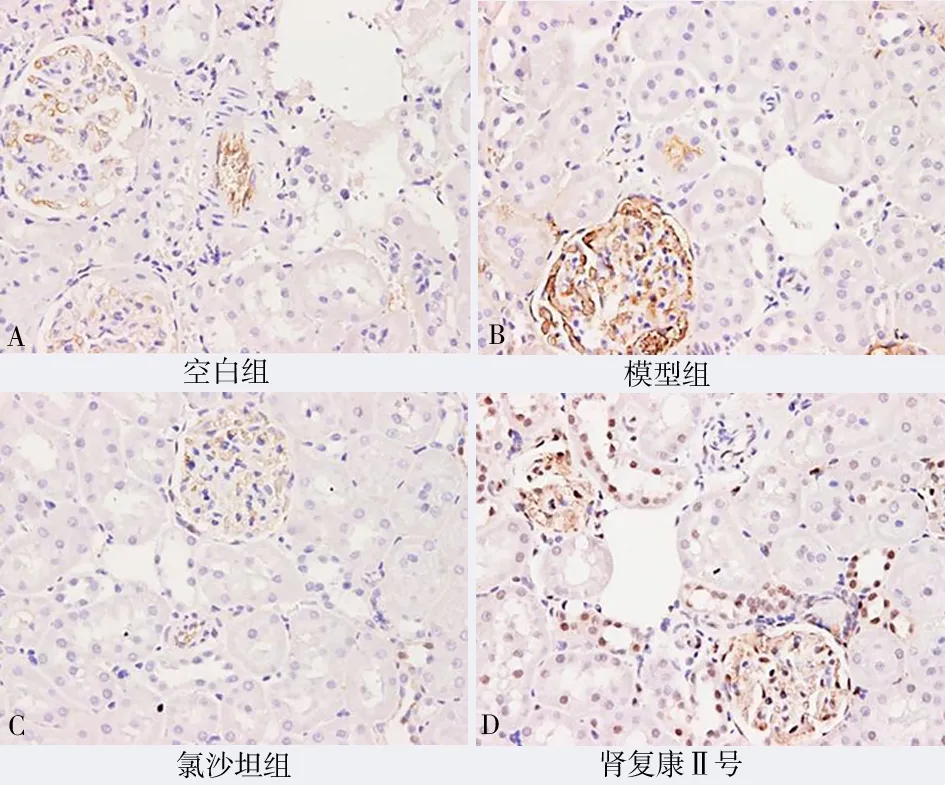
图7 各组ERK1/2 表达(免疫组化染色,×200)Fig 7 ERK1/2 expression in each group(IHC,×200)
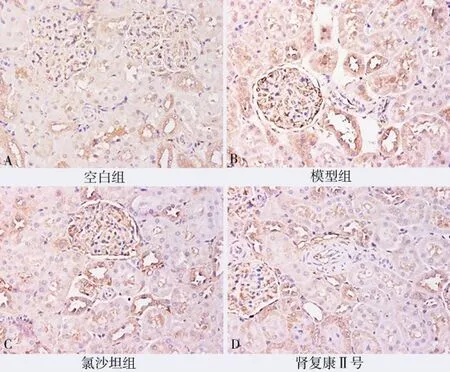
图8 各组NF-κB 表达(免疫组化染色,×200)Fig 8 NF⁃κB expression in each group(IHC,×200)
3 讨论
近年来,多个研究表明肾内小动脉的病变可能与IgA 肾病的进展相关,吴杰等[13]对1 005 例IgA 肾病患者进行回顾性分析发现,肾小球动脉病变可占54.6%,而血管病变则与患者血压、肌酐、尿蛋白水平密切相关。周素晗等[14]分析1 699 例IgA 肾病患者发现,血管病变的患者更容易发生肾脏终点事件。孔军等[15]对北京大学人民医院就诊的20 例IgA 肾病患者及10 例非IgA 肾病轻度系膜增生或局灶增生的肾小球肾炎患者比较研究发现,IgA 肾病组肾内小动脉的管壁厚度及内膜厚度均高于非IgA肾病组,而且IgA 肾病组的肾内小动脉管壁的厚度与AngⅡ呈正相关。这提示了肾素-血管紧张素系统的过度激活可能在IgA 肾病发挥了一定的作用。兰小梅[16]对100 例IgA 肾病患者进行研究发现,在大量蛋白尿的患者中,肾血管病变可占61.5%,在肌酐异常的36 例患者中,肾血管病变可占69.4%,这表明肾血管病变与大量蛋白尿及肾功能状态密切相关,肾血管病变可加速肾脏进展,并可作为反映IgA 肾病预后的一项重要指标。
研究表明,细胞外信号调节激酶(ERK)在调节细胞生长、凋亡或各种基因的表达中起关键作用[3],也在肾脏疾病发挥重要作用,激活ERK 通路可介导肾小球系膜细胞的增殖等,导致肾脏组织发生慢性病变[17]。同时在多种因素的介导下,ERK 磷酸化后被激活,导致细胞质转运至核内,促进NF-κB 的磷酸化,介导了机体炎症反应的发生[18,19]。而NF-κB通路可调节各种粘附因子、细胞因子、趋化因子等参与血管损伤的过程[20],同时也促进炎症因子如TNF-α、IL-1、IL-6 等的产生,TNF-α 可加重肾组织的损伤,IL-1 与IgA 肾病患者的预后密切相关[21],而且这些炎症因子又可上调基质金属蛋白酶(MMPs)的活性,进一步加重血管内膜的增生[22]。同时VEGF 可增加细胞内皮的通透性,诱导内皮细胞的有丝分裂,李小莉[23]研究发现,IgAN 患者血清VEGF 水平相较于健康人群明显增加,与肾小球滤过率呈现负相关性。本研究中以氯沙坦钾组为标准药物对照组,肾复康Ⅱ号胶囊组为实验组,在给药12 周处死大鼠后检测两组相关标志物,两组大鼠在Scr、ADS、BUN 与模型组相比,均有统计学差异,但两组之间比较差异并无统计学意义,在大鼠肾脏病理指标检测中,VEGF、MMP-9、PCNA、ERK1/2、NF-κB 等相关蛋白因子表达在肾组织中含量模型组显著高于空白组,而肾复康Ⅱ号胶囊组及氯沙坦钾片组较模型组均有下降,差异有统计学意义(P<0.05)。本实验在大鼠肾组织肾内血管厚度值测量上,模型组大鼠内膜、中膜、管壁厚度显著高于空白组,而肾复康Ⅱ号胶囊组大鼠在内膜及中膜厚度上明显低于模型组,管壁厚度与模型组无明显差异。
传统中医学虽然对肾内小动脉病变没有具体的描述,但根据病理特征,可表现为血管壁增厚、玻璃样病变等,同时具有固定不移、经久不愈等特点,可以辩证为中医学中“癥积”,而且IgA 肾病患者经常出现乏力,腰痛等脾肾亏虚症候,因此,我们将其病理的微观辩证与整体辩证相结合,将其准确辩证为“脾肾亏虚,痰瘀互结证”[24],治疗上采用益肾散结化瘀的治法。既往的研究证实[9-11],益肾散结化瘀复方可延缓肾脏间质纤维化,其机制可能是通过抑制炎症反应,下调TGF-β1 及纤溶酶原激活剂抑制剂-1(PAI-1)的表达,减少细胞外基质的积聚等。本动物实验研究发现,益肾散结化瘀复方可能抑制了IgA 肾病大鼠ERK/NF-κB 信号通路,降低了相关因子在肾组织的表达,抑制血管内皮细胞及平滑肌细胞增殖,防止肾内小血管的病变,同时还降低了大鼠的尿蛋白水平,减轻了肾组织损伤。

