葫芦茶苷保护活性氮诱导内皮细胞线粒体损伤的作用研究
黄巧凡,吴昊霖,徐怡倩,樊好飞,2,方星悦,王爱萍,虞道锐,孟庆雯,刘启兵,2
(1. 海南医学院基础医学与生命科学学院药理学教研室,海南海口 571199;2. 海南省热带脑科学研究与转化重点实验室,海南海口 571199)
血管内皮细胞具有维持血管张力、参与凝血、调节血管通透性等多种生理功能[1]。活性氮(reactive nitrogen species,RNS)介导的内皮细胞凋亡可导致内皮功能障碍的发生,可能是动脉粥样硬化、高血压、血管炎症等多种心血管疾病的早期事件之一[2]。内皮功能障碍的早期表现之一是线粒体功能和生物发生的失调。线粒体活性氧(mitochondrial reactive oxygen species,mtROS)的不平衡和广泛形成导致内皮功能障碍,这一过程反过来又加速了活性氧(reactive oxygen species,ROS)的产生[3]。最近的报告表明,ROS/RNS 介导的内皮细胞损伤与细胞线粒体损伤有关[2,4]。S-亚硝基谷胱甘肽(S-nitrosoglutathione,GSNO)是一种细胞RNS 损伤模型药物,被广泛用作一氧化氮供体,可引起线粒体的损伤,导致细胞凋亡[5]。目前研究表明,其主要通过介导RNS 的大量释放进而促进过量ROS 的出现致使细胞凋亡[6]。因此,保护线粒体有助于对抗细胞线粒体中的氧化损伤,维持氧化还原平衡有助于减弱受损进程。葫芦茶苷(tadehaginoside,THS)是葫芦茶活性成分之一[7]。近年来研究发现THS 在体内具有降血糖、抗炎等生物活性[8,9],但对内皮细胞损伤的保护作用研究较少,且作用机制有待阐明。本研究采用高浓度活性氮GSNO(0.5 mmol/L)诱导内皮细胞损伤模型,探讨THS 对内皮细胞线粒体损伤的保护作用,为中草药葫芦茶的进一步开发提供科学依据。但是THS 如何介导分子信号通路仍然很不清楚。本研究旨在探讨GSNO 对内皮细胞线粒体的损伤机制以及THS 对内皮细胞线粒体基因的潜在益处,为保护血管内皮、预防RNS 损伤提供一种潜在保护策略。
1 材料与方法
1.1 实验材料
EA.hy 926 细胞系购自中科院上海细胞库。所有细胞均在37 ℃,含5% CO2的饱和湿度培养箱中培养。GSNO(自提,纯度≥95%)、THS(自提,纯度≥95%)、DMEM 培养基(Gibco)、胎牛血清(FBS,Gibco)和青-链霉素(P/S,Gibco)。
1.2 仪器
荧光显微镜(Carl Zeiss AG);全波长酶标仪(Thermo);离心机(Thermo);超微量分光光度计(NanoPhotometer);多功能凝胶成像仪(GE);实时荧光定量PCR 仪(ABI)。
1.3 方法
1.3.1 Western blot 分析 将EA.hy 926 细胞接种于7 个60 mm 培养皿中,细胞聚合至60%,加入终浓度为0.5 mmol/L GSNO 的DMEM 完全培养基分别损伤0、1、2、4、8、12、24 h,配置RIPA 裂解液(PAPI:PMSF=100∶1),12 000 r/min 离心10 min,通过BCA 蛋白定量试剂盒(Thermo)进行蛋白定量,用SDS-PAGE 分离各组EA.hy 926 细胞蛋白质30 μ L,转移到PVDF 膜上。用5% 脱脂牛奶封闭后,将膜与4 ℃的一抗孵育过夜。样品洗涤后与二抗(1∶5 000)在37 ℃下孵育2 h。本实验所用抗体如下,anti- BAX(1∶1 000,Santa Cruz Biotechnology)、anti-Bcl-2(1∶1 000,Santa Cruz Biotechnology)、anti-β-actin(1∶5 000,碧云天),用ECL化学发光试剂盒(碧云天)在多功能成像仪中显影采集蛋白条带。
1.3.2 MTT 法检测THS 细胞毒性 将细胞以105/mL 细胞/孔的密度接种于96 孔板中。分别加入THS 终浓度分别为0、5、10、20、40、80、160 μmol/L的DMEM 完全培养基孵育12 h,每种浓度梯度设3个复孔。
每孔加入20 μL MTT 染料溶液(5 mg/mL),并在37 ℃下孵育4 h。去除上清液,并用150 μL DMSO 溶解底部紫色沉淀。摇床孵育15 min,在490 nm 波长处测定各孔吸光度值。
1.3.3 MTT 法检测THS 保护作用 分别加入THS 终浓度为0、5、10、20、40、80、160 μmol/L 的DMEM 完全培养基37 ℃孵育1 h,然后每孔加入终浓度为0.5 mmol/L GSNO 的DMEM 完全培养基在细胞培养箱孵育12 h,每种浓度梯度设3 个复孔。MTT 比色方法同1.3.2。
1.3.4 荧光定量PCR 将EA.hy 926 细胞以105/mL 的密度接种于6 孔板中,分组为Control(Con)组、0.5 mmol/L GSNO 组、0.5 mmol/L GSNO+40 μmol/L THS 组,GSNO 组加入0.5 mmol/L GSNO损伤12 h,0.5 mmol/L GSNO+40 μmol/L THS 组先预给药40 μmol/L THS 1 h 后加入0.5 mmol/L GSNO 损伤EA.hy 926 细胞12 h。采用RNA 提取试剂盒(Thermo)提取各组EA.hy 926 细胞总RNA。紫外分光光度计测定OD 260/OD 280,计算各组总RNA 浓度,参照逆转录试剂盒说明书(Thermo)合成cDNA。采用Real-time PCR 检测目的基因相对表达量,扩增条件为:95 ℃预变性3 min,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸60 s/kb、72 ℃彻底延伸5 min,循环35 次。在退火步骤中采集荧光信号,每组基因重复3 组。引物序列合成见表1(Sangon Biotech)。

表1 线粒体相关因子引物序列Tab 1 Primer sequence of mitochondrial related factors
1.3.5 JC1 染色检测线粒体ΔΨm 将EA.hy 926 细胞以105/mL 的密度接种于6 孔板中,分组为Control组、GSNO 组、THS 组,GSNO 组加入0.5 mmol/L GSNO 损伤12 h,THS 组预给药40 μmol/L THS 1 h 后加入0.5 mmol/L GSNO 损伤EA.hy 926 细胞12 h。按照JC-1 试剂盒(碧云天)流程完成对各组Ea.hy 926 细胞的处理工作,将Ea.hy 926 细胞置于荧光显微镜下观察拍照,红色为正常线粒体膜电位,绿色代表线粒体膜电位下降。
1.4 统计学处理
2 结果
2.1 GSNO 对EA.hy926 细胞凋亡的影响
图1 所示,Bcl-2 蛋白随GSNO 损伤时间的增长逐渐下调,Bax 蛋白表达趋势与Bcl-2 蛋白表达相反,说明GSNO 能引起内皮细胞凋亡,且随时间增加不断加重。但其是否通过损伤线粒体进而引起细胞凋亡仍需进一步研究。
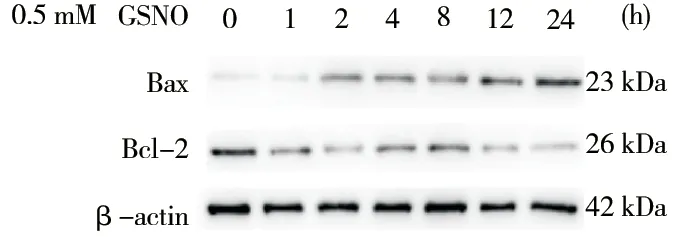
图1 GSNO 损伤不同时间对EA.hy 926 细胞凋亡蛋白表达的影响Fig 1 The effect of GSNO injury for different length of time on the expression of apoptosis protein in EA.hy 926 cells
2.2 THS 对内皮细胞的毒性研究
通过MTT 比色法检测各组细胞活性,80 μmol/L 与160 μmol/L THS 组细胞存活率分别为90.77% 和85.24%,与0 μmol/L THS 组相比略微下降,差异均无统计学意义(t=1.083,P=0.339 8;t=1.911,P=0.128 6)。5、10、20、40 μmol/L THS组细胞活性分别为102.04%、103.81%、106.03%和99.32%,与0 μmol/L THS 组相似,差异均无统计学意义,见图2。结果表明5~160 μmol/L 的THS 对细胞存活无影响,认为无细胞毒性。
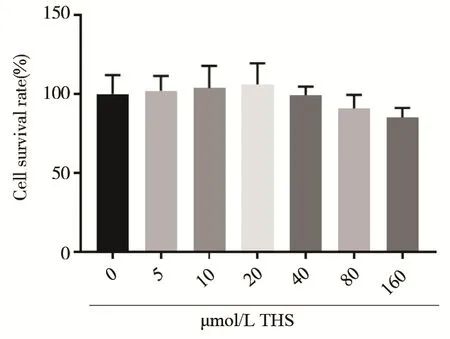
图2 不同浓度THS 对EA.hy926 细胞存活率的影响Fig 2 The effect of different concentrations of THS on the survival rate of EA.hy 926 cells
2.3 THS 的最佳药物保护浓度
不同浓度THS 预给药1 h 后加入高浓度GSNO 损伤内皮细胞,图3 MTT 结果表明,5 μmol/L THS 对细胞内皮损伤的保护能力较弱(74.38%,t=2.716,P=0.053 2),10~160 μmol/L THS 均有明显的保护作用(87.2%,t=9.782,P=0.000 6;101.6%,t=43.36,P<0.000 1;110.2%,t=13.6,P=0.000 2;88.8%,t=5.377,P=0.005 8;86.1%,t=12.95,P=0.000 2),其中40 μmol/L THS 对内皮细胞的保护能力最强(110.2%,t= 49.12,P<0.01),且细胞毒性实验表明40 μmol/L THS(99.32%,t=13.6,P<0.01)无细胞毒性,因此本实验选用40 μmol/LTHS 进行后续实验,研究其对GSNO 损伤内皮细胞线粒体的保护作用。
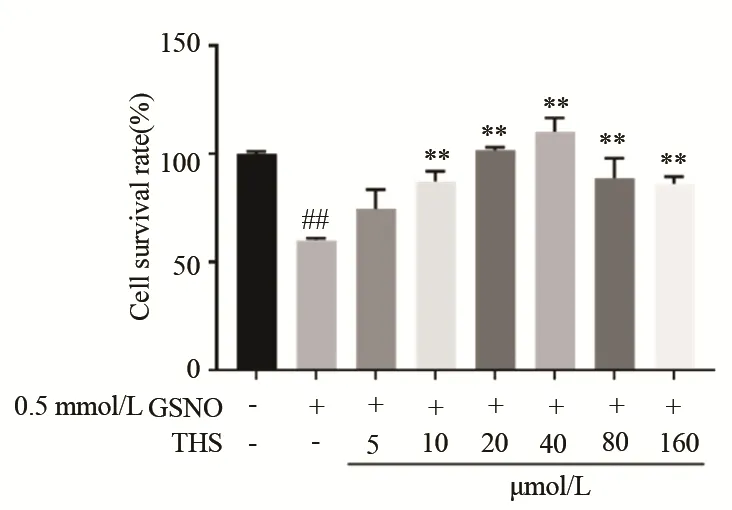
图3 THS 对GSNO 诱导的内皮细胞损伤后的保护作用Fig 3 The protective effect of THS on endothelial cell in⁃jury induced by GSNO
2.4 THS 对线粒体相关基因表达的影响
2.4.1ND-1与COX-1基因表达量 采用2-△△Ct法计算基因相对表达量,图4 结果显示:与Con 组比较,0.5 mmol/L GSNO 损伤内皮细胞后,ND-1的表达量显著增加(2-△△Ct=1.98,t=49.94,P<0.01),但COX-1基因表达量明显减少(2-△△Ct=0.80,t=10.37,P<0.05),说明GSNO 可能损伤内皮细胞线粒体基因。与0.5 mmol/L GSNO 组相比,THS 明显抑制了ND-1的表达(2-△△Ct=1.20,t=49.94,P<0.01),并增加了COX-1的表达(2-△△Ct=0.94,t=5.461,P<0.01)。
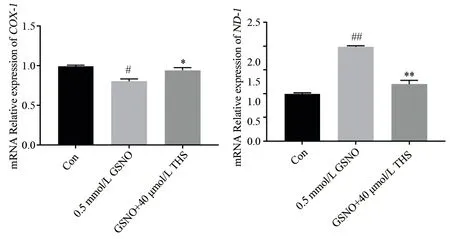
图4 THS 对GSNO 损伤EA.hy926 细胞12 h 后ND⁃1 和COX⁃1 基因表达的影响Fig 4 The effect of THS on the expression of ND-1 and COX-1 genes after GSNO injuried EA.hy926 cells for 12 hours
2.4.2IL-1β基因表达量 图5 所示,与Con 组相比,0.5 mmol/L GSNO 能显著上调IL-1β基因表达量(2-△△Ct=22.94,t=34.49,P<0.01)。与0.5 mmol/L GSNO 组比较,GSNO+40 μmol/L THS 显著抑制IL-1β基因表达(2-△△Ct=1.26,t=33.86,P<0.01),说明THS 有明显的抗炎作用。
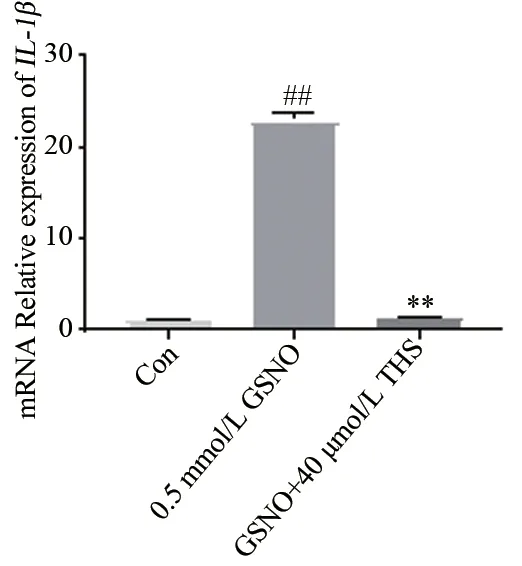
图5 THS 对GSNO 损伤EA.hy926 细胞12 h 后IL⁃1β 基因表达的影响Fig 5 The effect of THS on IL-1β gene expression after GSNO injury in EA.hy926 cells for 12 hours
2.5 JC-1 线粒体膜电位变化
图6 所示,通过JC-1 试剂盒(碧云天)检测线粒体膜电位,正常的EA.hy926 细胞(Control 组)线粒体呈红色荧光;当线粒体膜电位下降后,红色荧光强度显著降低,而细胞浆中的绿色荧光显著增强(GSNO 组)。THS 干预后明显恢复内皮细胞红色荧光,降低了绿色荧光,说明THS 具有保护线粒体膜电位的作用。
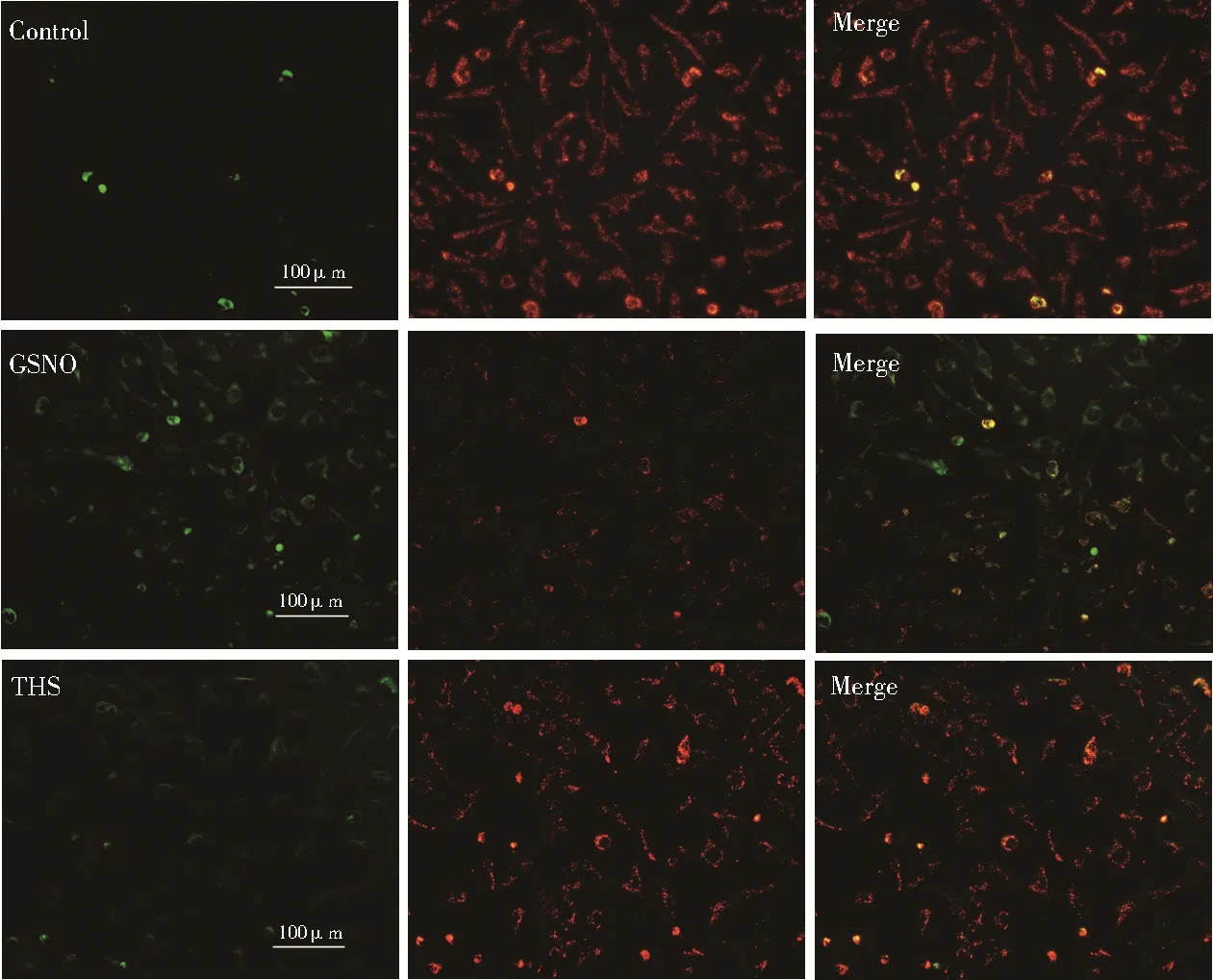
图6 THS 对GSNO 损伤EA.hy 926 细胞线粒体膜电位变化的影响Fig 6 The change of mitochondrial membrane potential of EA.hy 926 cells 12 h after THS damages GSNO
3 讨论
ROS 和RNS 是细胞具有重要意义的代谢物[10]。相对低浓度下,它们在调节机体生理过程方面发挥多方面作用,但高浓度一氧化氮会产生高N2O3和ONOO-水平[11]。据报道,过量的N2O3和ONOO-可形成大量NO2和OH-自由基,并可能加剧蛋白质、脂类和DNA 的不可逆亚硝化和亚硝酰化[12]。有文献报道了ROS 和RNS 的过量产生是内皮功能障碍的特征之一[13]。同时也有研究显示,大量的RNS 可能引起细胞供能系统线粒体损伤和ROS 的大量释放[14]。
线粒体对于维持多种生理功能至关重要,mtROS 在细胞信号转导和维持机体内稳态中发挥关键作用。然而,过多的mtROS 产生会导致细胞氧化应激状态,这是线粒体功能障碍的标志之一,同时可能直接或间接通过氧化应激诱发血管功能破坏[15]。本实验通过高浓度GSNO(0.5 mmol/L)对内皮细胞系EA.hy 926 模拟高浓度RNS 损伤细胞模型,通过Western Blot 法检测GSNO 损伤不同时间凋亡相关蛋白的变化,发现GSNO 对凋亡蛋白Bax 的损伤呈时间依赖性增高,抗凋亡蛋白Bcl-2 则显示出与之相反的趋势,可以看出GSNO 作用于内皮细胞后,细胞随时间凋亡逐渐加剧。此外,MTT法验证了5~160 μmol/L THS 没有明显的细胞毒性,同时预给药THS 1 h 后给予高浓度GSNO 损伤内皮细胞,发现10~160 μmol/L 的THS 均对损伤后细胞有明显的保护作用,其中40 μmol/L THS 保护作用最明显,因此,本实验选用40 μmol/L THS保护内皮细胞验证其对内皮细胞线粒体损伤的保护作用。
线粒体是细胞ROS 的重要来源,实验和疾病模型的数据表明,过量的mtROS 在调节血管功能障碍中发挥着关键作用[16]。有人提出,COX-1的损伤导致ROS 中间体促进线粒体氧化应激活化凋亡信号通路[17-19]。线粒体ND-1基因是参与线粒体氧化磷酸化电子传递链的第一步,通过氧化磷酸化产生ATP[20]。本实验结果发现高浓度GSNO 损伤后COX-1表达量明显下降,同时ND-1出现明显增多,说明高浓度GSNO 可能通过损伤线粒体DNA 促进内皮细胞凋亡。和0.5 mmol/L GSNO 组比较,THS 能明显抑制ND-1和IL-1β基因表达,上调COX-1基因表达。Liu 等[2]研究发现线粒体膜电位的降低可能协同增加线粒体ROS 的释放,同时促进GSNO 次级反应性介质过氧亚硝酸盐的形成,进而加重线粒体的损伤。本研究采用JC-1 法发现GSNO 能明显降低线粒体膜电位,而THS 一定程度上恢复了线粒体膜电位,说明THS 对内皮细胞线粒体损伤具有一定的保护作用。
研究表明,线粒体功能障碍可能加重内皮功能障碍,导致炎症被激活[16]。同时也有研究表明,Bcl-2 和BAX 的激活不仅能导致COX 的释放,还导致了线粒体DNA(mtDNA)的释放,进而调节炎症反应[21]。因此笔者还检测了IL-1β基因的表达,发现其在高浓度GSNO 损伤下大量生成,说明内皮细胞线粒体存在炎症反应。
综上所述,GSNO 可能通过引起线粒体功能障碍,进而引发炎症因子大量释放并促进内皮细胞凋亡。同时,THS 在一定程度上保护内皮细胞免受高浓度GSNO 的损伤,保护血管内皮细胞线粒体损伤在防治心血管疾病中具有重要意义,其机制可能与上调线粒体关键基因COX-1,下调ND-1基因有关。但研究发现其对IL-1β的抑制效果更显著,可能还通过其他途径抑制炎症因子保护内皮细胞的损伤作用,因此需要更进一步研究其潜在保护机制。
作者贡献度说明:
黄巧凡,吴昊霖:参与实验,撰写论文;徐怡倩:参与实验,整理数据;樊好飞:指导实验,参与实验;方星悦:参与实验,购买耗材;王爱萍:参与实验,整理数据;虞道锐:参与实验,提供实验器材;孟庆雯:参与实验,整理数据;刘启兵:指导实验,参与实验,修改论文。

