右归饮对糖皮质激素诱导的骨髓间充质干细胞凋亡的调节作用
陈 浩,袁 鹏,孙 浩,高飞飞,陈 阳,刘 锌,杜 斌
(1.南京中医药大学附属医院,江苏南京 210012;2.江苏省中医院骨伤科,江苏南京 210029)
激素性股骨头坏死(glucoticorticoid-associated osteonecrosis of the femoral head,GA-ONFH)是一种因长期或大剂量应用激素导致股骨头不可逆塌陷、髋关节功能障碍的疾病[1],具有呈渐进性发展、预后差、致残率高[2,3]的临床特点。GA-ONFH 的确切发病机制尚无定论,最新研究[4]表明糖皮质激素(glucocorticoids,GCs)通过诱导骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的凋亡从而降低其增殖,引起细胞的成骨分化能力减弱、成脂分化增强,进而导致骨修复不足。这也是GA-ONFH 的发生发展的重要机制之一。因此,恢复BMSCs 成骨和成脂分化之间的平衡对GA-ONFH 的治疗至关重要。
中医理论认为,肾主骨生髓,肾中所含先天之精是人体生命活动的物质基础,对骨骼的强健起主宰作用。长期或大剂量使用GCs 伤及肾精,致五脏六腑失养、气血生化乏源,血行推动无力而成瘀,髓海瘀滞,髓死骨枯,发为本病。此类患者的肾上腺皮质激素及甲状腺激素轴被抑制,因此常伴有畏寒、无力、皮肤苍白、食欲减退等肾阳虚证的临床表现[5]。右归饮以“阴中求阳”立法,温补命门之火,常用于肾阳亏虚之证。多项研究[6]表明,右归饮能通过调节骨代谢发挥对GA-ONFH 的治疗作用。本实验通过对大鼠BMSCs 进行体外实验,观察右归饮含药血清对BMSCs 凋亡相关蛋白、成骨指标的影响,并对靶点蛋白进行分子对接以明确右归饮的作用机制,以期发现该方治疗GA-ONFH 的现代医学依据。
1 材料与方法
1.1 实验动物
清洁级SD 大鼠20 只,体质量200~250 g,6 周龄,购自南京浦口区莱芙养殖场[动物生产许可证号:SCXK(苏)2019-0005],饲养于南京中医药大学动物实验中心。该研究经过南京中医药大学附属医院动物伦理委员会批准。
1.2 药品及实验试剂
右归饮药物组成:熟地黄30 g,山药、肉桂、姜杜仲、枸杞子、炙甘草各6 g,山茱萸、制附子各3 g,中药饮片由江苏省中医院中药房提供;抗兔Bcl-2(Bcl-2 Rabbit Polyclonal antibody;26593-1-AP)、抗兔Bcl-2 相关X 蛋白(BAX Mouse Monoclonal antibody;60267-1-lg)购自Protientech 公司;抗兔半胱氨酸蛋白酶3[Caspase-3(D3R6Y) Rabbit mAb;14220]购自CST 公司;胎牛血清(10091148)、青霉素-链霉素(15140122)购自赛默飞世尔科技有限公司;SD 大鼠骨髓间充质干细胞成脂(RASMX-90031)、成骨(RASMX-90021)诱导分化培养基(赛业生物科技集团);苏木精、伊红(四季青公司);大鼠骨碱性磷酸酶ELISA 试剂盒(上海臻科生物科技有限公司);茜素红、油红O 染液、噻唑蓝、二甲基亚砜、Percoll(南京碧云天生物有限公司);P53、LC3Ⅱ抗体、辣根过氧化物酶(Cyagen 公司)。
1.3 主要仪器
倒置相差显微镜(上海光学仪器厂);Image-pro plus 6.0(IPP);恒温恒湿孵育箱(Heraeus 公司);蛋白交互仪(Beckman 公司);Mini Electrophoresis System 电泳仪(BIO-RAD 公司);转膜及成像系统(Beckman 公司);激光共聚焦显微镜(ZEISS公司)。
1.4 实验方法
1.4.1 含药血清的制备 按照随机数字表法将大鼠平均分为2 组:生理盐水组、右归饮组。右归饮按照灌胃剂量公式[7]:200(mL)÷人类平均体质量(kg)×大鼠实际体质量(kg)×倍增系数,按人类平均体质量70 kg,倍增系数为1 换算后进行灌胃,生理盐水组给予每日8 mL/kg 生理盐水灌胃,均为1次/d。连续灌胃2 周,末次灌胃1 h 后脱脊处死,腹主动脉取血,室温下静置2 h,离心取上层血清,灭活、过滤、分装,-80 ℃保存。
1.4.2 细胞提取与分组 大鼠脊椎脱臼,无菌条件下分离大鼠双侧股骨和胫骨,剪开干骺端后用培养基反复冲洗髓腔,细胞过滤器过滤,1 000 r/min 离心8 min,弃上清。加入完全培养基(15% 胎牛血清、100 U/mL 青霉素+100 μg/mL 链霉素、1 mmol/L 的L-谷氨酰胺)吹成细胞悬液接种于培养瓶内,2 d 后换液,倒置显微镜下观察。当细胞融合达70%~80%时用0.25%的胰蛋白酶消化细胞传代,取生长良好的第2 代BMSCs,以4.0×105/mL 培养液种于25 cm2培养瓶中,根据文献报道进行实验分组及给药[8-10]:空白组:10%空白血清;模型组:10% 空白血清+地塞米松5×10-5mol/mL;中药组:10%含药血清+地塞米松5×10-5mol/mL;对照组:10%含药血清。
1.4.3 细胞增殖情况检测 采用细胞计数试剂盒(CCK-8)检测各组细胞增殖变化。将BMSCs 接种于4 块96 孔板中,1 d 后细胞贴壁取出一块检测,之后以2 d 为1 个周期,每天取出一块96 孔板,吸取培养基,每孔加入10%的CCK8 溶液100 μL,38 ℃孵育2 h,酶标仪450 nm 检测吸光度,计算平均值。绘制细胞的生长曲线。
1.4.4 成骨分化指标检测 使用成骨诱导培养基对各组BMSCs 进行成骨诱导培养,2 d 后使用骨ALP ELISA 试剂盒进行检测,设置标准孔和样本孔,标准品孔各加不同浓度的标准品50 μL;样本孔加各组培养基10 μL,再加样本稀释液40 μL。加入辣根过氧化物酶100 μL,封膜,37 ℃孵育1 h,弃去液体,拍干,洗涤5 次,加入底物A、B 各50 μL,37 ℃避光孵育15 min,加入终止液50 μL,ELISA 监测仪检测各孔450 nm 波长的吸光度值,根据标准品计量。21 d 后,以茜素红染色30 min,200 倍镜下随机选取3 个视野,比较各组红染钙矿化结节数量。
1.4.5 Western blot 检测BMSCs 凋亡相关蛋白表达 细胞分组干预后,待细胞融合达90%后进行蛋白提取,吸出培养基,PBS 冲洗3 遍,并完全吸干,每孔加入100 μL 细胞裂解液(1% 苯甲基磺酰氟和10%磷酸酶蛋白酶抑制剂)。15 min 后,用刮板将细胞刮下,超声裂解25 s,重复3 次。细胞充分裂解后12 000 ×g在4 ℃离心20 min 后取上清,BAC 法测蛋白浓度。加入6×上样缓冲液混匀后煮沸。电泳板安装好后制作凝胶,并在上面的样品孔中加样。然后在恒压下进行电泳。电泳后,用聚亚乙烯基二氟化物膜0 ℃恒流转膜。5%的脱脂奶粉室温下封闭1 h。之后按条带剪开,一抗caspase 3(1∶1 000)、Bcl-2(1∶1 000)和Bax(1∶5 000)在4 ℃下孵化过夜。次日,用TBST 冲洗3次,再用二抗在室温下孵育1 h,并再次清洗3次。最后,添加显影液,对条带进行可视化。然后对显影带进行灰度扫描,并对数据进行分析。β-actin作为内参,Image J软件对印迹进行定量分析。
1.4.6 分子对接 根据既往右归饮质谱结果[11],对量丰成分进行通过Pubchem(https://pubchem.ncbi.nlm.nih.gov/)数据库检索,获得3D 化合物结构,运用 Swisstarget(http://www. swisstargetprediction.ch/)数据库预测其药代动力学(ADME),以胃肠吸收率(GI absorption)为High 和类药性(Drug likeness)>0.18 为筛选标准。通过Uniprot 数据库(https://www.uniprot.org/)和RCSB PDB 数据库(http://www.rcsb.org/)查找Bcl-2、Bax、caspase 3的PDB ID,与筛选后的量丰成分前2 位进行对接,根据结合能评价靶点与活性化合物的结合强度与活性。
1.5 统计学处理
2 结果
2.1 BMSCs 形态学观察
48 h 换液后可见BMSCs 贴壁生长,呈纺锤形、椭圆形分布。培养3~7 d 后,细胞形态均一,呈长梭形,少量呈三角形集落生长(图1)。
图1 BMSCs 镜下观察(×200)Fig 1 BMSCs under microscope(×200)
2.2 细胞增殖结果
对比各组不同时间点的吸光度(A450)比值,模型组较空白组均降低,差异有统计学意义(P<0.05);而中药组、对照组较模型组均提高,差异有统计学意义(P<0.05),对照组与空白组比较差异无统计学意义(P>0.05),见表1。
表1 各组BMSCs 生长情况(±s)Tab 1 BMSCs growth in each group(±s)
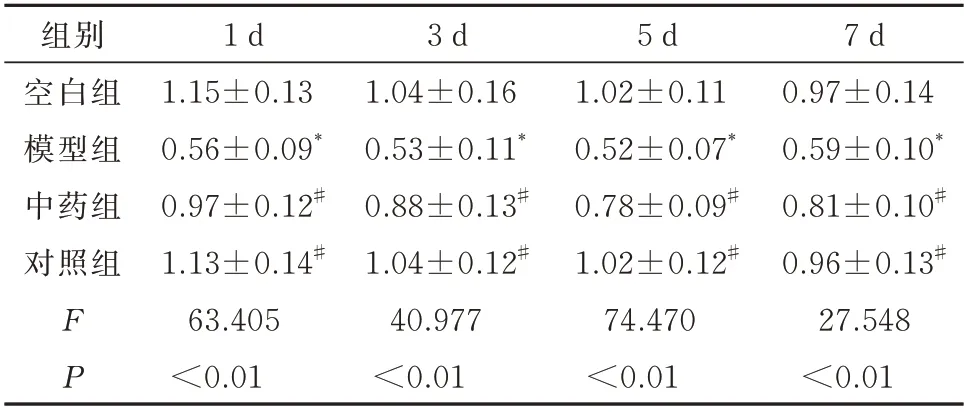
表1 各组BMSCs 生长情况(±s)Tab 1 BMSCs growth in each group(±s)
注:生长情况以各组吸光度(A450)比值表示;与空白组比较,*P<0.05;与模型组比较,#P<0.05。
7 d 0.97±0.14 0.59±0.10*0.81±0.10#0.96±0.13#27.548<0.01组别空白组模型组中药组对照组FP 1 d 1.15±0.13 0.56±0.09*0.97±0.12#1.13±0.14#63.405<0.01 3 d 1.04±0.16 0.53±0.11*0.88±0.13#1.04±0.12#40.977<0.01 5 d 1.02±0.11 0.52±0.07*0.78±0.09#1.02±0.12#74.470<0.01
2.3 成骨诱导结果
各组BMSCs 成骨诱导2 周后,模型组ALP水平(73.96±3.02)显著低于空白组(132.32±4.01)和对照组(131.74±3.18),差异有统计学意义(P<0.05);相较于模型组,中药组ALP 水平显著提高(108.67±4.78),差异有统计学意义(P<0.05),对照组与空白组比较差异无统计学意义(P>0.05)。各组BMSCs 成骨诱导后进行茜素红染色标定钙结节。模型组与各组相比,红染钙结节数量均显著降低;对照组与空白组无显著差异,两组均高于模型组与中药组,见图2。

图2 各组茜素红染色情况(×200)Fig 2 Alizarin red staining in each group(×200)
2.4 BMSCs 凋亡蛋白表达的影响
与空白组相比,模型组促凋亡蛋白Bax 和cleaved caspase 3 的表达水平显著升高,差异有统计学意义(P<0.01),而抗凋亡蛋白Bcl-2 的表达水平则显著降低,差异有统计学意义(P<0.01);中药组的Bax 和cleaved caspase 3 的表达水平较模型组显著降低,Bcl-2 的表达水平显著升高,差异均有统计学意义(P<0.01)。对照组Bcl-2、Bax 和cleaved caspase 3 的表达水平与空白组相比无明显变化,见图3 及表2。
表2 各组蛋白印迹结果(±s)Tab 2 Western blot results in each group(±s)
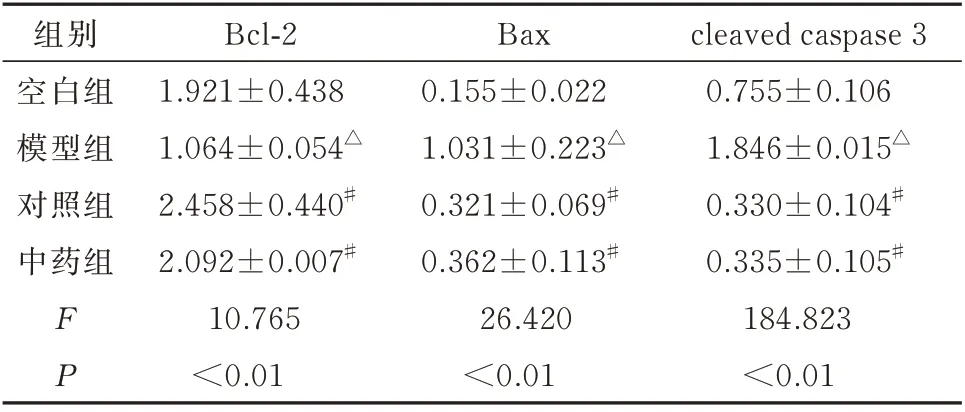
表2 各组蛋白印迹结果(±s)Tab 2 Western blot results in each group(±s)
注:蛋白印迹定量结果以各组灰度值与actin 的比值表示;与空白组比较,△P<0.01;与模型组比较,#P<0.01。
cleaved caspase 3 0.755±0.106 1.846±0.015△0.330±0.104#0.335±0.105#184.823<0.01组别空白组模型组对照组中药组FP Bcl-2 1.921±0.438 1.064±0.054△2.458±0.440#2.092±0.007#10.765<0.01 Bax 0.155±0.022 1.031±0.223△0.321±0.069#0.362±0.113#26.420<0.01
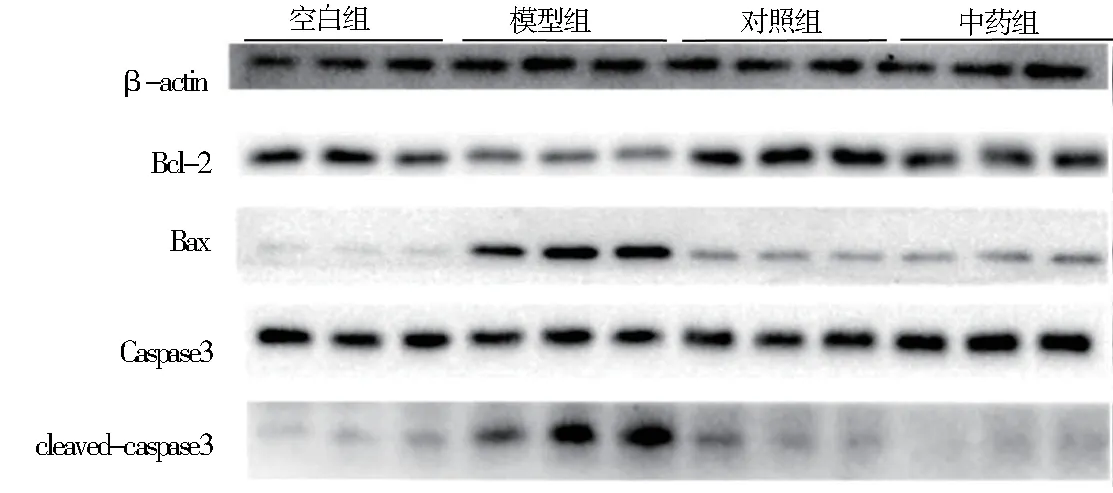
图3 各组蛋白表达Fig 3 The expression of proteins in each group
2.5 分子对接结果
对量丰成分进行筛选后结果(表3),选取峰值前2 为epicatechin 5,7,3'-trimethyl ether、delphinin与受体蛋白Bcl-2(PDB 编码:5vau)、Bax(PDB 编码:2k7w)、Caspase 3(PDB 编码:5i9B)进行分子对接,结果见图4、5,能量越低,分子亲和度越好,见表4。

表3 筛选后成分表Tab 3 List of components after screening
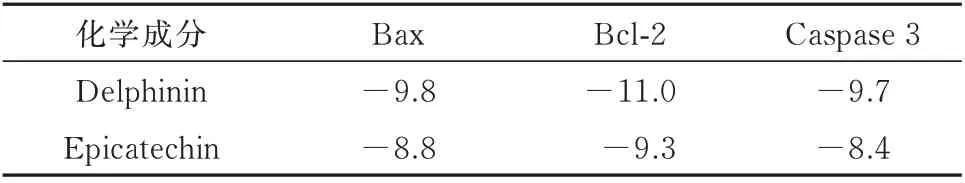
表4 分子对接结合能(kcal/mol)Tab 4 Molecular docking binding energy(kcal/mol)
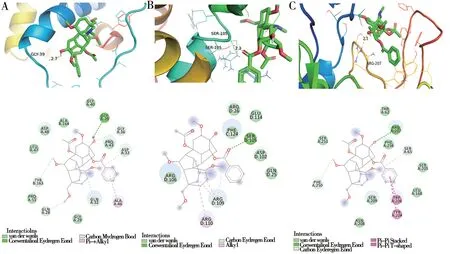
图4 Delphinin 与靶点的对接模型Fig 4 Docking model of delphinin and target

图5 Epicatechin 5,7,3'-trimethyl ether 与靶点的对接模型Fig 5 Docking model of epicatechin 5,7,3'-trimethyl ether and target
3 讨论
凋亡是指机体为清除衰老或有害细胞、维护内环境稳定,通过线粒体凋亡途径和死亡受体(Fas-FasL)介导途径,引发有核细胞程序性死亡的过程[12]。
作为细胞死亡通路的整合元件,线粒体在细胞凋亡过程中扮演重要角色,由线粒体介导的细胞凋亡途径被称为caspase-9 途径。线粒体渗透性转变孔道复合物(permeability transition pore composite,PTPC)是一种由外膜蛋白电压依从性阴离子通道(voltage-dependent anion channel,VDAC)、腺嘌呤核苷酸易位体(adenine nucleotide translocase,ANT)、胞溶质蛋白D(cyclin D)等组件构成[13]的大分子、多蛋白复合体,当机体出现衰老或有害细胞时,线粒体内膜首先出现渗透性改变(permeability transition,PT),基质、胞浆内离子藉由PTPC 的开放得以流动,继而引发跨膜电位的下降及线粒体外膜的去极化。在dATP/ATP 的协助下,释放进入胞浆的细胞色素C 与Apaf-1 结合、寡聚化,并募集、活化和释放caspase-9 前体,启动caspase 级联反应,激活caspase-3、caspase-6、caspase-7 等下游分子,最终引起细胞凋亡[14]。上述途径也是Bcl-2 蛋白家族调控细胞凋亡的主要途径。当PTPC 开放时,Bcl-2能够在线粒体外膜形成离子通道,平衡其介导的跨膜离子流动,调节线粒体跨膜电位,阻止PTPC 的进一步开放,继而阻断细胞凋亡途径。此外,Bcl-2 还能提高线粒体膜的稳定性,阻止促凋亡蛋白的释放,对细胞功能发挥重要的保护作用[15]。
基于“肾主骨生髓”理论,右归饮被广泛应用于肾阳不足导致的骨伤科疾病。全方取“阴中求阳”之义,在肉桂、附子温肾助阳,补命门之火的同时,以山药、山萸肉、熟地益肾填精滋阴,使阳得阴助而生化无穷;辅以杜仲、枸杞补益肝肾,甘草调和诸药,共奏补肾助阳、壮骨生髓之功。多项研究也证实了右归饮具有调节脂质代谢、平衡成骨细胞与破骨细胞的形成分化的作用,从而发挥防治GA-ONFH 的功效。范连霞等[16]使用右归饮含药血清体外干预成骨细胞,检测ERK、β-catenin 和Runx-2 的蛋白表达,发现右归饮能通过ERK、Wnt 信号通路显著增加成骨细胞活性;吴承亮等[17]发现右归饮可抑制股骨头髓腔内骨髓脂肪化,可能通过拮抗GCs 诱导骨髓基质细胞成脂分化,促进GA-ONFH 的成骨修复。
Bcl-2 和Bax 的失衡是GCs 诱导BMSCs 凋亡的重要原因[18]。促凋亡蛋白Bax 能与ANT、VDAC 的结合,促进PTPC 的开放[13],而Bcl-2 可通过与Bax竞争性结合ANT,或直接阻止Bax 与ANT、VDAC的结合来发挥其抗凋亡效应。本研究发现,中药组的Bax、cleaved caspase 3 蛋白表达降低,Bcl-2 表达增加,右归饮含药血清明显促进了经GCs 诱导的BMSCs 的增殖,对GCs 诱导的细胞凋亡起到了保护作用。此外,相较于模型组,中药组BMSCs 成骨发育潜力更强。分子对接结果表明,右归饮主要通过epicatechin 5,7,3'-trimethyl ether、delphinin 等调控BMSCs 凋亡,促进成骨。
综上所述,右归饮可能通过调控GCs 诱导的BMSCs 的凋亡,发挥对GA-ONFH 的治疗作用。但是本次实验仅进行了成骨诱导,未行成脂、成软骨诱导,缺少对间充质干细胞分化潜力的全面研究;对于凋亡,仅进行了蛋白表达的测定,未进行流式细胞凋亡检测等其他实验验证,并且其相关上游通路有待进一步探究。
作者贡献度说明:
陈浩:进行实验操作及数据分析,论文成文与修改;杜斌:课题项目的总策划人与总负责人,保障课题成功进行,论文修改者;刘锌:协助通讯作者实施课题,协助第一作者进行动物饲养及实验操作,协助数据处理;袁鹏:协助动物饲养及实验操作,协助数据分析;孙浩:协助数据分析及图表制作;高飞飞:协助实验操作、数据分析;陈阳:协助实验操作、数据分析。

