黄芪多糖对MC3T3-E1细胞增殖及成骨分化的影响
胡俊 杨盼盼 袁忠 谈荣珍 张楚焌 张斌 沈云峰
1.南昌市洪都中医院骨伤七科,江西 南昌 330008 2.南昌大学第二附属医院内分泌代谢科,江西 南昌 330006
骨质疏松症(osteoporosis,OP)为绝经后妇女常见的代谢性骨骼疾病,以骨量减少、骨折风险增加为主要特征,因此严重影响患者的健康及生活治疗[1]。据我国最新的流行病学调查,在50岁以上的人群中有19.2 %的人患有骨质疏松症,而在65岁以上的人群中,此患病率更是高达32.0 %[2]。作为抗骨质疏松常用手段,双膦酸盐类药物常伴随不良反应,如增加患乳腺癌风险或下颌坏死等[3-4]。因此,寻找更加安全可靠的治疗药物吸引了越来越多的学者关注,而中药因其简、便、验、廉的特性,在世界上受到越来越多的关注[5],其优异疗效也被越来越多的研究所证实[6]。
黄芪中主要含有皂苷、黄酮、多糖类等活性成分,除优异的抗动脉硬化、抗细胞衰老作用之外,其提高性激素水平、调控骨代谢的作用也被逐渐被人们熟知[7]。研究发现黄芪水提液可有效促进骨质疏松大鼠的骨形成,同时抑制骨量丢失[8]。而现阶段,关于黄芪多糖(astragalus polysaccharides,AP)对成骨细胞增殖、分化的潜在作用机制尚无深入的认识。因此本研究将分析探讨不同浓度AP对MC3T3-E1细胞增殖及成骨分化的影响及可能的作用机制。
1 材料和方法
1.1 材料
1.1.1成骨细胞:MC3T3-E1细胞购自于中国科学院上海细胞所细胞库,第3代细胞用于后续实验。
1.1.2材料与试剂 :黄芪多糖(纯度>98 %)从成都德思特生物技术有限公司购买;α-MEM培养基、胎牛血清、青链霉素、0.25 %胰蛋白酶从美国Gibco公司购买;β甘油磷酸钠、抗坏血酸、地塞米松、MTT试剂盒购买于美国Sigma公司;RIPA裂解液、ALP染色试剂盒、免疫荧光染色试剂盒、ECL曝光液从上海碧云天生物技术有限公司购买;茜素红染色液从经赛业生物科技有限公司购买;RNA提取试剂盒、反转录试剂盒购买于日本Takara公司;Runx2、β-catenin、Osteocalcin抗体购自Santa Cruz 公司;β-actin、鼠二抗、兔二抗购自北京全氏金生物技术有限公司。全自动酶标仪购自美国Thermo Fisher公司;电泳仪、电转仪购自美国Bio-Rad 公司;倒置相差显微镜购自德国Leica公司;实时荧光定量PCR仪购自美国Bio-Rad公司;BX51荧光显微镜购自日本Olympus公司。
1.2 方法
1.2.1细胞培养:将含有10 %胎牛血清、1 %青链霉素的α-MEM的基础培养基配制后,用于后续的MC3T3-E1细胞系培养。细胞板均放置于37 ℃、5 % CO2的细胞培养箱。在细胞生长、融合至80 %~90 %时,使用胰蛋白酶消化及分瓶,用于后续实验。
1.2.2MTT法检测细胞增殖:以每孔2 000个MC3T3-E1细胞接种于96孔板中,置于培养箱中生长24 h后,加入不同浓度的AP(0、5、10 μmol/L)进行干预,每组设3个复孔。使用MTT法在干预后的1、3、5、7 d检测细胞活力。在每培养孔加入10 μL MTT试剂后,放置培养箱中避光孵育4 h,然后在酶标仪(570 nm波长)处测定每孔的吸光值。
1.2.3ALP及茜素红染色:10-8mol/L 地塞米松、10 mmol/L β甘油磷酸钠和50 μmol/L 抗坏血酸配制成成骨诱导液。MC3T3-E1细胞以5×104/孔的密度水平铺板于24孔板中,24 h细胞贴壁后培养于成骨诱导液中。细胞按不同浓度的AP(0、5、10 μmol/L)干预而分组,每3天换液1次,14 d后进行ALP及茜素红染色。ALP染色过程如下:弃置培养基后,细胞在裂解液作用下裂解,后续染色流程根据ALP试剂盒说明书实施。茜素红染色过程如下:弃置旧培养液后,细胞经PBS反复清洗3次,然后加入4 %多聚甲醛固定细胞30 min,然后PBS冲洗固定液3遍后,取300 μL茜素红染液于每孔细胞,室温下静置10 min后PBS冲洗染液3次,最后使用显微镜观察每组染色情况。
1.2.4Real-time PCR检测相关mRNA:以1×108/孔的密度种植于6孔板中,干预措施同1.2.3。细胞干预14 d后,根据RNA提取试剂盒说明书实施细胞总RNA提取,使用无RNA酶水溶解后测定浓度。扩增cDNA反应条件为:95 ℃预变性10 min,95 ℃变性20 s,58 ℃退火30 s,72 ℃延伸45 s,一共40个循环。然后从PCR仪中获取Ct值采用2-△△Ct 法,以GAPDH作为内参计算Runt相关转录因子2(Runx2)、β-连环蛋白(β-catenin)、骨钙素(osteocalcin)、I型胶原蛋白(collagen I)的mRNA表达量,引物序列见表1。

表1 引物序列Table 1 Primer sequence
1.2.5Western Blot检测相关蛋白:以2×105/孔的密度种植于6孔板中,分组、干预方式同上,14 d后使用RIPA裂解细胞提取总蛋白,配置好10 %SDS-PAGE分离胶与5 %浓缩胶后,每组取20 μL样本进行后续的电泳、转膜、封闭步骤。Runx2(1∶1 000)、β-catenin(1∶1 000)、osteocalcin(1∶500)、β-actin(1∶1 000)一抗4 ℃孵育过夜;室温下孵育二抗(1∶2 000)2 h,TBST洗涤后ECL曝光。条带表达情况使用Image J 软件分析。
1.2.6免疫荧光测定β-catenin荧光强度:MC3T3-E1细胞以2×104/片的密度铺于爬片,接受AP干预作用14 d后,在室温下使用4 %的多聚甲醛室温固定MC3T3-E115 min,接着用0.1 % Triton X破膜20 min。使用血清封闭20 min后,每孔加入β-catenin一抗(1∶200)放置于4 ℃孵育过夜;第二天使用荧光二抗(1∶150)室温孵育2 h,然后加入DAPI避光孵育2 min,在暗光条件下使用荧光显微镜拍照。
1.3 统计学处理
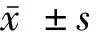
2 结果
2.1 不同AP对MC3T3-E1增殖影响
MC3T3-E1细胞增殖随着AP干预时间增加呈逐步上升趋势,并与AP浓度呈正相关关系。与其他浓度比较,10 μmol/L AP在各时间点促细胞增殖效果更加明显,且差异具有统计学意义;而干预1、5 d后5 μmol/L的AP促增殖效果与对照组对比的差异同样有统计学意义。见图1。
注:与0 μmol/L组同期对比,#*P<0.05。图1 不同浓度AP对MC3T3-E1增殖影响Fig.1 Effects of AP at different concentrations on the proliferation of MC3T3-E1
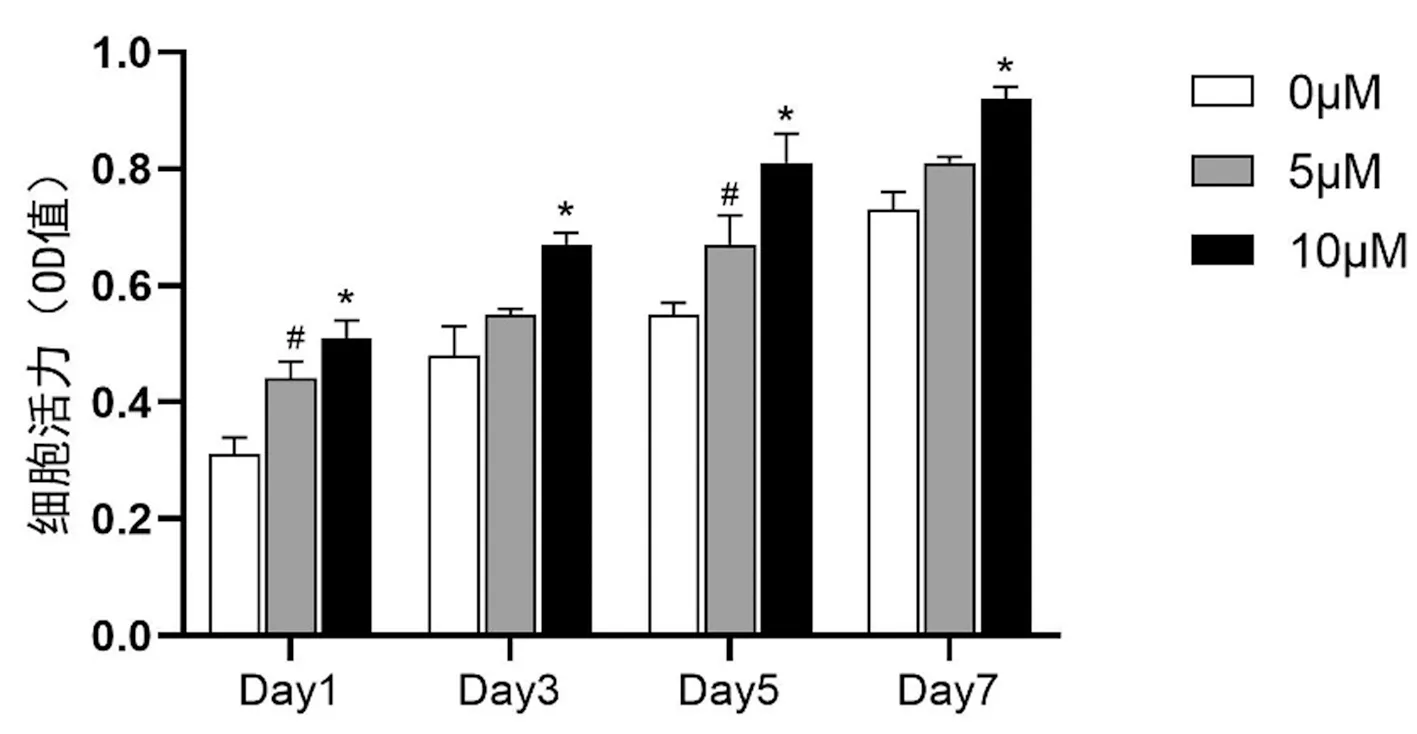
2.2 不同浓度AP的促成骨分化效果观察
ALP染色结果显示AP干预14 d后,细胞的ALP染色阳性率明显高于对照组(0 μmol/L),且与浓度呈正相关关系,10 μmol/L AP的促成骨作用更佳。ARS染色结果与ALP染色结果相符合,10 μmol/L AP可有效提高染色阳性率。见图2。
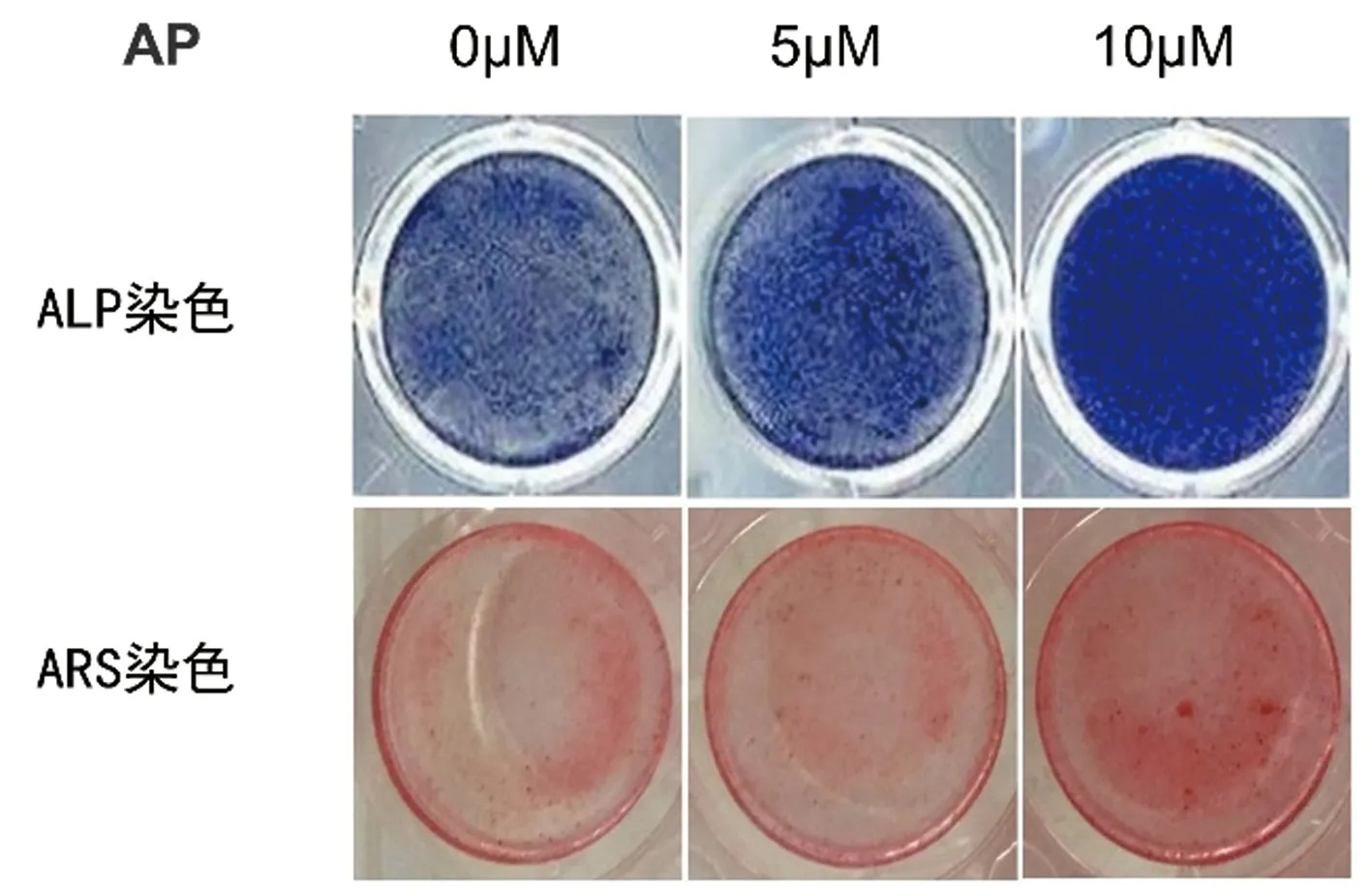
图2 干预14 d后不同浓度AP的促成骨作用观察Fig.2 Effects of AP at different concentrations on the osteogenic differentiation of MC3T3-E1
2.3 不同浓度AP对成骨相关mRNA表达影响
不同浓度AP干预14 d后,与对照组相比,5 μmol/L AP可有效提高Runx2、osteocalcin、collagen I mRNA的表达(P<0.05);而10 μmol/L AP促进上述mRNA表达效果更加明显(P<0.01),同时还可以促进β-catenin mRNA表达 (P<0.01)。见图3。

图3 干预14 d后不同浓度AP对成骨分化标志物的调控作用观察Fig.3 Effects of AP at different concentrations on osteogenic differentiation-related mRNA of MC3T3-E1 cells
2.4 不同浓度AP对成骨相关蛋白表达影响
结果显示5 μmol/L AP的促进β-catenin、Osteocalcin、Runx2蛋白表达作用与对照组比较,差异无明显统计学意义。而10 μmol/L AP则可促进β-catenin(1.024±0.056)、osteocalcin(1.498±0.025)、Runx2(0.873±0.038)蛋白的表达,差异具有统计学差异(P<0.05)。见图4。
图4 干预14 d后不同浓度AP对成骨分化相关蛋白的调控作用观察Fig.4 Effects of AP at different concentrations on osteogenic differentiation-related proteins of MC3T3-E1 cells
2.5 10 μmol/L AP对β-catenin蛋白核移位的影响
与对照组(0 μmol/L AP)比较,10 μmol/L AP干预细胞14 d后,可有效促进β-catenin蛋白在细胞核内的表达。见图5。

图5 10 μmol/L AP对β-catenin蛋白核移位的影响(100×)Fig.5 Effects of 10μM AP on the nuclear translocation of β-catenin protein(100×)
3 讨论
骨质疏松症可因年龄增长、药物使用、体内激素水平改变等因素而诱发,背后机制与骨形成与骨吸收之间的动态平衡被打破有关[9-10]。近年研究发现,中医药治疗可有效改善骨质疏松引起的骨量丢失,其治疗机制可能与上调骨形成、下调骨吸收过程有关[6,11]。Shen等[12]经体内外实验研究发现虎杖苷可激活BMP2-Wnt/β-catenin信号通路,以及诱导TAZ表达以调控骨髓间充质干细胞向成骨细胞分化,因此有抑制骨质疏松小鼠骨量丢失的作用。Ornstrup等[13-14]通过给予患者口服白藜芦醇治疗16周后,发现治疗组患者的腰椎骨密度、血ALP水平均明显提高,其中机制与可能与上调了促骨形成的SIRT1蛋白有关。
黄芪虽为常用的补气中药,但其抗骨质疏松作用也逐渐受到关注、应用,并取得了令人满意的疗效[15]。成鹏等[16]发现在骨质疏松大鼠中,黄芪甲苷可明显提高β-catenin以及Wnt2蛋白的表达量,并下调FoxO3a蛋白的表达,抑制氧化应激引起的骨量丢失。黄芪注射液静滴、中药黄芪口服可有效提高患者骨密度、改善骨代谢[17-18]。高糖环境对MC3T3-E1细胞的增殖以及成骨分化有负向调控作用,但AP逆转高糖环境的不利影响[19]。
本研究结果表明,早期成骨标志物(ALP、Runx2)[20],以及钙沉积标志物(Collagen I)[21]均可被AP上调表达,并与AP浓度呈正相关关系,该部分结果与ALP、茜素红染色结果一致,因此表明AP可以促进 MC3T3-E1的成骨分化和矿化。Western blot实验结果也从蛋白表达层面验证了这一趋势。此外,我们还发现AP明显促进了β-catenin蛋白的表达以及核易位。Wnt以及BMP均为调控细胞成骨分化的重要通路信号,前者可诱导间充质干细胞向成骨祖细胞分化[22],而后者则可进一步促进祖细胞向成骨细胞分化[23]。而上述两条成骨分化关键通路对β-catenin基因的转录表达,以及其蛋白翻译、核易位过程均有促进作用,最终下游的促细胞增殖、成骨的相关基因的转录水平因此明显增高[24]。所以,我们认为AP促进MC3T3-E1细胞增殖、成骨分化,可能与这些机制有关。
综上所述,Wnt/β-catenin信号通路激活可能为AP促MC3T3-E1细胞增殖以及成骨分化的作用机制之一,但是本研究目前仅停留在细胞水平,缺少动物实验结果支持,因此研究结果存在一定的局限性,后续将会完善体内相关实验。

