高剂量糖皮质激素对成年雄性小鼠PDGF-BB分泌及H型血管生长的作用研究
李素丽 詹先琴 张艳君 马艳荣 王英 王燕
新疆维吾尔自治区人民医院,新疆 乌鲁木齐 830001
骨质疏松症(osteoporosis,OP)是一种以骨量降低、骨脆性增加、骨强度下降、骨折风险性增加为特征的全身性、代谢性骨病[1]。在继发性骨质疏松症中,糖皮质激素性骨质疏松症(glucocorticoid induced osteoporosis,GIOP)是临床上常见的继发性骨质疏松症之一,多伴有骨质疏松或并发骨折。大量研究表明,超生理量的类固醇激素及其类似物对骨骼系统的发育、生长与细胞代谢有明显不利影响。欧洲绝经后骨质疏松妇女指南已经明确将每日使用强的松龙5 mg、时间超过3个月或更长作为骨质疏松症的临床危险因素[2]。
目前GIOP治疗的药物多局限在双膦酸盐、性激素替代及重组甲状旁腺素、抗RANKL单克隆抗体的治疗上[2-4],对于糖皮质激素性骨质疏松症的病因还不是很清楚。本研究将探讨长期高剂量糖皮质激素对成年雄性小鼠破骨前体细胞PDGF-BB分泌的影响以及对骨成长特异的H型血管生长的作用。
1 材料与方法
1.1 材料
1.1.1实验动物:12只雄性3月龄C57小鼠,体重21~24 g [购于南京市江宁区青龙山动物繁殖场,许可证号:SCXK(苏)2017-0001]。
1.1.2实验仪器及试剂小动物Micro-CT仪(德国Bruker公司SkyScan 1176);冰冻切片机(LEICA CM1950);荧光显微镜(日本尼康Nikon Eclipse TS2R);成像系统(日本尼康Nikon DS-Ri2);强的松龙[爱必信(上海)生物科技有限公司,CAS号:83-43-2];rhPDGF-BB(peprotech,100-14B);Mouse PDGF-BB ELISA kit(cusabio,CSB-E08925);Mouse Osteocalcin ELISA试剂盒(cusabio,CSB-E06917 m);Mouse BSAP ELISA试剂盒(cusabio,CSB-E11914 m);Mouse PINP ELISA试剂盒(cusabio,CSB-E12775 m);Mouse CTX-1 ELISA试剂盒(cusabio,CSB-E12782 m);PBS(南京生兴生物);TRAP(solarbio,G1492);CD31(abcam,ab24590);Endomucin(abcam,ab106100)。
1.2 方法
1.2.1实验分组及处理:12只C57小鼠被随机分为两组,每组各6只。GIOP组通过腹腔注射强的松龙(10 mg/m2),每天一次,持续四周。BSA(体表面积)=k*W2/3,k=9.82,w=body weight;对照组通过腹腔注射等量的PBS。
1.2.2标本取材及处理:分别取各组小鼠外周血1 mL。将外周血置于冷冻离心机, 4 500 r/min,4 ℃离心10 min,取上清部分做ELISA检测。测定骨形成标志物骨钙素(osteocalcin ,OC)、骨特异性碱性磷酸酶(bone-specific alkaline phosphatase ,BSAP)、胶原氨基酸延长肽I(aminoterminal propeptide of type I procollagen,PINP)及骨吸收标志物:血清C端交联肽(serum C-telopeptide,CTX)。测定血小板衍化生长因子(platelet drive growth factor-BB, PDGF-BB)。解剖分离小鼠股骨,剪开股骨两端,用500 μL灭菌生理盐水反复冲洗小鼠股骨干,冷冻离心机4 500 r/min,4 ℃离心10 min,取上清部分做ELISA检测,测定骨髓上清PDGF-BB水平。取C57小鼠股骨行Micro-CT扫描。将股骨制成80 μm厚的冰冻切片,行CD31hiEmcnhiH型血管免疫荧光染色。分别取各组小鼠外周血1 mL。将外周血置于冷冻离心机, 4 500 r/min,4 ℃离心10 min,取上清部分做ELISA检测。测定骨形成标志物骨钙素(osteocalcin ,OC)、骨特异性碱性磷酸酶(bone-specific alkaline phosphatase ,BSAP)、胶原氨基酸延长肽I(aminoterminal propeptide of type I procollagen,PINP)及骨吸收标志物:血清C端交联肽(serum C-telopeptide,CTX)。测定血小板衍化生长因子(platelet drive growth factor-BB, PDGF-BB)。解剖分离小鼠股骨,剪开股骨两端,用500 μL灭菌生理盐水反复冲洗小鼠股骨干,冷冻离心机4 500 r/min,4 ℃离心10 min,取上清部分做ELISA检测,测定骨髓上清PDGF-BB水平。取C57小鼠股骨行Micro-CT扫描。将股骨制成80 μm厚的冰冻切片,行CD31hiEmcnhiH型血管免疫荧光染色。
1.3 统计学处理
2 结果
2.1 血清中BSAP、CTX-1、OC和PINP的表达
相对于对照组,GIOP组血清中CTX-1(P=0.000 3)表达上升,BSAP(P=0.000 01)、OC(P=0.001 3)和PINP(P=0.005 9)表达下降,见图1。
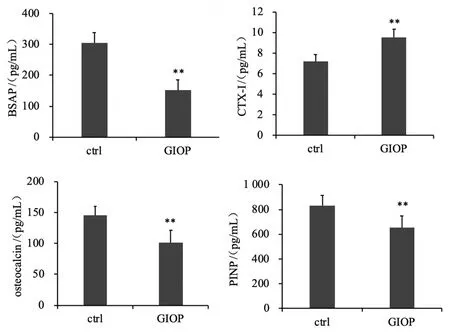
图1 血清中BSAP、CTX-1、OC和PINP的表达Fig.1 The expression of BSAP, CTX-1, OC and PINP in serum
从股骨Micro CT结果中可以看出,GIOP组相对于对照组,骨量减少, Tb.Th即小梁骨厚度有显著差异(P=0.000 6),见图2、表1。
表1 股骨Micro CT结果Table 1 Results of femur bone micro CT

图2 股骨Micro CT结果Fig.2 Results of femur bone Micro CT
从腰椎骨Micro CT结果(图3、表2)中可以看出,GIOP组相对于对照组,骨量明显减少。主要在TV(P=0.020 5)、BV(P=0.003 2)、Tb.N(P=0.039 9)和 BMD方面有统计学意义(P=0.031 2)。
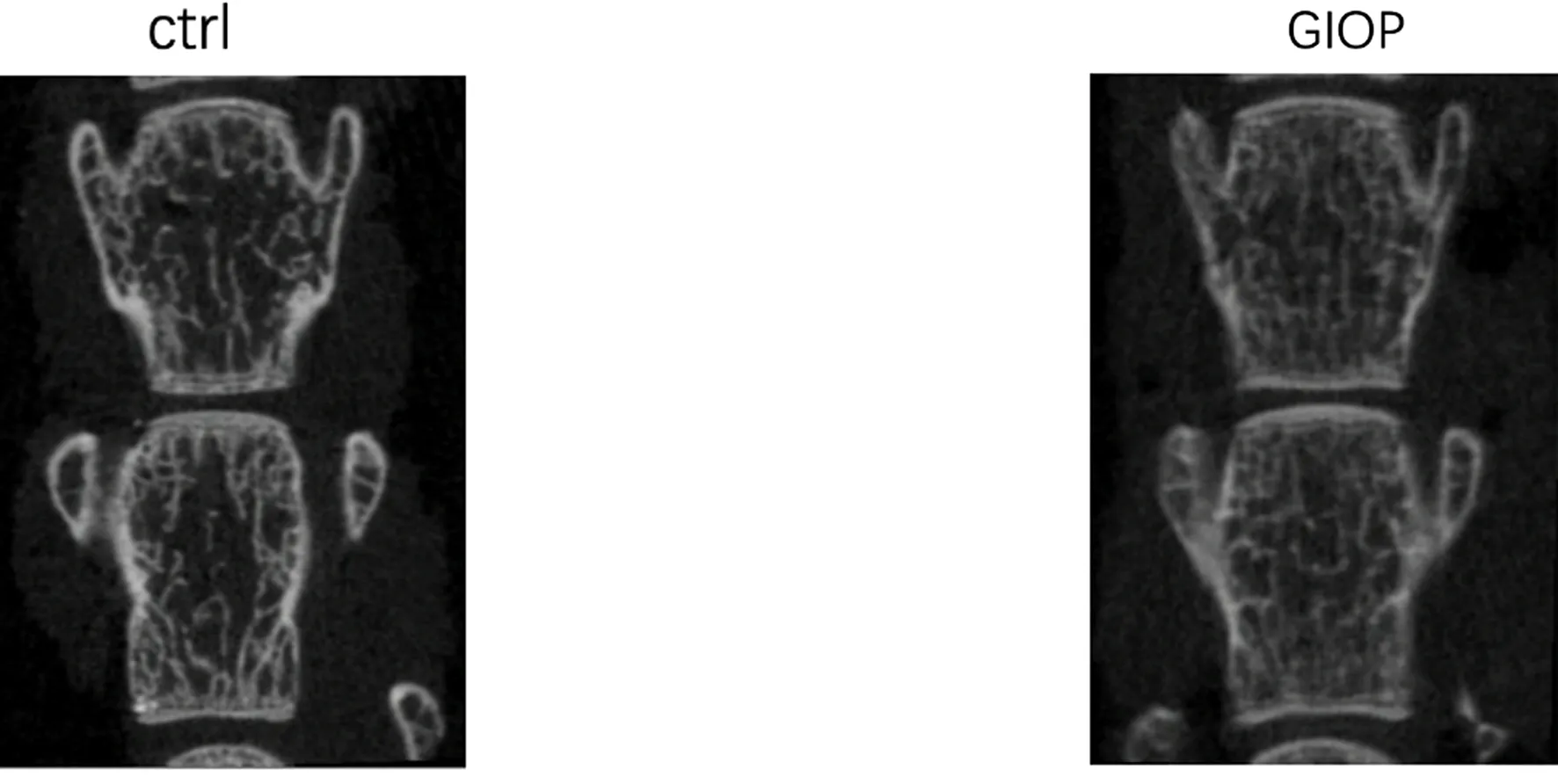
图3 腰椎Micro CT结果Fig.3 Results of lumbar bone micro CT
表2 腰椎Micro CT结果Table 2 Results of lumbar spine micro CT
相对于对照组,GIOP组血清和骨髓中的PDGF-BB表达明显下降,CD31和Endomucin 表达均有所下调,见图4、图5。
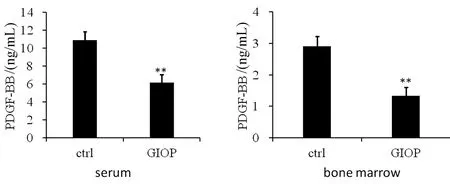
图4 血清和骨髓中PDGF-BB的表达Fig.4 The expression of PDGF-BB in serum and bone marrow
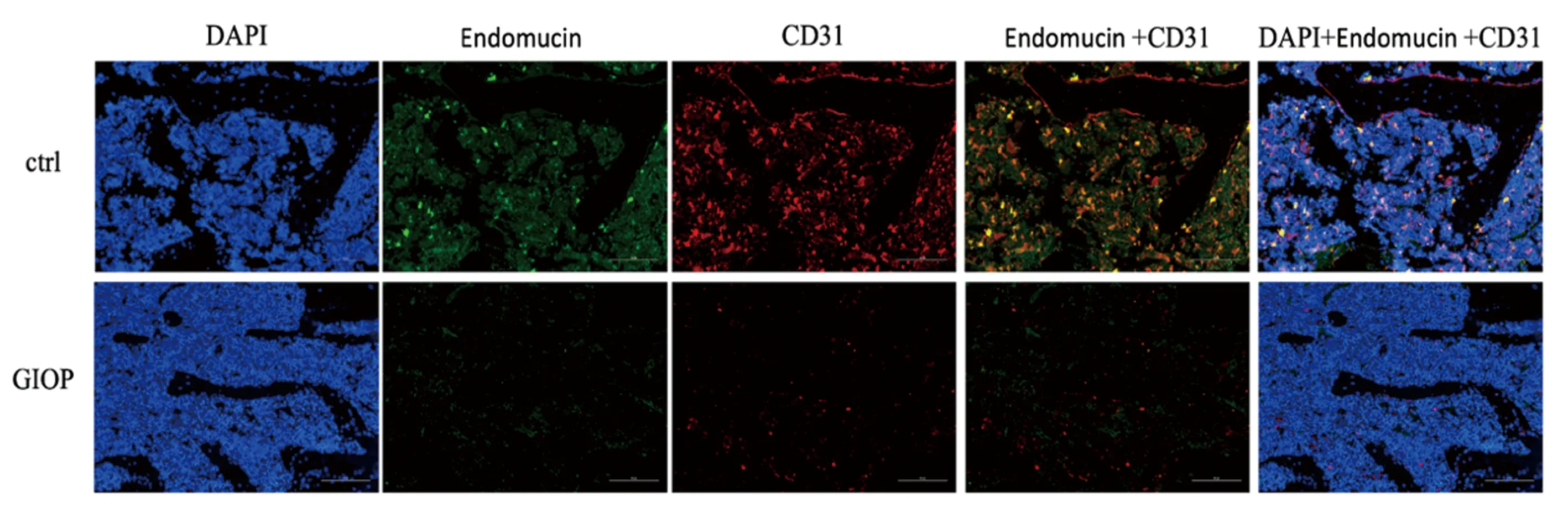
图5 H血管CD31和Endomucin表达Fig.5 CD31 and Endomucin expression of H type blood vessels
3 讨论
GIOP的发生具有一定的异质性[5]。一般来说,根据BMD的测定结果来看,在使用糖皮质激素一年之内,患者骨量快速丢失比例为6%~12%。此后,随着治疗的进行,每年依次丢失骨量3%[6]。在糖皮质激素短期高剂量、长期中等剂量和一次关节腔内注射就可以引起股骨颈或肱骨近端无菌性坏死,发生率为25%[7]。
由于糖皮质激素不可替代的作用,在临床工作中被广泛使用。在炎性和免疫性疾病中,包括风湿性关节炎、炎症性肠病、肾病综合征会在全身性使用[8]。在皮炎、哮喘、结膜炎等疾病中会被局部使用。而在急性炎症反应如休克、脑水肿和移植术后会使用高剂量的糖皮质激素[9]。在2019年对于新冠病毒的治疗中,也有不同程度的使用[10]。长期使用糖皮质激素,将不可避免的出现骨量减少、骨质疏松或骨质坏死。
糖皮质激素通过多种途径影响骨代谢,抑制成骨,增加骨吸收,最终导致骨量的丢失。目前已知的具体机制如下:①糖皮质激素诱导骨细胞程序性死亡,加速成骨细胞凋亡;②促使骨基质细胞分化为脂肪细胞,从而减少骨细胞数量[11];③通过直接抑制睾丸和卵巢及促性腺激素的释放,抑制性激素的合成,雄、雌激素的减少进一步加重骨量丢失;④通过影响钙在肠道和肾脏的代谢、转运,使尿钙增加、肠钙吸收明显减少,钙流失增多;⑤刺激甲状旁腺素的合成、分泌和释放,诱导骨质疏松的发生。本课题组前期的研究认为骨微环境尤其是微血管数目的减少,是GIOP的一个重要原因,糖皮质激素可能影响了与这些细胞及器官组织有关的血管联系,破坏骨形成的微环境[12],从而导致骨质疏松或骨量减少。
骨组织血管丰富,有广泛的大血管和毛细血管网络交织。破骨细胞的作用并不是简单的理解为促进骨吸收的因素。它与成骨细胞、血管生成偶联,起到促进新生血管生成的作用。骨稳态的维持和新骨的生成与血管生成密不可分。H型血管是科学家们发现的对CD31 和Endomucin (Emcn)高表达的骨特异性血管,H型血管内皮细胞分泌成骨转录因子Osterix。研究[13-14]证明随着年龄增长尤其是在老龄小鼠骨中,随着骨前体细胞和骨质量的减少,H型血管明显减少,在这点上,老年性骨质疏松症可能也有相似的发病机制。
血小板衍化生长因子(platelet drive growth factor, PDGF )是一组生长因子,调节细胞生长和分化,尤其是在血管生成方面作用显著。主要由体内单核/巨噬细胞合成。一般认为,PDGF源于间充质干细胞,包括纤维母细胞、平滑肌细胞和胶质细胞,储存在血小板α颗粒中,在血小板被激活后释放。PDGF分成AA/AB/BB三种具有生理活性的形式,其中BB型式更能促进纤维母细胞的生长。作为巨噬细胞的趋化因子[15],促进血管新生和动脉生成[16],体内研究证实,这一过程早于血管的萌芽和神经血管的生成[17-20]。
本研究在糖皮质激素诱导的小鼠骨质疏松症模型中,证明使用4周糖皮质激素会使PDGF-BB明显下降,出现骨量降低[18]。谢辉等[19]的研究证实了在卵巢切除小鼠中骨H型血管减少,而外源性的注射PDGF-BB 或cathepsin K阻滞剂可以增加破骨前体细胞数量,PDGF-BB的升高可以提高H型血管的数量,促进卵巢切除小鼠的骨形成。他们的研究提示在骨髓中PDGF-BB约有72.6%始自TRAP+的细胞分泌(主要为破骨前体细胞),12.6%由内皮细胞分泌,14.8%源自其他细胞。最近的研究[18]也证实,骨血流量的多少进一步控制了骨的功能血管生成和骨的生成。
经过Micro-CT测定,地塞米松使用3周(相当于人类的3~4年)使小鼠股骨远端小梁骨的厚度及数量明显减少[21]。本研究进一步证实长期高剂量糖皮质激素对成年小鼠破骨前体细胞PDGF-BB分泌及对骨成长特异的H型血管生长均具有抑制作用,相对于对照组,GIOP组血清和骨髓中的PDGF-BB表达明显下降;GIOP组血清中CTX-1表达上升,BASP、OC和PINP表达下降。
当然,本研究也存在一定的不足。在后续研究中需要进一步通过PDGF-BB局部穿刺注射治疗动态观察骨的代谢产物和H型血管的变化。另外,对于使用糖皮质激素4周的C57小鼠模型,从股骨Micro CT结果中看到GIOP组相对于对照组骨量减少,以小梁骨厚度有显著差异为主(P=0.000 64);在腰椎骨的组织量(P=0.020 5)、骨量(P=0.003 2)、骨小梁数(P=0.039 9)、骨密度方面(P=0.031 2)有统计学意义。但以股骨为代表的皮质骨、以腰椎为代表的松质骨为什么会对糖皮质激素的应答不一致,目前还未得出结论,今后应在这方面进一步展开研究与探讨。

