老年营养风险指数与老年男性2型糖尿病患者骨密度和骨质疏松症的关系
王环君 李琳 高海花 陈娟 陈少波 皮银珍
长沙市第一医院内分泌科,湖南 长沙 410005
2型糖尿病和骨质疏松症都是增龄性疾病,流行病学调查发现骨质疏松症是全因死亡率最重要的危险因素,其次是糖尿病[1]。我国65岁以上人群骨质疏松症患病率达32%[2],糖尿病患病率由2007年的9.7%攀升至2017年的11.2%,其中老年、男性患者明显增加[3]。有研究[4-5]表明营养不良也是老年骨质疏松症的危险因素。尽管有专门的饮食指导,2型糖尿病患者的营养状况仍然受到不良的影响[6]。老年营养风险指数(geriatric nutritional risk index,GNRI)于2005年被Bouillanne[7]首次报道,与化脓性肝脓肿[8]、髋部骨折术后[9]等很多疾病的预后密切相关。本文将主要探究GNRI与老年男性2型糖尿病患者骨密度(bone mineral density, BMD)和骨质疏松症(osteoporosis, OP)的关系。
1 对象与方法
1.1 研究对象
选取2019年1月至2019年8月在长沙市第一医院内分泌科住院的老年男性2型糖尿病患者(年龄60~95岁)216例。2型糖尿病诊断采用“中国2型糖尿病防治指南(2017年版)”的标准[10]。排除标准:①长期(≥6个月)使用可能影响骨代谢的药物如噻唑烷二酮类、钙剂、维生素D、利尿剂、糖皮质激素等;②合并急性感染、糖尿病性酮症酸中毒、糖尿病高渗性昏迷;③合并慢性阻塞性肺疾病、严重心衰、肝肾功能不全(谷丙转氨酶≥2.5倍,肌酐≥133 μmol/L );④合并甲状腺功能亢进症或甲状腺功能减退症、甲状旁腺功能亢进症或甲状旁腺功能减退症;⑤合并类风湿性关节炎、系统性红斑狼疮、恶性肿瘤等;⑥长期卧床者。本研究项目经长沙市第一医院医学伦理委员会批准(批号KL-2019004)并获患者知情同意。
1.2 方法
1.2.1一般情况:记录受试者年龄、血压、身高、体重、糖尿病病程等基本情况,根据身高、体重计算体质量指数,体质量指数(body mass index, BMI)=体重/身高2(kg/m2)。
1.2.2生化指标检测:隔夜8~10 h后于次晨空腹采集受试者静脉血,用贝克曼 AU5800型全自动生化分析仪测定空腹血糖(FBG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、血尿酸(UA)、血肌酐(Cr)等;通过比色法测定血清总钙、柠檬酸法测定血清磷;运用高压液相色谱法测定25羟维生素D、糖化血红蛋白(HbA1C)。
1.2.3骨密度测定:采用双能X线吸收法(DXA,Osteocore Type 3,French Medlink)测量受试者腰椎(lumbar)、股骨颈(fermur neck)和左侧髋部(total hip)骨密度(g/cm2)。对于骨质疏松症的诊断参照2017年中华医学会骨质疏松和骨矿盐疾病分会制定的标准[2]。
1.2.4GNRI测定:根据受试者身高(cm)、体重(kg)、理想体重(kg)、血清白蛋白(g/L)等参数计算GNRI。计算公式:GNRI=(1.489×白蛋白(g/L))+41.7×[体重/理想体重],理想体重(男)=身高-100-([身高-150]/4),当体重超过理想体重时,设体重/理想体重=1。GNRI营养评估等级判定:高营养风险(GNRI< 82),中营养风险(82≤GNRI< 92),低营养风险(92≤GNRI≤98),无营养风险(GNRI> 98)[7]。本研究将纳入的216例患者分为GNRI正常组(GNRI> 98,n=169)和GNRI降低组(GNRI≤98,n=47)。
1.3 统计学分析
2 结果
2.1 两组间一般资料比较
216例患者GNRI平均值为101.73±6.77,其中高营养风险4例,中营养风险14例,低营养风险29例,无营养风险169例,有21.8%的老年男性2型糖尿病患者存在营养风险。与GNRI正常组相比,GNRI降低组糖尿病病程更长(P<0.05),BMI、白蛋白更低(P<0.01),血清钙、25羟维生素D更低(P<0.05),股骨颈、全髋BMD更低(P<0.01),骨质疏松症患病率更高(P<0.05)。两组患者的年龄、收缩压、舒张压、HbA1C、TG、TC、HDL、LDL、FBG、Cr、UA、血清磷、腰椎BMD等比较差异无统计学意义(P>0.05),见表1。
表1 两组患者一般资料比较Table 1 Comparison of general parameters between the two groups
2.2 腰椎、股骨颈及全髋BMD与GNRI的相关性分析
通过直线相关分析发现,GNRI与腰椎BMD无相关性(P>0.05),与股骨颈BMD呈正相关(P<0.01),与全髋BMD呈正相关(P<0.05)。见图1。
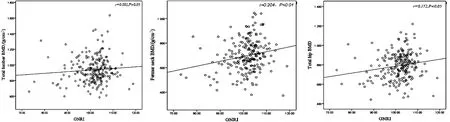
图1 老年营养风险指数与骨密度相关关系散点图Fig.1 The scatter plot of the correlation between the geriatric nutritional risk index and each site of bone mineral density
2.3 各部位BMD与其余指标的相关性分析
腰椎BMD与25羟维生素D呈正相关(P<0.05);股骨颈BMD与BMI呈正相关(P<0.01)、与25羟维生素D呈正相关(P<0.05)、与年龄呈负相关(P<0.05);全髋BMD与BMI、25羟维生素D呈正相关(P<0.01),与UA呈正相关(P<0.05),与年龄呈负相关(P<0.05)。见表2。
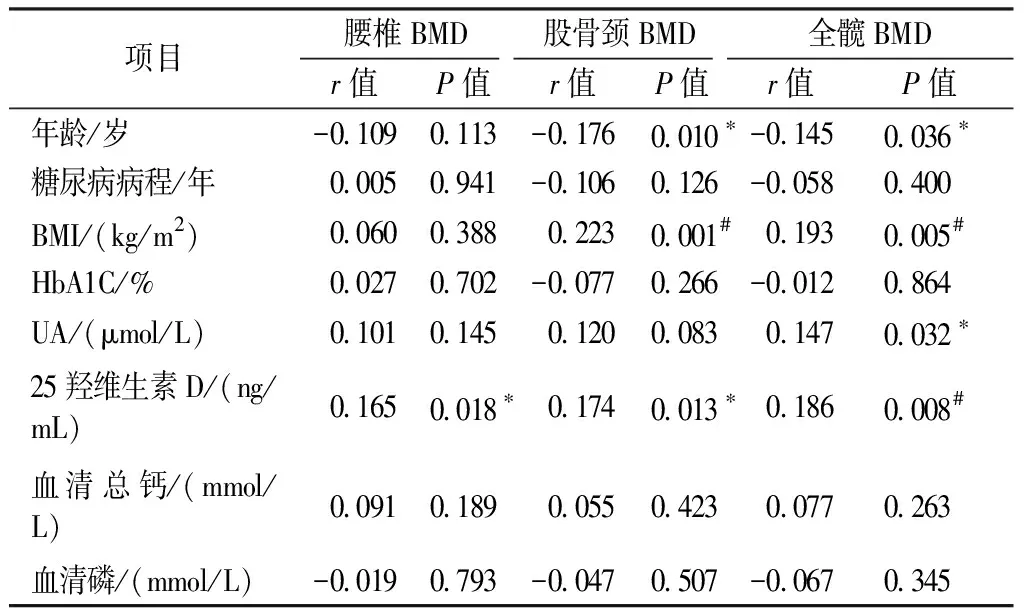
表2 腰椎、股骨颈及全髋BMD与其余指标的相关性分析
2.4 老年男性T2DM患者骨质疏松症的多元Logistic回归分析
以骨质疏松症为因变量、其余因素为自变量进行二分类Logistic回归分析发现,高龄和UA、25羟维生素D、GNRI降低是老年男性2型糖尿病患者骨质疏松症的独立危险因素(B=0.057,-0.006,-0.070,-0.076,P<0.05)。见表3。
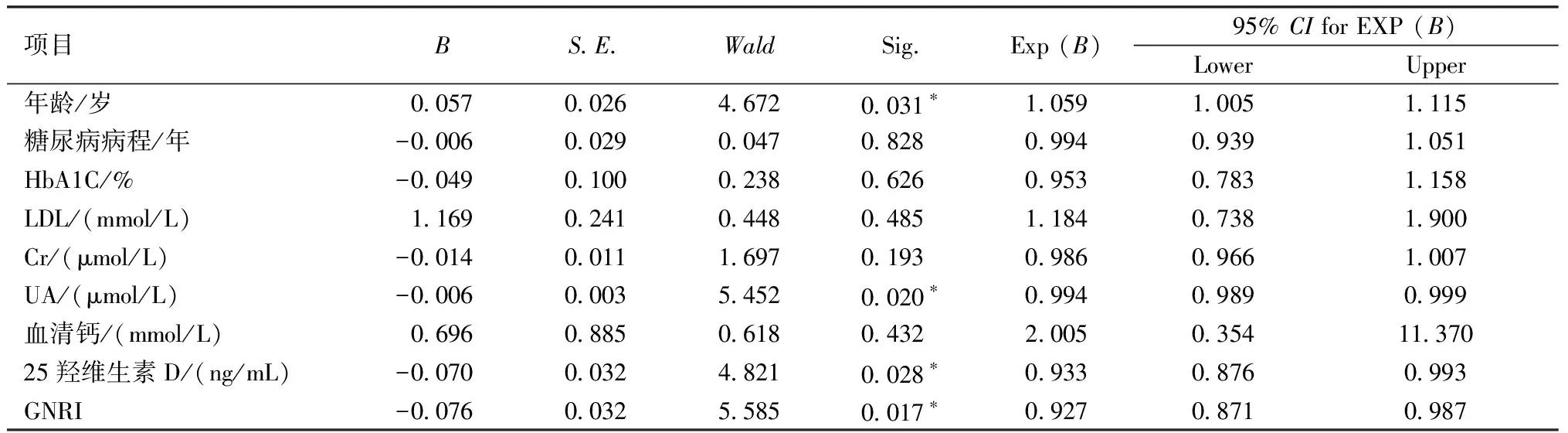
表3 老年男性T2DM患者骨质疏松症的多元Logistic回归分析Table 3 Multiple logistic regression analysis for risk factors associated with osteoporosis in elderly men with type 2 diabetes mellitus
2.5 GNRI等联合指标对老年男性T2DM患者骨质疏松症的预测价值
ROC曲线结果显示,包含年龄、UA、25羟维生素D和GNRI的联合指标对骨质疏松症进行预测的曲线下面积达0.721,灵敏度为60.5%,特异性为73.1%,联合指标预测价值较高。见图2。
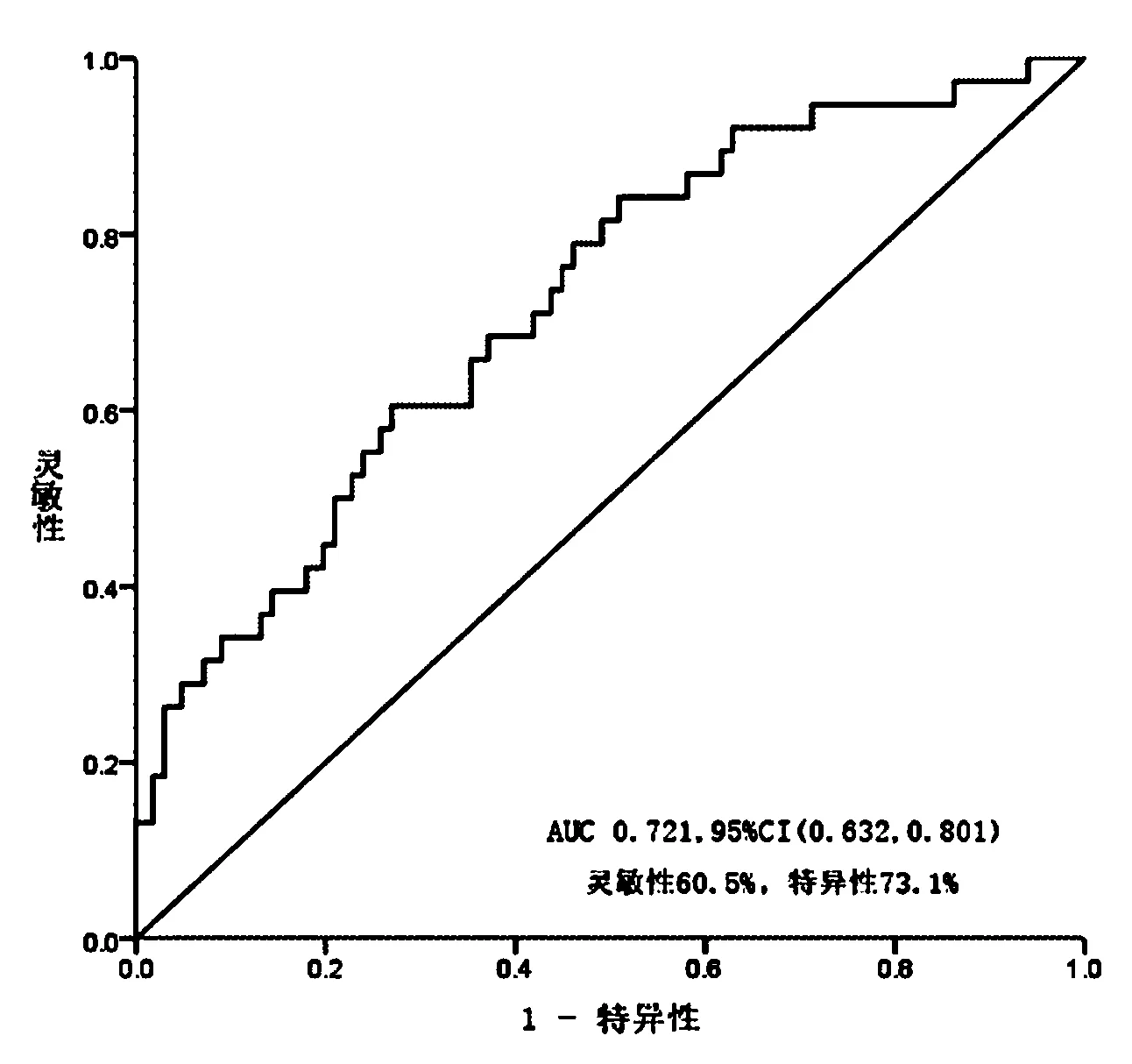
图2 ROC曲线分析包含GNRI的联合指标对骨质疏松症的预测价值Fig.2 ROC curve analysis the predictive value of the combined indicators including GNRI for osteoporosis
3 讨论
T2DM特别是老年患者由于代谢紊乱、胰岛素抵抗等导致机体对葡萄糖利用减少,脂肪、蛋白质分解增加,往往存在不同程度的营养不良[11]。营养评估目前没有统一标准,单一指标如血红蛋白、白蛋白、体重等都有一定的局限性,临床多用复合指标来评估,但复合指标也各有优劣。微营养评定法简表(MNA-SF)是2001年由Rubenstein等[12]修订,包括人体测量、整体情况、膳食问卷和主观评定,简单、易操作但主观性较强。营养风险筛查2002(NRS2002)是由Espen提出[13],由营养状况、疾病严重程度和年龄三方面评分组成,主要筛查近期、急性的营养状况改变,特异度高而灵敏性低[14]。控制营养状况(COUNT)评分法是2005年由Ignacio等[15]制定,使用清蛋白、总胆固醇、外周血总淋巴细胞数等客观指标,主要反映评估对象的蛋白储备、热量消耗及免疫炎症状态。GNRI则结合了白蛋白、身高、体重等各种指标,是一个相对简单、准确、客观地评估“营养相关风险”的工具。本研究发现老年男性T2DM患者GNRI平均值为101.73±6.77,发生营养不良风险者达47例,占比21.8%,说明老年男性T2DM患者有较高的营养不良风险。
近来一些研究发现GNRI与骨密度、骨质疏松症有明显的相关性。行甲状腺全切除术的绝经后妇女中GNRI与BMD呈正相关[16],低水平的GNRI是青年男性类风湿性关节炎患者骨质疏松的一个危险因素[17],T2DM患者的GNRI与BMD呈正相关,与骨质疏松呈负相关[18]。本研究中发现GNRI降低组的股骨颈、全髋BMD明显低于GNRI正常组,骨质疏松症发病率更高。GNRI与股骨颈、全髋BMD呈负相关,差异有统计学意义(r分别为0.204,0.172,P<0.05),说明股骨颈、全髋BMD的下降与营养不良风险增加有关。肌肉组织是骨密度及骨强度的重要影响因素,其在力学作用和化学调节等多方面对骨骼起到正向保护作用[19]。本研究中GNRI正常组白蛋白和血清总钙明显高于GNRI降低组,高摄入蛋白质能减少骨骼和肌肉的丢失,并可维持下肢肌肉功能,防止跌倒[20]。饮食中蛋白质含量的增加可提高肠道对钙的吸收,抑制甲状旁腺素的分泌、抑制骨吸收[21]。蛋白质的摄入减少还会降低胰岛素生长因子-1的水平[22],胰岛素生长因子-1是骨代谢的重要调节因子,对骨骼的生长和稳定有十分关键的作用[23]。此外,体重增加会增大对骨骼的机械应力,作用于成骨细胞和破骨细胞上的机械应力感受器,使骨形成增加、骨吸收减少,提高骨强度和骨矿含量。GNRI包含了白蛋白、体质量、理想体质量等几个客观指标,可能是它与骨密度相关性较大的原因。
多因素Logistic回归分析表明,高龄是骨质疏松症的独立危险因素,而尿酸、25羟维生素D和GNRI是骨质疏松症的独立保护因素。随着年龄的增加骨密度逐年下降,氧化应激能使破骨细胞活性增强、骨吸收增加,是与年龄相关的骨质流失的原因之一。血尿酸是一种十分重要的内源性抗氧化剂,外周循环中的尿酸具有强烈的抗氧化性[24]。活性氧能抑制成骨细胞在体外的分化和增殖,促进骨吸收,对小鼠进行研究[25]发现尿酸可剂量依赖性地抑制破骨细胞活性、减少破骨细胞前体中的活性氧的含量,本研究也证实尿酸是骨质疏松的独立危险因素。维生素D的活性形式1,25(OH)2D3能增加小肠黏膜对钙、磷的吸收,增加肾小管对钙、磷的重吸收。骨组织中生理剂量的1,25(OH)2D3能直接作用于骨的矿物质代谢,促进骨基质形成及类骨质矿化[26]。ROC曲线发现年龄、尿酸、25羟维生素D、GNRI等4个指标联合曲线下面积为0.721,提示包含GNRI的联合指标对老年男性T2DM患者骨质疏松症有较高的预测价值。
本研究中GNRI与腰椎BMD无相关性,考虑DXA法检测腰椎BMD易受肥胖、腹主动脉钙化、脊柱畸形和骨质增生等影响,有学者[27]认为DXA法测量BMD的部位应首选髋部。因此对于老年男性T2DM患者来说,腰椎BMD可能不能客观、准确地反映骨量下降的情况。对老年男性T2DM患者要尽早进行营养风险筛查和BMD的测定,及时进行营养干预、减少骨量的丢失,预防骨质疏松症的发生发展。本研究为单中心横断面研究,样本量有限,存在选择偏倚;未将饮食习惯、体育锻炼、家族史等可能引起BMD下降的一些因素纳入分析是本研究的局限之处。在后续的研究中应扩大样本量,争取进行多中心、前瞻性的研究,为GNRI对老年男性T2DM患者骨密度、骨质疏松症的影响提供更多的临床证据。

