乳蛋白多态性和盐分布对牛乳凝乳性能的影响
郑思凡,马长路,张文远,杨宇泽,申晓琳,姜竹茂,张书文,,吕加平
(1.烟台大学生命科学学院,山东 烟台 264000;2.中国农业科学院农产品加工研究所,北京 100193;3.北京市畜牧总站,北京 100101;4.河南牧业经济学院食品与生物工程学院,河南 郑州 450046)
牛乳凝乳是酸乳和干酪等发酵乳制品生产过程中的关键步骤[1]。在添加凝乳酶或发酵剂后,凝乳性能差(poor coagulation,PC)或不凝乳(non-coagulation,NC)现象的出现严重影响了产品得率及品质[2]。在抗生素残留控制十分严格的情况下,还是会出现NC或PC的现象,研究发现约有13%的奶牛包括丹麦荷兰等国家的荷斯坦奶牛、Jersry牛等所产牛乳凝乳时间显著较长,并且约有2%~4%的奶牛所产牛乳NC[3],牛乳凝乳性能(milk coagulation properties,MCP)是决定牛乳加工生产所得奶酪得率的一个重要因素。MCP是牛乳凝固过程中多种因素共同作用的结果,其中牛乳含有的酪蛋白含量和MCP是干酪生产的关键因素,并且有研究报道,牛乳的遗传因素中酪蛋白的多态性显著影响MCP。
与凝乳性能好(well-coagulating,WC)的牛乳相比,PC或NC牛乳样品中κ-酪蛋白(κ-casein,κ-CN)的基因型为AA,就酪蛋白而言,WC的牛乳酪蛋白胶束具有较大的平均直径和较低含量的κ-CN。β-乳球蛋白(β-lactoglobulin,β-LG)基因型对凝乳时间有明显影响。研究发现β-LG基因型为AA的牛乳比基因型为BB或AB的牛乳更适于加工干酪,前者可以加快凝乳速度并且能够获得更高的干酪产量,这可能是由于含基因型为AA的β-LG的牛乳通常酪蛋白含量较高所致,同时含A等位基因β-LG的牛乳要比含B等位基因β-LG的牛乳凝乳速度更快[4]。在生产Manchego干酪时,β-LG基因型为AA的牛乳加工的干酪产量最高。
PC牛乳的κ-CN基因型通常为AA、AE和EE,而凝乳时间短和凝块硬度大的牛乳其κ-CN等位基因通常为B[5]。影响MCP大小的κ-CN基因型的顺序为BB>AB>AA,这种κ-CN基因型的顺序与Hallén等[6-7]描述的κ-CN浓度和比例相对应。除了环境因素外,已经证实了牛乳凝固的遗传因素中最一致的结果是,κ-CN、β-CN和β-LG与牛乳凝乳和奶酪的生产效率呈正相关趋势[1,8]。个体奶牛的MCP变化主要与酪蛋白(αS1-、αS2-、β-和κ-CN)和乳清蛋白的含量和相对比例有关[1,9],这些成分影响酪蛋白胶束的大小和稳定性。
本实验研究不同乳蛋白基因型对牛乳凝乳特性的影响,通过动态流变仪、凝胶电泳、毛细管电泳、高效液相色谱技术等手段分析不同基因型原料乳的凝乳特性差异。明确造成牛乳PC或NC的内源性因素,建立原料乳组分与凝乳特性之间的相关性,确定影响凝乳的主要乳蛋白质组分和基因型。以期为原料乳的品质评价和合理利用,改善发酵乳品质,增加乳品企业经济效益,提供重要的理论研究参考和应用价值。
1 材料与方法
1.1 材料与试剂
1 071 头奶牛分别来自北京三元绿荷南口三场、绿荷南口二场、三石牛场、王庄牛场等。采集血样和乳样。
凝乳酶(CHY-MAX POWDER EXTRA NB)科汉森中国有限公司;乳酸、氢氧化钠、柠檬酸、柠檬酸钠、尿素(均为分析纯) 国药集团化学试剂有限公司;二硫代苏糖醇、羟丙基甲基纤维素、三羟甲基胺基甲烷、盐酸胍、Bis-Tris(均为分析纯),α-乳白蛋白(α-lactalbumin,α-LA)、β-LG、α-CN、β-CN、κ-CN标准品 美国Sigma公司;乙腈、三氟乙酸、甲醇(均为色谱纯) 北京广达恒益科技有限公司;实验所用水均为Millpore超纯水。
样品缓冲溶液:准确称取0.295 4 g柠檬酸钠、0.156 g二硫代苏糖醇、2.011 1 g三羟甲基胺基甲烷,加入6 mol/L尿素溶液75 mL,定容至100 mL,调至pH 8.0。
运行缓冲溶液:准确称取4.208 3 g柠檬酸、0.582 8 g柠檬酸钠、0.05%羟丙基甲基纤维素,加入6 mol/L尿素溶液75 mL,定容至100 mL,调至pH 3.0。
1.2 仪器与设备
pH计 上海天美科学仪器有限公司;DK-S24电热恒温水浴锅 上海森信实验仪器有限公司;3K15离心机德国Sigma公司;MCR502流变仪 奥地利安东帕公司;7700X电感耦合等离子体质谱仪、Alpha Ease FC凝胶成像系统 美国Agilent公司;L-80XP超速离心机、毛细管电泳仪 美国Beckman公司;UHPLC 1525超高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 样品采集
血样采集及检测:通过对北京三元绿荷南口奶牛三场等牛场3 625 头母牛系谱分析,采集其后代1 071 头16 月龄大青年、一胎、二胎母牛血样并提取DNA,采用竞争性等位基因特异性聚合酶链式反应对样本进行分型,之后利用基因分型技术对其进行κ-CN和β-LG基因分型检测。主要操作是通过蛋白酶K消化,使用苯酚-氯仿从血液样本中分离DNA。使用MassARRAY iPLEX受体型蛋白酪氨酸磷酸酶分析对DNA进行基因分型。汇编80 个单核苷酸多态性(single nucleotide polymorphism,SNP)位点,包括κ-CN和β-LG,仅对次要等位基因频率大于5%且检出率至少为90%的SNP进行分析。
乳样采集:初筛和复筛方法。在北京三元绿荷南口奶牛三场,采集已知的6种基因型原料乳样品,每种基因型样品每次采集至少30 份,每份50~100 mL,共180 份;相同实验重复3 次(每隔15 d采集1 次,共采集3 次)。从中筛选出WC、PC及NC牛乳样品每类至少5 份样品;然后,重复采集选出的牛乳样品5 次(隔3 d采集1 次,每天采集早、中、晚3 次,每次采集50~100 mL)。
1.3.2 MCP判定标准
将牛乳放置于33 ℃恒温水浴锅,添加凝乳酶使其凝乳,按照凝乳时间划分凝乳等级,凝乳时间在18 min以内的划分为WC乳样,凝乳时间在18~30 min之内的划分为PC乳样,凝乳时间大于30 min的乳样即为NC乳样[4]。
1.3.3 电感应耦合等离子体质谱仪测定
使用电感应耦合等离子体质谱仪测定样品中可溶性钙、镁和磷浓度。按照文献[10]方法进行检测并稍作修改。将原料乳在4 ℃、2 000×g离心30 min取脱脂乳测定乳中元素总含量。样品前处理将牛乳分为可溶相和胶体相,使用超速离心机将10 mL样品100 000×g离心1 h[11],收集上清液用于可溶相元素分析。波长315.887 nm,功率1 kW,等离子流量15 L/min,辅助流量1.5 L/min,雾化器流量0.75 L/min,泵速15 r/min。所有样品均重复3 次。在超速离心的上清液中测量可溶性矿物质含量。计算方法见下式:
胶束矿物质含量=总矿物质含量-可溶性矿物质含量
1.3.4 流变仪分析
参考文献[11]的方法,准备已预选好的牛乳样品20 mL,用体积分数10%的乳酸溶液将pH值调节至6.5,移取适量样品至流变仪样品池中,检测条件为应变1%,频率1 Hz,预热并稳定温度在33 ℃后,每10 mL样品添加凝乳酶8.9 μL(酶浓度0.038 IMCU/mL),搅匀后开始测定,测定时间1 h,检测指标包括凝乳时间、储能模量G’、损耗模量G”。
1.3.5 牛乳成分测定数据收集和整理
数据来自该采样牛场采样牛只的DHI记录,主要包括牛号、基因型、采样时间、胎次、产犊日期、泌乳时间、日产奶量、乳脂率、乳蛋白率、脂蛋白比、体细胞数、体细胞评分等信息。为保证结果的可靠性,数据不完整的记录不纳入分析。
1.3.6 毛细管电泳分析蛋白多态性
操作条件为分离电压20 kV、柱温38 ℃、进样压力0.5 psi、时间5 s、紫外检测波长214 nm。参考文献[12]方法,采用毛细管电泳定量分析样品牛乳κ-CN和β-LG的含量。将样品与样品缓冲溶液按1∶3(V/V)的比例混合,室温放置1 h,10 000 r/min离心5 min,取上清液,用0.45 μm的滤膜过滤后直接进样。
1.3.7 高效液相色谱法分析牛乳中蛋白质含量
参照文献[4,13-14]方法并加以修改。向样品中加入等体积的工作液I(0.1 mol/L Bis-Tris、6 mol/L盐酸胍、5.37 mmol/L柠檬酸钠、19.5 mmol/L二硫苏糖醇的混合溶液),样品融化后振荡10 s混匀,室温静置1 h。将混合溶液4 ℃、16 000×g离心5 min,除去表层乳脂,取底层溶液300 μL于新的离心管中,加入工作液II(以流动相A为溶剂的4.5 mol/L盐酸胍溶液)体积比1∶3稀释,混匀,过滤到进样瓶中待测。流动相A为0.1% TFA溶液,流动相B为0.1% TFA-乙腈溶液。流动相经抽滤、超声脱气后备用。
色谱条件:Waters SunFiveTMC18柱(250 mm×4.6 mm,5 μm),检测波长214 nm,柱温40 ℃,进样量10 μL,流速0.5 mL/min。实验所用水均为Millpore超纯水。洗脱梯度:0~9 min,67%~65% A、33%~35% B;9~18 min,63%~60% A、37%~40% B;18~22 min,60%~59% A、40%~41% B;22~27.5 min,59% A、41% B;27.5~28 min,59%~57% A、41%~43% B;28~36 min,57%~55% A、43%~45% B;36~40 min,55%~10% A、45%~90% B。
1.4 数据处理
除另有说明,每种处理均3 次重复。利用SPSS具有相互作用的单向ANOVA以确定显著差异。使用Duncan的多重范围测试比较多个均值之间的差异。统计学显著性设定为P<0.05,差异显著。绘图由Origin 9.0完成。
2 结果与分析
2.1 牛乳蛋白基因型频率分析
血样采集结果显示,κ-CN基因设计4 个SNP位点,β-LG基因设计2 个SNP位点,其中κ-CN基因有AA、AB、AE、BB、BE、EE 6种基因型,β-LG基因型有AA、AB、BB 3种基因型。
牛场现有奶牛中已知基因型的牛乳蛋白基因型及频率,κ-CN和β-LG的乳蛋白基因型存在比例上的差异,如表1所示。在所有奶牛组中,β-LG的AB基因型(占比48.48%)最常见,但AA型基因(30.97%)的原料乳凝乳效果较好;κ-CN的BB基因型(12.00%)凝乳效果较好,较AA、AB等凝乳时间更短和凝胶强度更强。酪蛋白和乳球蛋白的不同基因型牛乳的凝乳频率也存在明显差异。分泌κ-CN的AA基因型牛乳的母牛所占比例最高,在κ-CN的AB、BB、BE基因的总体凝乳效果较好,凝乳频率都达到了70%以上。等位基因B对凝乳有积极作用[15],与AB型相比,BB基因型更能提高干酪产量,等位基因A对凝乳产生消极作用。κ-CN的EE在整体牛群中比例含量最少,考虑到母牛的更替换代,所以在后续分析处理中并未对此基因型列入到数据库中;在所有奶牛组中最常见的β-LG基因型是AB[6],β-LG的AA和BB基因型的凝乳效果良好,凝乳频率都超过了80%,而AB基因型有33.01%的MCP很差,有7.56%的牛乳NC,这导致其整体的MCP大大减弱。从以上结果可知,至少有4%~8%的牛乳存在NC的现象,若这部分牛乳应用到实际生产过程中,其对产品品质造成一定影响,这也证明了此研究的必要性。有相关研究[2]显示,丹麦荷斯坦奶牛和Jersey奶牛也有类似的趋势,本研究结果与其一致。已有研究[16-19]表明:κ-CN和β-LG的B变异体可通过缩短凝乳时间,改善凝乳硬度而对MCP产生有利影响。另外,前期研究报道,κ-CN的A和E型变异体对凝乳有负面影响[20],但在本实验中并未显示出E型基因对MCP有明显的负面影响,原因可能是我国所用奶牛是荷斯坦牛与本土黄牛的杂交品种,其牛乳相关特性发生了改变,所以并未有明显的负面效果,或者是E型牛乳在牛群中样本量不足。
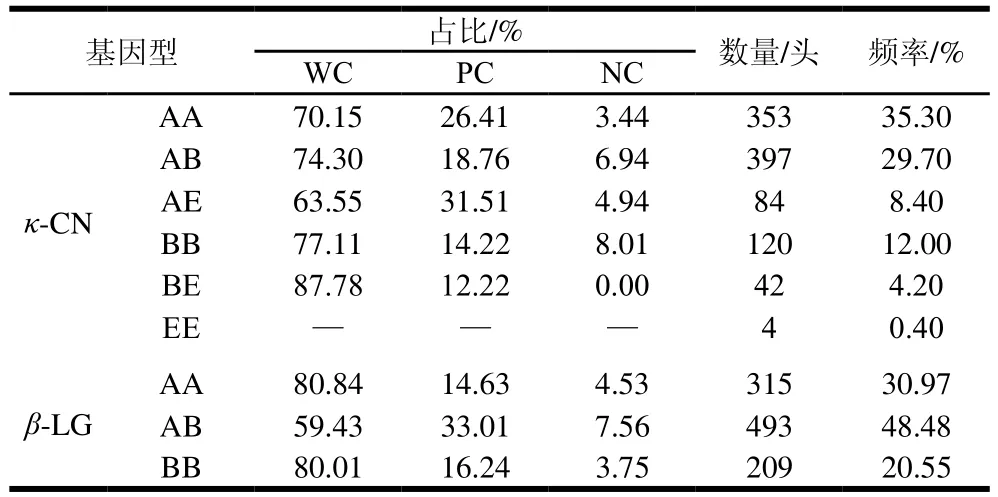
表1 κ-CN和β-LG蛋白各基因型牛乳的凝乳频率Table 1 Curding frequency of milk from cows with different κ-CN and β-LG genotypes
2.2 乳成分及体细胞分析
两种蛋白不同基因型所对应牛乳DHI的基础数据(表2)显示,κ-CN中基因型AB和AE含蛋白较高。AE基因型虽蛋白质含量较高,但表1显示其凝乳频率较低,原因可能是在总蛋白中乳清蛋白含量较高、酪蛋白含量较低导致,酪蛋白是凝乳过程中起主要作用的蛋白。并且与具有良好凝结特性的牛乳相比,PC、NC牛乳在凝结性差和不凝结的牛乳中总蛋白、总酪蛋白和κ-CN含量较低,且矿物质含量(Ca、P、Mg)较低[1]。其他乳糖、干物质含量相差不大,说明这些因素对凝乳效果影响不大。但也有文献指出,在制作酸乳过程中乳糖可提高酪蛋白的凝胶作用,对凝乳强度有积极作用[21]。乳糖可以通过增强凝胶中相邻酪蛋白胶束表面上非极性氨基酸残基或非极性板块之间的疏水相互作用增强酪蛋白凝胶化作用。有必要进一步分析乳糖在酸诱导乳凝中的作用[7]。

表2 κ-CN和β-LG不同基因型牛乳DHI检测结果Table 2 DHI parameters of milk from cows with different κ-CN and β-LG genotypes
2.3 流变仪分析MCP
G’和G”是反映牛乳黏弹性的重要指标;G’代表牛乳流动时的弹性大小,描述样品的固态特性。G”代表样品流动时的黏性大小,表示流动时由于内部摩擦而损失的变形能量,描述样品的液态特性。一般认为,G’值越高,其凝胶结构越致密。凝乳时间定义为凝胶G’值大于1 Pa时所需的时间点[22]。通过流变数据可以看出,在初筛出的全部样品中,可以明显界定出WC、PC与NC的样品。由表3可知,将WC、PC与NC牛乳样品的凝乳时间和凝乳硬度进行比较,结果表明差异极显著(P<0.01)。对应的动态流变示意图如图1所示,WC牛乳的G’值最高,其凝胶结构最为紧密,并且凝乳时间最短,凝乳效率最高;而PC牛乳虽能形成凝胶,但其凝乳时间较长,G’值普遍比WC牛乳要低,证明其凝胶结构不够紧致,不坚硬,形成的凝乳状态不好,会影响生产品质;NC牛乳显而易见基本未形成凝乳状态,其G’值甚至未达到10 Pa,没有形成凝胶状态,影响最终产品品质。表4显示了β-LG的AA基因型凝乳时间较短,且凝胶强度最高,但乳球蛋白含量较高会对凝乳产生不利影响,延长凝乳时间并降低凝乳强度;κ-CN的BB基因型较其他4种基因型,其凝乳时间最短,G’30值最高,证明形成的凝胶结构更为致密,形成了高度交联的网状结构,BB型基因对牛乳凝乳产生有利影响[20]。
表3 动态流变数据定义牛乳凝乳等级的显著性分析结果(x±s)Table 3 Significance analysis results of rheological data defining milk coagulation grades (x ± s)

表3 动态流变数据定义牛乳凝乳等级的显著性分析结果(x±s)Table 3 Significance analysis results of rheological data defining milk coagulation grades (x ± s)
注:**.三者差异极显著,P<0.01;1.主观评价凝乳30 min的硬度:坚固=足以形成立方体;柔软=不足以形成立方体;等级按照G’18的时间划分;NC时间统一选取检测总时长60 min作为最终时间。
指标 凝乳等级 显著性WC(n=30) PC(n=13) NC(n=8)凝乳时间/min 11±2.18 21.91±2.98 >30 **G′max/Pa 139.35±26.30 59.51±17.64 6.53±5.32 **30 min凝乳硬度1 坚固 柔软 不凝乳

图1 3 类牛乳样品动态流变示意图Fig.1 Dynamic rheological curves of milk samples with different coagulation abilities

表4 基因型与凝乳时间及凝乳硬度的关系Table 4 Relationship of genotype with RCT and curd hardness
2.4 不同凝乳种类牛乳组成及矿物元素分布
由表5可知,在NC牛乳样品中的矿物元素含量明显低于凝乳WC样品,此结果与Jensen等[1]的研究结果一致。尤其胶体钙含量明显较低,以及可溶相和胶体相中磷元素含量差异明显。结果说明离子含量和分布的差异影响牛乳的凝乳能力。WC样品比NC样品中总钙含量高,胶体相钙含量与MCP呈正相关趋势,结果差异显著。酪蛋白胶束和可溶性矿物质的分布,尤其是钙和磷离子含量,影响酪蛋白胶束的大小和稳定性[23]。但矿物元素分布不受蛋白质遗传多态性的影响。Ca2+有助于凝乳酶凝结,但不能促进酸凝结[22]。高钙含量会促使酪蛋白胶束凝结,从而提高干酪产量。离子钙的积极作用体现在通过改善聚集过程中的相互作用,降低了酪蛋白的表面电荷等方面[24]。另外,在凝乳酶诱导过程中,当超过85%的κ-CN水解时,酪蛋白胶束会大量聚集。疏水相互作用和钙键是凝乳酶诱导的凝胶的主要作用力。Jensen等[1]研究表明胶束矿物元素分布比例与泌乳阶段差异有关。
表5 牛乳组成和矿物质成分(x±s)与凝乳等级的关系Table 5 Milk composition and mineral composition (x ± s) as a function of milk coagulation grades

表5 牛乳组成和矿物质成分(x±s)与凝乳等级的关系Table 5 Milk composition and mineral composition (x ± s) as a function of milk coagulation grades
注:*.P<0.05,差异显著;**.P<0.01,差异极显著;***.P<0.000 1,差异高度显著。基于ANOVA检验计算显著性。
检测项目 WC PC NC 显著性测定值 最小值 最大值 测定值 最小值 最大值 测定值 最小值 最大值牛乳成分及pH值脂肪/(g/100 mL) 3.86±0.73 2.24 5.33 3.77±0.89 2.24 5.88 3.72±0.59 2.92 5.01 NS pH 6.76±0.10 6.53 6.96 7.08±0.14 6.75 7.38 7.16±0.13 6.97 7.44 ***乳糖/% 5.23±0.12 4.90 5.45 5.22±0.21 4.14 5.46 5.19±0.10 4.98 5.40 NS蛋白质/(g/100 mL) 3.34±0.24 2.94 4.10 3.27±0.26 2.74 4.19 3.07±0.27 2.77 3.35 *酪蛋白/(g/100 mL) 2.23±0.08 2.45 2.18 2.13±0.15 2.32 2.02 2.05±0.21 2.12 1.95 *乳清蛋白/(g/100 mL) 0.59±0.02 0.56 0.62 0.59±0.04 0.54 0.65 0.61±0.06 0.54 0.71 NS体细胞数 163±157.07 17 487 177.19±259.04 10 1427 314.80±429.51 18 1 367 NS盐分布总Ca/(mg/kg) 1 205.44±139.04 1 016.41 1 265.65 1 097.89±54.08 949.27 1156.13 978.35±61.29 849.44 1 070.75 *可溶相Ca/(mg/kg) 467.46±100.02 323.31 509.73 451.86±44.57 408.39 497.45 436.34±60.67 366.80 478.49 *胶体Ca/(mg/kg) 667.98±132.70 524.51 786.31 546.03±57.95 490.83 606.39 582.01±216.71 370.95 803.95 NS总Mg/(mg/kg) 108.38±7.47 99.77 113.08 108.20±1.69 106.37 109.70 106.55±20.04 84.53 123.72 *可溶相Mg/(mg/kg) 69.30±6.09 64.15 76.02 77.28±6.32 70.50 83.03 71.71±3.84 69.26 76.13 NS胶体Mg/(mg/kg) 39.08±13.46 23.74 48.93 30.92±5.20 25.49 35.87 34.84±19.84 14.79 54.46 NS总P/(mg/kg) 991.88±204.48 827.07 1 220.70 957.24±57.13 891.69 996.47 1 020.84±217.77 780.59 1 205.25 NS可溶相P/(mg/kg) 464.48±94.95 385.14 569.68 531.01±66.83 477.10 605.78 534.65±44.49 501.38 585.19 NS胶体P/(mg/kg) 527.40±131.96 388.44 651.02 426.23±55.20 377.78 486.33 486.19±204.37 279.21 687.85 NS
WC牛乳体细胞数明显低于NC及PC牛乳样品,体细胞数含量越高,MCP越差,当然还包括有乳房炎的个体牛,泌乳量减少,牛乳中体细胞数含量增加。体细胞数增加与纤溶酶活性高有关,纤溶酶会影响乳蛋白含量进而影响凝乳。另外乳蛋白和和乳脂肪含量越高,牛乳的凝乳效果越好[25]。凝乳过程包含多种机制,如已知pH值的变化会影响酶的活性,证明纤溶酶在低pH值牛乳中的活性较低[26-27]。乳糖含量与MCP呈正相关趋势,在WC牛乳样品中含量略有增高,但其中机制尚不清楚。有解释说乳糖是牛乳中重要的渗透调节剂,当乳腺发炎时,血液中的离子流入乳汁的量增加,会导致高体细胞数乳汁中的电导率增加和乳糖含量降低。在PC或NC牛乳中,乳脂含量低于凝乳中乳脂含量,但这一结果与Jensen[1]的结果相符。
另外,结果显示WC牛乳样品的pH值整体比PC和NC牛乳样品低,可能是由于在高pH值下溶解胶束P和Ca的时间更长,所以pH值越高,MCP越差[28]。不同MCP牛乳中乳蛋白含量无明显差异或显著趋势,但总蛋白中酪蛋白含量与凝乳性能呈正相关趋势,牛乳中酪蛋白含量越高,MCP越好,凝乳时间越短,凝胶强度越高。
2.5 毛细管电泳和高效液相色谱HPLC检测结果
由图2可知,利用毛细管区带电泳法可快速地检测出牛乳中几种蛋白质。通过峰形和峰值的对比,WC牛乳样品的β-CN的大部分样品都存在2 个峰,并且在NC牛乳样品中其他小峰,可能是水解产物,或者蛋白磷酸化水平较高。国外相关使用毛细管电泳法判断乳酪发酵过程中酪蛋白含量变化发现牛乳的特征也很明显。

图2 3种牛乳样品毛细管电泳图Fig.2 Capillary electrophoregrams of α-LA, β-LG and CNs in milk samples with different coagulation abilities
由图3可知,液相色谱结果和毛细管电泳结果相互对应,WC牛乳蛋白相对含量比PC和NC高,PC和NC牛乳样品的图谱中出现了除主要乳清蛋白和酪蛋白5种蛋白的其他峰值,可能是在PC和NC牛乳样品中的其他种类蛋白含量较多,如proteolyticβ-CN、para-κ-CN等一些磷酸化程度较高的蛋白峰。乳蛋白质的多态性不仅表现在蛋白质的种类和不同遗传变异体上,而且还表现在蛋白质翻译后的修饰上,如磷酸化、糖基化、二硫键的形成及蛋白质的水解。
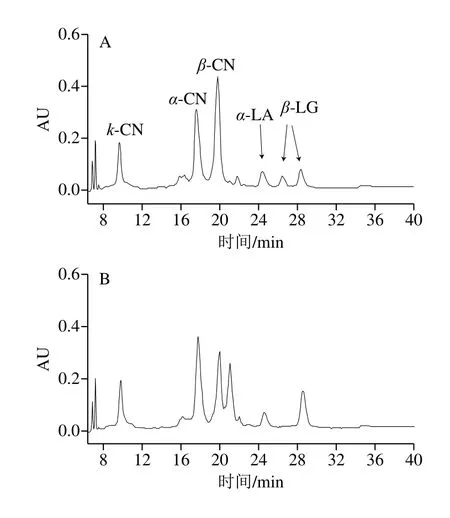

图3 不同凝乳特性牛乳的液相色谱图Fig.3 HPLC profiles of α-LA, β-LG and CNs in milks with different coagulation properties
牛乳中含有4种不同的酪蛋白,分别为αS1-、αS2-、β-和κ-CN,占总酪蛋白的比例分别约为37%、10%、35%和12%,牛乳中蛋白的相对含量如表6所示。检测前,已将不同类型牛乳蛋白含量规范到相同浓度。已有研究提出,κ-CN在凝乳酶诱导凝乳过程中起着至关重要的作用,κ-CN含量越高,牛乳凝乳能力越高,特别源自占主要比例的未糖基化κ-CN 1P的影响最大,在其他研究中,发现NC牛乳中的κ-CN含量较低[9],较高的κ-CN含量可以改善牛乳的整体凝结能力。

表6 牛乳中蛋白的相对含量Table 6 Relative contents of milk proteins
κ-CN上的碳水化合物使其具有亲水性和较高的水溶性。当凝乳酶作用时,含有碳水化合物的C-末端被水解下来,形成糖巨肽,糖巨肽结构域消除了胶束的极性静电和空间稳定作用,增加了表面疏水性并导致凝块形成[29-30]。Frederiksen等[11]指出,在PC牛乳中κ-CN含量相对较低,αS1-、αS2-CN的磷酸化程度较高,κ-CN的AA型蛋白是导致PC和NC牛乳不凝的重要因素,但只靠它本身的强度并不够,主要是乳蛋白之间存在紧密的遗传联系,并且高含量κ-CN与较小的胶束有关,与凝胶强度呈正相关。但κ-CN含量的增加会使酪蛋白总体含量增加[23],而不是仅κ-CN相对含量的变化,这是一个整体关联的关系。Wedholm等[31]指出,PC和NC牛乳样品主要与κ-CN在总酪蛋白中含量较低有关,此外,AB基因型牛乳中κ-CN浓度高于AA基因型。对于总酪蛋白和β-LG含量相当的牛乳而言,选择高浓度的αS1-、β-和κ-CN牛乳可以提高奶酪制作性能。
3 结 论
本研究统计分析的奶牛样本中,β-LG AB基因型最常见,研究发现β-LG基因型为AA的牛乳比基因型为BB或AB的牛乳更适于加工干酪,前者可以加快凝乳速度并且能够获得更高的干酪产量,这可能是由于含基因型AA的β-LG的牛乳通常酪蛋白含量较高所致;κ-CN BB基因型具有较好MCP,较AA、AB等其凝乳时间更短和凝胶强度更强。WC的样品中酪蛋白含量及钙离子含量较高,总胶体钙含量越高,对酶凝胶越有利;此外,WC牛乳的pH值较PC和NC牛乳样品低。凝结受κ-CN含量的有利影响,酪蛋白和乳清蛋白组成和基因频率的变化会影响MCP的变化。牛乳中α-LA对酶凝具有不利影响,相反,κ-CN相对含量越高,MCP越好。
乳蛋白的遗传多态性主要影响牛乳蛋白的相对含量及其磷酸化和糖基化程度,对凝乳的影响主要是通过影响蛋白含量而产生间接影响,未来需要进一步评价牛乳蛋白组成和翻译后修饰对凝乳能力的影响,但此研究结果表明,酪蛋白牛乳和乳清蛋白基因座处的牛乳蛋白组成和基因频率的变化对牛乳的凝结特性产生影响。牛乳蛋白质组分含量和蛋白质组成的遗传参数,需要进一步研究。

