磷酸二丁酯在2.0 mol/L HNO3 介质中的水解动力学
周沐春,费 玲,陈 涛,孙孝群,唐双凌
南京理工大学 环境与生物工程学院,江苏 南京 210000
在乏燃料后处理PUREX 流程中,通常采用磷酸三丁酯(TBP)-稀释剂/HNO3作为萃取体系,HNO3浓度一般为2.0 mol/L[1-2]。由于酸性环境和高放废液的辐照作用,TBP 首先水解产生磷酸二丁酯(HDBP),HDBP 继续逐级水解成磷酸一丁酯(H2MBP)与,水解过程中产生的丁醇,可以与HNO3发生氧化、硝化裂解和热解等反应[3-4]。TBP-HNO3体系可以看作以TBP及其水解产物为还原剂、HNO3为氧化剂的氧化还原反应,该反应在一定温度下可能发生热失控现象,分解产生的气体产物和能量如果不能及时释放出去,就会引起容器超压,严重时还会导致“红油”爆炸事故的发生[5-6],存在一定的安全隐患。
HDBP作为TBP的次级降解产物,同时是主要降解产物之一,在体系TBP浓度基数大的情况下,水解产生的量较多[7-8]。由 于H2MBP 在HNO3中的溶解度较高,能够促进HDBP共同溶解,因此HDBP-HNO3体系在反应过程中更容易由不相溶的两相变为均相,发生热失控的几率也会增加,可能会给后处理工艺带来不利影响。研究HDBP 的水解反应动力学,便于完善TBP 水解产物对萃取体系原组分的影响,了解水溶性产物与HNO3反应的热危险性,为后续反应机理以及热力学研究提供参考[9-11]。
以往的文献中,针对HDBP反应动力学展开的研究很少,涉及HDBP水解的数据几乎完全缺乏[12]。根据磷酸酯的性质推测HDBP的水解行为接近TBP,水解反应速率与温度、辐射剂量和HNO3浓度等因素有关[13]。关于HDBP-HNO3体系的分析方法中,离子色谱法能够同时对体系中水溶性离子DBP-、MBP2-、和的含量进行检测[14-17],经预实验优化后的离子色谱分析方法无需过多前处理步骤,所用试剂少,简单快捷,且测试灵敏度较高。本工作拟使用红外光谱、气质联用和离子色谱等分析方法对HDBP-HNO3体系中的水溶性产物进行定性分析,并通过离子色谱外标法对水解产物浓度变化情况进行定量分析,探究2.0 mol/L低HNO3浓度下反应温度与时间对HDBP水解反应速率的影响,分析水解反应动力学。
1 实验部分
1.1 主要试剂及仪器
磷酸二丁酯(HDBP),97%(质量分数),分析纯,南京娇子藤科学器材有限公司;HNO3,质量分数为68%,南京化学试剂公司。
50 mL水热反应釜,南京大卫仪器公司,设计压力为30 MPa;NICOLET IS10型红外光谱仪,美国赛默飞公司;GCMS-QP2020NX 型气相色谱-质谱联用仪、SH-Rsi-5Sil MS 型色谱柱,日本岛津;940 Professional IC Vario型离子色谱仪、Metrosep A Supp 7-250/4.0型分离柱、Metrosep A Supp 5 Guard/4.0型保护柱,瑞士万通;DGH-9920A 型电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;分析天平,精度0.1 mg,梅特勒公司;N-1300EYELA 旋转蒸发仪,日本东京理化公司。
1.2 实验方法
1.2.1 反应步骤 用分析天平准确称取一定质量的HDBP 和2.0 mol/L 的HNO3于聚四氟乙烯内衬中,并将内衬装入水热釜中,安装完毕后将水热釜放入恒温干燥箱中进行恒温加热反应,到达反应预设时间后取出水热反应釜,经骤冷过程处理后取出反应产物进行分析测试。随着反应时间与温度的变化,反应呈现油-水分层的两相与混溶的均相两种情况,若体系呈两相,将水相与有机相静置分层后,分离下层水相至干净的样品瓶中;若体系呈均相,则直接将产物取至样品瓶中。部分样品使用超纯水稀释一定倍数后用于离子色谱分析,部分样品使用二氯甲烷萃取3~4次后分液,经过无水硫酸钠进行干燥后使用旋转蒸发仪除去二氯甲烷,将预处理后的有机相用于定性分析测试。
1.2.2 气相色谱-质谱(GC-MS)联用分析 色谱分析条件:以二氯甲烷为溶剂;SH-Rsi-5Sil MS型色谱柱,柱长30 m,内径0.25 mm,0.25 um df(df为色谱柱液膜厚度);柱箱温度50℃,进样温度250℃,进样模式为分流;压力控制为53.5 kPa;总流量14.0 mL/min;柱温箱温度程序:50 ℃保持3.0 min,以15.0 ℃/min 升温至280 ℃,保 持5.0 min。质谱分析条件(EI):离子源温度200℃;接口温度250℃;溶剂延迟时间1.50 min;开始时间2.00 min;结束时间23.33 min;采集方式,扫描;间隔,0.30 s;扫描范围,m/z=33~650。
1.2.3 离子色谱分析 柱温箱温度45.0 ℃;标准柱压9.7 MPa;Metrosep A Supp 5 Guard/4.0保护柱,含有与色谱柱相同的分离材料,最大压力15.0 MPa;淋洗液:2.0 mol/L Na2CO3和5.0 mmol/L NaOH;淋洗液流速0.7 mL/min;电导检测器使用945 Professional Detector Vario 1,实验数据的采集和系统操作使用Mag IC Net色谱工作站。离子色谱法测试过程使用超纯水,同一样品进行3组平行实验。
1.2.4 离子色谱标准曲线的建立 配制质量分数分别为1×10-4的HDBP、、H2MBP标准物质于100 mL 容量瓶中,充分混合摇匀后进行测试,确定四种离子的保留时间。样品的定量分析采用离子色谱的外标法,配制质量分数分别为1×10-3的HDBP、和H2MBP的标样储备液,再将储备液分别逐级稀释成质量分数为1×10-6、5×10-6、10×10-6、50×10-6、200×10-6的梯度标准溶液,绘制标准曲线,用于测定处理后的样品。
1.3 水解反应速率计算方法
大多数研究都认为HDBP-HNO3体系的反应是一级反应,也有研究表明,在HNO3浓度为1.5~3.0 mol/L 时,HDBP 的水解反应速率与HNO3浓度无关[18]。假设HDBP 水解反应过程中pH 值不变,反应速率仅随HDBP浓度的变化而变化,可以认为该水解过程是准一级反应,采用连续反应动力学对HDBP水解过程进行分析,反应动力学方程式[19]为:

式中:k1为一级水解反应速率常数;k2为二级水解反应速率常数;ct(HDBP)、ct(H2MBP)、分别为经过反应时间t后HDBP、H2MBP的浓度,其实际浓度均可通过实验测得相应值;生成H2MBP 的速率等于其生成速率与消耗速率之差。
2 结果与讨论
2.1 HDBP-2.0 mol/L HNO3 体系水溶性产物定性分析
2.1.1 红外光谱分析结果 图1为HDBP-2.0 mol/L HNO3体系水溶性产物的红外光谱(IR)图。由图1可知,736 cm-1与1 264 cm-1处对应二氯甲烷的特征峰,1 712 cm-1处为的特征峰,2 800~3 200 cm-1处的连续峰对应C—H 烷基链上的伸缩振动,3 000~3 500 cm-1处还出现一个峰形宽大的特征峰,对应—OH 的伸缩振动。因此可以推断出产物中存在醇类与酸类物质,推测为丁醇与丁酸。

图1 HDBP-2.0 mol/L HNO3 体系产物的IR 图Fig.1 Infrared spectrum of products of HDBP-2.0 mol/L nitric acid system
2.1.2 GC-MS分析结果 对HDBP-2.0 mol/L HNO3体系反应产物进行GC-MS 分析,得到气相色谱的物质保留时间示于图2。通过谱图库检索以及标准物质对比,确定了保留时间2.30 min处对应丁醇,保留时间2.89 min处为丙酸,保留时间3.99 min处为丁酸,14.25 min处对应HDBP的特征峰,图谱检索结果匹配度较高,均在95%以上。

图2 HDBP-2.0 mol/L HNO3 体系产物的GC图Fig.2 Gas chromatography of products of HDBP-2.0 mol/L nitric acid system
2.1.3 离子色谱分析结果 标准物质混合液离子色谱图示于图3。如图3所示,测得HDBP 的保留时间为15.71 min,的保留时间为19.04 min,H2MBP 的保留时间为22.40 min,的保留时间为31.48 min。采用离子色谱法测得HDBP、、H2MBP 与标准曲线的线性相关系数均在0.999以上。

图3 HDBP、、H2 MBP和标准物质混合液离子色谱图Fig.3 Standard chromatogram of HDBP,,H2 MBP andmixture
2.2 反应时间与温度对水解反应产物浓度的影响
2.2.1 不同温度下HDBP、H2MBP 与含磷量的变化情况 在HDBP与2.0 mol/L HNO3的物质的量之比为0.3∶2.0的条件下,HDBP的初始浓度为0.3 mol/L。为探究反应时间与温度对水解产物的影响,反应时间选择6.0、12.0、24.0、48.0、72.0 h,在同样的条件下,改变反应温度,得 到110、120、130、140、150 ℃下HDBP-2.0 mol/L HNO3体系中HDBP、H2MBP 与三者含磷量占总磷的比例(W)随反应时间的变化趋势,结果示于图4。当反应温度为110 ℃时,如图4(a)所示,HDBP 含磷量占总磷的比例(W(HDBP))整体呈下降趋势,H2MBP 与含磷量占总磷的比例呈上升趋势,此时,随着时间的增加,HDBP不断水解产生H2MBP,由于110℃条件下HDBP 水解速率较慢,H2MBP 与的生成速率也相对较低。反应温度提高至120℃时,HDBP与H2MBP的降解与形成过程如图4(b)所示,反应时间达到24.0 h时W(HDBP)低于50%,即24.0 h之内HDBP的水解率超过50%,此时体系中的HDBP基本全部溶解至HNO3中,有机相消失,整个体系中只有水相存在。当反应进行到72.0 h时,HDBP的水解率达到80%。在120 ℃条件下,W(H2MBP)随时间先增加后逐渐降低,在24.0 h左右达到最大值,而始终随时间的增加而不断增加,最终趋于恒定,且与图4(a)相比,达到恒定值所需的时间更短,说明温度升高导致HDBP的一级水解反应速率与二级水解反应速率均加快。当反应温度继续升高至130℃与140 ℃,如图4(c)与图4(d)所示,HDBP、H2MBP与三者含磷量占总磷的比例变化趋势与120 ℃条件下的情况相似,三者浓度最终均达到一个相对恒定的数值,且达到平衡的时间不断缩短,可以认为温度升高加快了反应的进程。当反应温度为150 ℃时,如图4(e)所示,HDBP反应6.0 h后就基本水解完全,W(H2MBP)与的数值也趋于恒定。

图4 不同温度下HDBP、H2 MBP和含磷量占总磷比例的变化趋势Fig.4 Trends of proportion of HDBP,H2 MBP andto total phosphorus at different tempretures

图5 不同温度下(a)和(b)浓度随反应时间的变化Fig.5 Change of concentration of (a)and (b)with reaction time at different temperatures
2.3 水解速率常数计算及动力学研究
2.3.1 水解速率常数计算 为了进一步探究温度对HDBP水解反应速率的影响,采用连续反应动力学模型对不同温度下HDBP 的一级水解速率常数k1以及二级水解速率常数k2进行计算,用于后续反应动力学研究。对式(1)—(3)的连续反应动力学方程进行微分求解,式(1)的微分计算结果见式(4):

式中:ct(HDBP)为反应t时刻HDBP 的浓度,mol/L;c0(HDBP)为反应物HDBP的起始浓度,mol/L;k1为一级水解反应速率常数,s-1;t为反应时间,h。结合实验测得的HDBP 浓度数据,采用Origin软件对式(4)进行非线性拟合,拟合结果示于图6(a)。将式(4)代入式(2),求解关于H2MBP浓度的一阶线性微分方程,结果如式(5)所示:
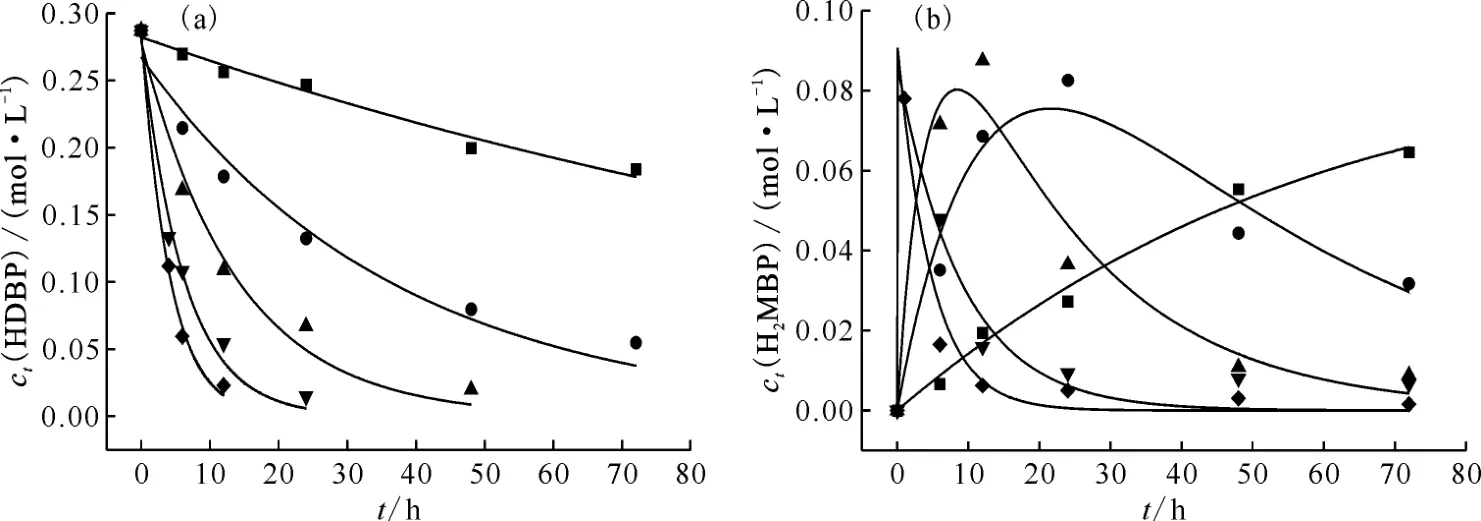
图6 不同温度下水解反应速率常数k1(a)与k2(b)的拟合图Fig.6 Fitting diagram of hydrolysis rate constants k1(a)and k2(b)at different temperatures

结合式(6)所示HDBP水解反应方程中ct(HDBP)、三者浓度的关系,对式(4)—(6)进行整合,得式(7):

式中:ct(H2MBP)、为反应t时 刻H2MBP和的浓度,mol/L;k2为二级水解反应速率常数,s-1;t为反应时间,h。根据已拟合得到的一级水解速率常数k1,结合H2MBP 的净生成浓度数值,对式(5)进行多参数非线性拟合,得到二级水解速率常数k2,拟合结果示于图6(b)。110~150 ℃条件下,HDBP-2.0 mol/L HNO3体系水解反应速率常数k1与k2的拟合结果汇总于表1。如表1所示,随着温度的升高,水解反应速率常数k1与k2均增大,在110~150 ℃高温环境中,k1与k2的拟合值相差不大,k1略大于k2,且温度越高,二者的数值越接近。

表1 不同温度下的分级水解速率常数拟合Table 1 Fractional hydrolysis rate constants at different temperatures
2.3.2 半寿期计算 半寿期即为化合物转变为原来一半时所需的时间。由反应动力学方程可知,当c=c0/2时,HDBP-2.0 mol/L HNO3体系水解反应半寿期t1/2=ln2/k(k为反应速率常数)。在110~150 ℃条件下,HDBP 半寿期的计算结果列于表2,110℃与150℃半寿期数值相差约70倍,温度的升高导致反应速率大幅度提高。
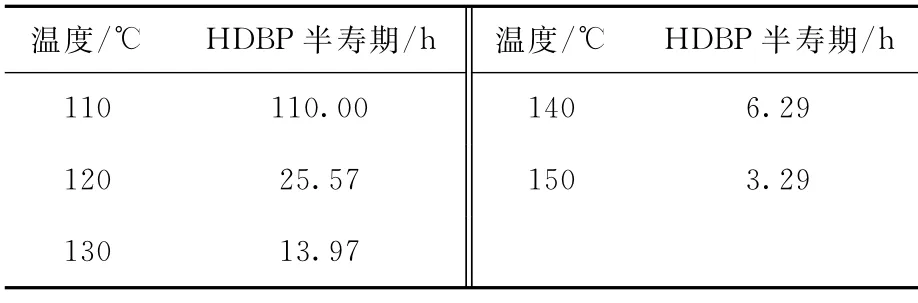
表2 不同温度下HDBP的半寿期计算值Table 2 Half-life calculated values of HDBP at different temperatures
2.3.3 水解反应的动力学研究 根据Arrhenius定理对HDBP-2.0 mol/L HNO3体系水解反应的反应活化能以及指前因子进行推导,方程如式(8)和式(9)所示:

式中:T为反应系统的温度,K;k为反应速率常数,s-1;E为反应活化能,kJ/mol;A为指前因子,s-1;R为通用气体常数,J/(mol·K)。采用表1中拟合的水解反应速率常数值,以lnk对1/T作图拟合得到一条直线,线性方程为:一级水解反应,y1=-1.33×104x+29.87,r2=0.97;二级水解反应,y2=-1.62×104x+36.85,r2=0.97。由直线的斜率和截距可得活化能E和指前因子A,即HDBP-2.0 mol/L HNO3体系一级水解反应的指前因子A1为9.38×1012s-1,活化能E1为111.0 kJ/mol;二级水解反应的指前因子A2为1.09×1016s-1,活化能E2为135.2 kJ/mol。

图7 浓度实验值与计算值的对比结果Fig.7 Comparison results of experimental and calculated values of PO3-4
3 结论
(1)通过红外光谱仪、GC-MS和离子色谱仪等分析手段确定了HDBP-2.0 mol/L HNO3体系的水溶性产物,主要包括H2MBP、、丁醇、丁酸和丙酸。
(2)通过离子色谱测试水相中HDBP、H2MBP、的浓度随时间与温度的变化关系,结果表明,随着反应时间的增加,水相中的HDBP浓度不断降低,H2MBP 先增大后降低,始终呈上升趋势最终达到一个恒定值,而与相反,始终呈下降趋势直至反应基本完全。
(3)根据连续反应动力学方程对HDBP、H2MBP和的浓度数据进行拟合,计算一级水解反应速率常数k1和二级水解反应速率常数k2,在110~150 ℃范围内,二者随温度的升高而增大,水解速率常数k1始终大于k2,且温度越高,k1与k2的拟合值越接近。根据不同温度下的速率常数进行动力学分析,通过拟合动力学方程得到,一级水解反应的指前因子为9.38×1012s-1,对应的活化能为111.0 kJ/mol,二级水解反应的指前因子为1.09×1016s-1,对应的活化能为135.2 kJ/mol。动力学计算值与实验值的误差在±9%以内,可为后续HDBP 与高浓度硝酸体系的反应机理以及热力学研究提供参考。

