DI-CTP联合MRI-STIR在肺癌淋巴结转移术前诊断中的应用
王成均 何灿 曾幸萍 古艳华
随着全球空气质量每况愈下,对人体呼吸系统造成极大影响,其中肺癌作为恶性肿瘤中的头号杀手,已成为人类发病率和死亡率最高的癌症[1]。手术是治疗肺癌患者的重要治疗手段,患者手术治疗方案及预后评估与肺癌的纵隔淋巴结转移情况、准确分期密切相关,术前在肺癌诊断中明确病情的分期、纵隔淋巴结转移情况,有助于针对患者病情制定最佳的治疗方案,提高患者预后[2]。随着医学影像技术的发展,放射技术在肺癌患者综合治疗中得到越来越广泛的应用,其中CT及磁共振成像检查技术具有多个断层和组织对比、多种序列成像等特点,在临床诊断中可以获得丰富的影像学信息[3-4]。双重血供CT灌注(DI-CTP)作为一种无创性功能学检查方法,其能够同时捕捉到肺动脉、主动脉及病灶的动态强化特征,从而获取反映肺部病变血供的参数,在肺内病灶的诊治中具有重要意义[5]。核磁共振短时间反转恢复序列(MRI-STIR)以其优秀的组织对比和多断面、多序列影像等特点,在肺癌诊断中具有重要价值[6]。基于此,本研究通过探讨DI-CTP联合MRI-STIR在肺癌淋巴结转移术前诊断中的应用价值。
1 资料与方法
1.1 一般资料
选取2019年1月-2020年12月在本院接受诊治的经穿刺或术后病理检查确诊为肺癌患者80例。纳入标准:(1)预估生存期大于3个月;(2)经穿刺或术后病理检查确诊为肺癌;(3)扫描资料及临床病历资料完整。排除标准:(1)图像资料质量较差,无法用于定量分析;(2)合并其他恶性肿瘤、肺部感染;(3)对碘对比剂过敏。根据患者淋巴结是否发生转移分为转移组(n=33)和未转移组(n=47)。未转移组:男22例,女25例;年龄41~85岁,平均(64.55±9.37)岁;肺癌T分期包括T1期4例,T2期8例,T3期18例,T4期17例。转移组:男15例,女18例;年龄40~86岁,平均(63.62±10.45岁);肺癌T分期包括T1期13例,T2期10例,T3期7例,T4期3例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 DI-CTP检查 采用64层螺旋CT扫描仪(德国西门子公司AS64)对患者胸部及上腹部进行扫描。扫描参数:扫描层的厚度定为5 mm,间距5.0 mm,螺距为0.984∶1。嘱患者调整呼吸,经肘静脉以采用80 ml碘佛醇对比剂(江苏恒瑞医药股份有限公司,国药准字 H20067896,规格:50 ml∶33.9 g)对患者进行肘静脉高压注射,注射速率为5.0 ml/s。注射后立即进行灌注扫描,扫描范围包括左心房及病变区域、胸主动脉、肺动脉主干,每隔2 s扫描一个序列,总共获得15个扫描序列。扫描完毕后将图像送至工作站进行图像处理。获取灌注指数(PI)、支气管动脉血流量(BAF)、肺动脉血流量(PAF)伪彩图。由2名具有超过5年阅片经验的影像科医师进行独立阅片,避开肉眼可见的钙化、液化坏死、血管、肺组织等,每个病灶勾画三个感兴趣区域(ROI),获取三项灌注参数值。
1.2.2 MRI-STIR检查 采用飞利浦公司生产的1.5 T超导型核磁共振扫描仪对患者进行MRI-STIR检查,采用8通道体部正交线圈,患者采取仰卧位,要求患者按照呼吸训练的操作进行调整呼吸,由头部进入,扫面范围为胸部及上腹部。扫描参数设置:矩阵128×128,层厚为 5 mm,翻转角 15°,层间距为 1 mm,TR 6 000 ms,TE 57.9 ms,b 值为 500 s/mm2,扫描时间为 3 min,激励次数4,总体扫描时间约为13 min。扫描完毕后将图像送至工作站,由2名具有超过5年阅片经验的影像科医师进行独立阅片,选择ROI,测量其表观扩散系数(ADC)值为淋巴结ADC。在原发病灶上勾画三个ROI,选取ROI时需避开肉眼可见的钙化、液化坏死、血管、肺组织等,测量原发病灶的ADC值为原发灶ADC,测量三次,取平均值。计算ADC原发灶和ADC淋巴结的差值绝对值D-value=|原发灶ADC-淋巴结ADC|。
1.3 观察指标
1.3.1 参数水平比较 比较两组DI-CTP参数水平:PI、BAF、PAF;比较两组MRI-STIR检查相关参数水平:淋巴结ADC值、D-value。
1.3.2 诊断价值 采用ROC曲线下面积(AUC)分析,比较DI-CTP和MRI-STIR各参数对肺癌淋巴结转移术前诊断的诊断价值,其中AUC≥0.9表示诊断价值高,0.7≤AUC<0.9表示诊断价值中等,0.5<AUC<0.7表示诊断价值低。
1.4 统计学处理
本研究数据采用SPSS 20.0统计学软件进行分析和处理,采用受试者工作特征(ROC)曲线下面积(AUC)分析各参数的诊断价值,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组DI-CTP参数水平比较
两组PAF水平比较差异无统计学意义(P>0.05),转移组BAF水平明显高于未转移组(P<0.05),PI水平明显低于未转移组(P<0.05),见表1。
表1 两组DI-CTP参数水平比较(±s)
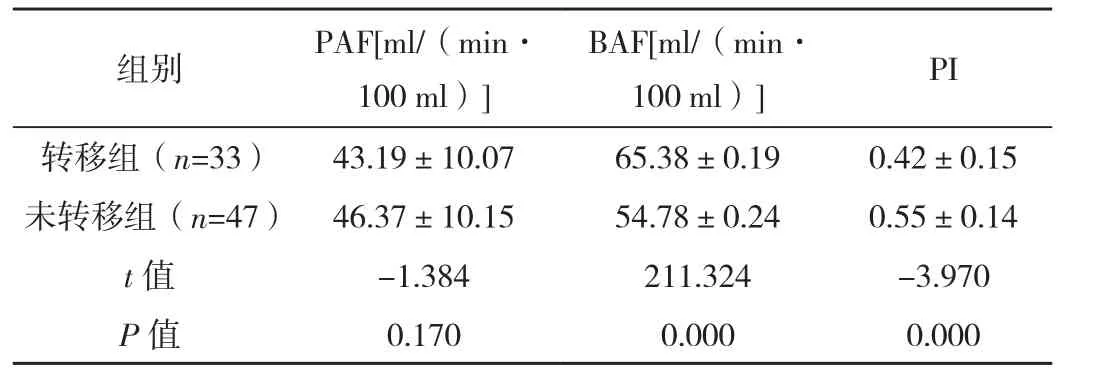
表1 两组DI-CTP参数水平比较(±s)
组别 PAF[ml/(min·100 ml)]BAF[ml/(min·100 ml)] PI转移组(n=33) 43.19±10.07 65.38±0.19 0.42±0.15未转移组(n=47) 46.37±10.15 54.78±0.24 0.55±0.14 t值 -1.384 211.324 -3.970 P值 0.170 0.000 0.000
2.2 两组MRI-STIR参数水平比较
转移组淋巴结ADC值、D-value明显低于未转移组(P<0.05),见表 2。
表2 两组MRI-STIR参数水平比较[×10-3mm2/s,(±s)]
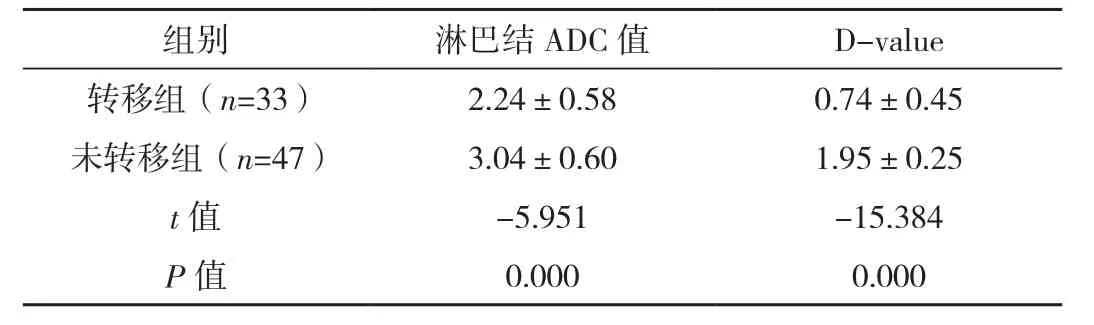
表2 两组MRI-STIR参数水平比较[×10-3mm2/s,(±s)]
组别 淋巴结ADC值 D-value转移组(n=33) 2.24±0.58 0.74±0.45未转移组(n=47) 3.04±0.60 1.95±0.25 t值 -5.951 -15.384 P值 0.000 0.000
2.3 DI-CTP、MRI-STIR单独及联合诊断肺癌淋巴结转移的诊断价值比较
DI-CTP、MRI-STIR单独及联合诊断肺癌淋巴结转移的 AUC值分别为 0.702、0.773、0.871(P<0.05),见表3、图1。

表3 DI-CTP、MRI-STIR单独及联合诊断肺癌淋巴结转移的诊断价值比较

图1 DI-CTP、MRI-STIR单独及联合检测的ROC曲线
3 讨论
近年来,肺癌的发病率逐年上升,已成为我国恶性肿瘤的头号杀手。手术是治疗肺癌患者的重要治疗手段,而术前评估纵隔淋巴结转移情况进行临床分期,对最佳手术治疗方案的选择至关重要,因此,临床备受关注评估肺癌患者术前淋巴结受累的检查方法的选择。据临床研究表明,常规CT检查难以准确反映肺部病变的血流灌注特点,在预测肺癌患者淋巴结是否发生转移方面特异性和灵敏性较低,检查效果并不理想[7]。DI-CTP能够获取反映肺部病变血供的参数,从而有效评价组织血流供应情况,在肺内病灶的诊治中具有重要意义。MRI-STIR以其优秀的组织对比和多断面、多序列影像等特点,在肺癌诊断中具有重要价值。本研究发现,DI-CTP联合MRI-STIR在肺癌淋巴结转移术前诊断中具有较好的诊断价值。
DI-CTP成像探测器在Z轴方向有较宽的覆盖范围,一次曝光扫描范围即可覆盖大部分成人肺脏,同时可以获得关于病灶、肺动脉、主动脉的动态强化特征信息,准确地反映恶性肿瘤组织血流灌注情况[8]。本研究结果发现,两组PAF水平比较差异无统计学意义(P>0.05);转移组PI水平明显低于未转移组,BAF水平明显高于未转移组(P<0.05)。提示淋巴结转移的肺癌以支气管动脉供血为主,BAF、PI水平变化可能影响术前肺癌淋巴结转移。BAF能够反映组织中毛细血管的数量。恶性肿瘤的发生发展主要表现为小血管数量的增加及结构的异常,支气管动脉是肺癌的主要供血动脉,而据临床研究发现,肺癌的淋巴结转移与原发肿瘤的血流动力学状态密切相关[9]。因此BAF及PI可作为预测淋巴结是否转移的重要参数。
MRI-STIR是一种抑脂技术,脂肪组织被抑制出现不了磁共振信号,而水的磁共振信号被增强。此外,MRI-STIR在抑制脂肪信号的同时,能够明显周边组织信号与强化淋巴结信号之间的差异,有助于发现增大的淋巴结[10]。本研究结果发现,肺癌患者淋巴结转移组淋巴结ADC值、D-value值明显低于未转移组。ADC值是定量描述水分子扩散受限程度的参数,能反映机体不同组织的病理学特点,据临床研究发现,组织内细胞密度、细胞膜结构、细胞外间隙、核浆比均会影响水分子扩散程度[11]。临床研究证实,转移性淋巴结中正常结构已被恶性肿瘤组织代替,淋巴结内细胞密度较高,水分子的弥散能力明显下降,故其ADC值低于具有正常组织结构的淋巴结[12]。此外,转移性淋巴结组织结构更接近原发灶,故其淋巴结ADC值与原发灶ADC值相近,与非转移性淋巴结相比,具有更低的D-value值。
本研究ROC曲线结果显示,DI-CTP、MRI-STIR单独及联合诊断肺癌淋巴结转移的AUC值分别为0.702、0.773、0.871,说明两种检查方法均可作肺癌淋巴结转移术前诊断的检测方法。此外,DI-CTP联合MRI-STIR诊断肺癌淋巴结转移的AUC值为0.871,可见两种检查方法联合在肺癌淋巴结转移患者的诊断中结果更为准确,具有较高的临床诊断价值。
综上所述,DI-CTP、MRI-STIR对肺癌淋巴结转移的术前诊断均具有中等程度价值,且DI-CTP联合MRI-STIR在肺癌淋巴结转移患者的诊断中结果更为准确,具有较高的临床诊断价值。

