低分子肝素联合奥曲肽治疗急性胰腺炎的临床效果及对血流动力学的影响
周章玉 张婷
急性胰腺炎(AP)是常见的一种急腹症,具有发病急、发展快、病死率高的特点,在短时间内会损伤多个器官,对患者的生命健康造成严重的危害[1]。该病的发病机制暂不明确,较多学者表明,该病的发生与饮食不节、胆道病史有关,其会激活机体中的胰酶,导致机体中的炎性介质大量增加[2]。目前临床多通过药物治疗AP,既往多给予补液、胃肠减压及抑酸等治疗,但效果不理想。近几年,有研究表明,针对AP患者通过抑制炎性反应和胰酶分泌的治疗方法,具有较好的效果[3]。低分子肝素是常用的一种抗凝剂,可以加速患者的血液微循环,从而预防缺血和坏死的发生;而奥曲肽则是常用的一种生长抑素类似物,可以保护胰腺细胞,对胰腺的分泌进行抑制。本文主要探讨低分子肝素联合奥曲肽治疗AP的效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年12月-2020年12月笔者所在医院收治的80例AP患者,纳入标准:血清淀粉酶(AMS)水平不在正常范围;确诊为AP。排除标准:对本研究所用药物过敏;身体重要器官存在严重疾患;合并有免疫学疾病;有认知或语言障碍;需要手术治疗;有严重感染性疾病;有精神病史;有血液或免疫系统疾病;有恶性肿瘤。将其随机分为两组,每组40例。研究组男24例,女16例;病程2~36 h,平均(5.7±1.1)h;年龄23~64岁,平均(48.7±3.4)岁;病因:酒精性2例,胆源性21例,高脂血症性17例。对照组女17例,男23例;病程2~36 h,平均(6.1±0.8)h,年龄23~64岁,平均(49.9±3.7)岁;病因:酒精性3例,胆源性19例,高脂血症性18例。两组一般资料比较差异无统计学意义(P>0.05),有可比性。本研究经伦理委员会批准。患者均签订知情同意书。
1.2 方法
两组均先给予禁食、抗感染、补液、改善酸碱失衡、胃肠减压等治疗。
对照组应用奥曲肽(上海上药第一生化药业有限公司,国药准字H20060171,规格:0.1 mg)治疗,将0.6 mg 奥曲肽融入 60 ml 0.9% 氯化钠注射液中进行静脉泵入,24 h维持用药,5 ml/h,治疗1周。
研究组在对照组基础上给予低分子肝素治疗,低分子肝素钙注射液(深圳赛保尔生物药业有限公司,国药准字 H20060190,规格:1.0 ml∶5 000 IU),2 次 /d,5 000 IU/次,治疗 1 周。
1.3 观察指标
比较两组治疗前后血流动力学变化情况,包括血小板黏附率、血栓长度、血浆黏度、全血黏度高切。治疗前后抽取患者5 ml空腹静脉血进行检测。
比较两组治疗前后肠道黏膜屏障功能相关指标变化情况,包括尿乳果糖/甘露醇(L/M)、二胺氧化酶(DAO)、血浆D-乳酸。治疗前后抽取患者5 ml空腹静脉血,通过改良酶学分光广度法进行检测。
比较两组治疗前后炎性因子水平,包括白介素-1β(IL-1β)、超敏C反应蛋白(hs-CRP)、白介素-6(IL-6)。治疗前后抽取患者5 ml空腹静脉血,通过酶联免疫吸附法进行检测。
比较两组病情改善情况及住院时间,病情改善情况包括AMS改善时间、血脂肪酶改善时间、腹痛改善时间、尿淀粉酶改善时间。
1.4 统计学处理
本研究数据采用SPSS 20.0统计学软件进行分析和处理,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组血流动力学变化情况对比
研究组治疗后血小板黏附率、血浆黏度、全血黏度高切均低于对照组,血栓长度短于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组血流动力学变化情况对比(±s)
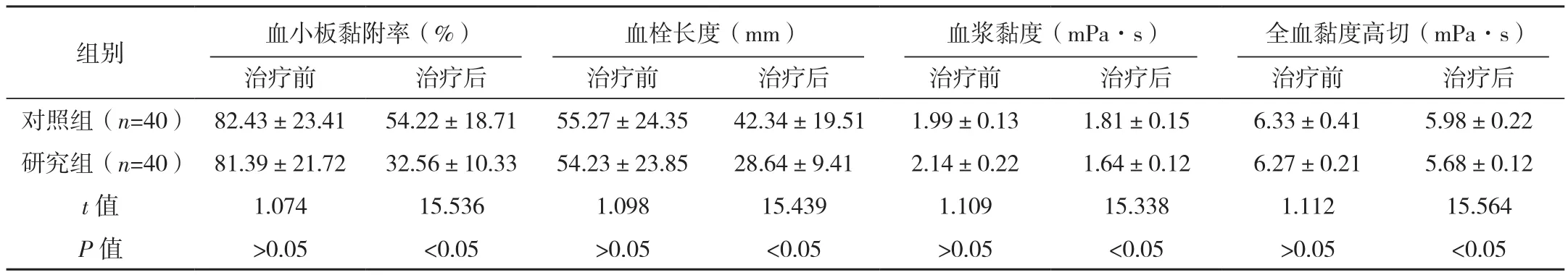
表1 两组血流动力学变化情况对比(±s)
组别 血小板黏附率(%) 血栓长度(mm) 血浆黏度(mPa·s) 全血黏度高切(mPa·s)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=40) 82.43±23.41 54.22±18.71 55.27±24.35 42.34±19.51 1.99±0.13 1.81±0.15 6.33±0.41 5.98±0.22研究组(n=40) 81.39±21.72 32.56±10.33 54.23±23.85 28.64±9.41 2.14±0.22 1.64±0.12 6.27±0.21 5.68±0.12 t值 1.074 15.536 1.098 15.439 1.109 15.338 1.112 15.564 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.2 两组肠道黏膜屏障功能相关指标变化情况对比
研究组治疗后L/M、DAO、血浆D-乳酸水平均低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组肠道黏膜屏障功能相关指标变化情况对比(±s)
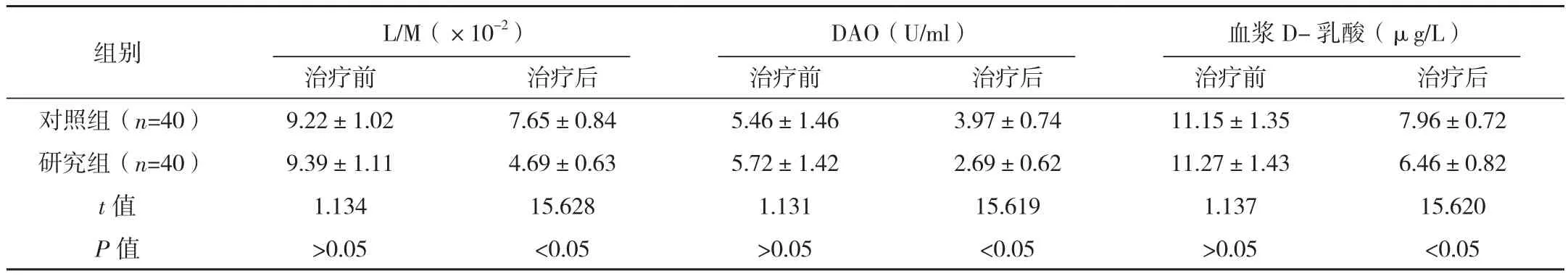
表2 两组肠道黏膜屏障功能相关指标变化情况对比(±s)
组别 L/M(×10-2)DAO(U/ml) 血浆D-乳酸(μg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=40) 9.22±1.02 7.65±0.84 5.46±1.46 3.97±0.74 11.15±1.35 7.96±0.72研究组(n=40) 9.39±1.11 4.69±0.63 5.72±1.42 2.69±0.62 11.27±1.43 6.46±0.82 t值 1.134 15.628 1.131 15.619 1.137 15.620 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组炎性因子水平变化对比
研究组治疗后IL-1β、hs-CRP、IL-6水平均低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组炎性因子水平变化对比(±s)
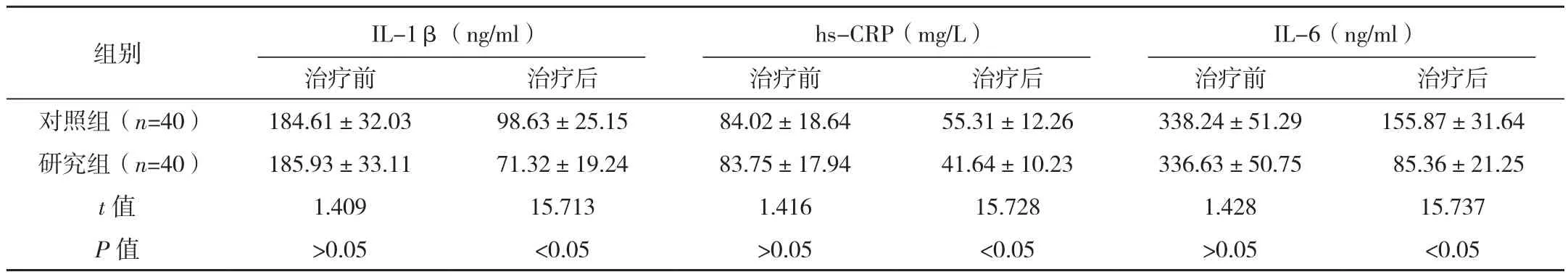
表3 两组炎性因子水平变化对比(±s)
组别 IL-1β(ng/ml)hs-CRP(mg/L)IL-6(ng/ml)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=40) 184.61±32.03 98.63±25.15 84.02±18.64 55.31±12.26 338.24±51.29 155.87±31.64研究组(n=40) 185.93±33.11 71.32±19.24 83.75±17.94 41.64±10.23 336.63±50.75 85.36±21.25 t值 1.409 15.713 1.416 15.728 1.428 15.737 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 两组病情改善情况及住院时间对比
研究组AMS、血脂肪酶、腹痛、尿淀粉酶改善时间均早于对照组,住院时间短于对照组,差异有统计学意义(P<0.05),见表 4。
表4 两组病情改善情况及住院时间对比[d,(±s)]
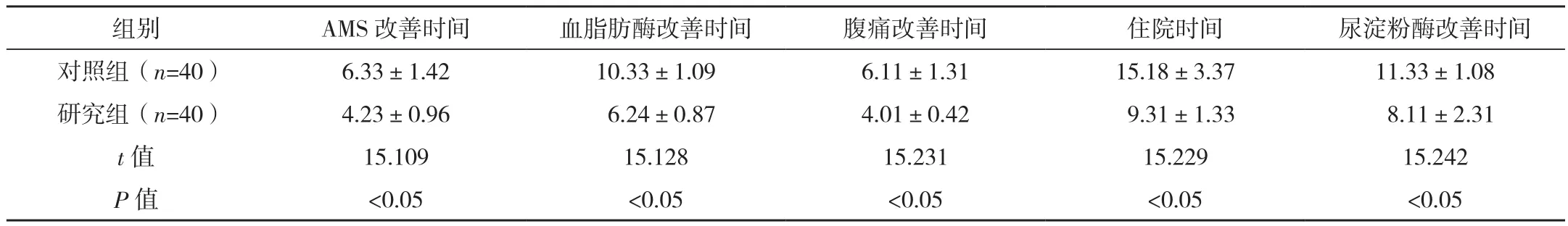
表4 两组病情改善情况及住院时间对比[d,(±s)]
组别 AMS改善时间 血脂肪酶改善时间 腹痛改善时间 住院时间 尿淀粉酶改善时间对照组(n=40) 6.33±1.42 10.33±1.09 6.11±1.31 15.18±3.37 11.33±1.08研究组(n=40) 4.23±0.96 6.24±0.87 4.01±0.42 9.31±1.33 8.11±2.31 t值 15.109 15.128 15.231 15.229 15.242 P 值 <0.05 <0.05 <0.05 <0.05 <0.05
3 讨论
随着社会的不断发展,人们的生活和饮食习惯发生了改变,促使AP的发病率不断增高。其主要发病原因有酗酒、胆道疾病及不良饮食,容易引发较多并发症,如果未及时给予治疗,容易累及较多器官,导致功能障碍,威胁患者的生命。AP病变的基础就是炎症反应,因此治疗AP的关键就是对机体炎症反应进行抑制[4]。AP的发病主要是由于胰液自身消化胰腺和其附近的组织,而导致其自身消化的关键点就是胰腺细胞中的消化酶活化,和其他的炎性疾病不同,AP患者的炎性反应会连累周围的组织,且会向全身扩大。目前临床认为导致胰酶激活的因素有药物、低血压、饮食、高血钙、氧化应激和高脂血症。有研究指出,AP发病后会诱导肝脏、肺部器官中的炎性因子分泌,从而导致脏器受损[5]。因此患者在确诊为AP后,需要及时对胰酶的分泌进行阻断,从而抑制疾病的进展。针对AP患者,临床中多通过药物治疗,常用的药物有蛋白酶抑制剂和生长抑素等,蛋白酶抑制剂可以对胰酶的活性进行抑制,从而降低其分泌,减少对胰腺和其他脏器的损害;而生长抑素也可以对胰酶的分泌进行控制。
生长抑素在中枢神经系统、消化道黏膜、脑垂体后叶中分布,可以降低胃部的蠕动、分泌,干扰胰酶的分泌和生长素的分泌。奥曲肽是常用的治疗AP的药物,其是生长抑素的一种,可以对胰酶、生长激素的分泌进行抑制,预防胰液的反流,同时可以降低胰管压力,加速微循环障碍的恢复,且可以对炎性因子的释放进行抑制,从而降低机体的炎症反应[6]。其具有较高的亲和性,一方面可以对膜受体进行调节,选择性地对胰高血糖素、生长抑素的合成进行抑制,另一方面可以对胃酸和胰酶的分泌进行抑制,从而有效抑制胆囊排空,保护胰腺的实质细胞膜;与此同时其还可以抑制血小板的活性,从而降低胆汁返流,预防低钙血症[7]。其药理作用为:抑制细胞的增殖,腺体的分泌,乙酰胆碱的释放及平滑肌的收缩等;用药后其可以直接作用于胰管、胰腺腺泡的受体上(生长抑素),从而影响溶酶体、胰泌素的分泌,加速胰管流通[8]。此外,其还可以降低炎症引发的脏器受损,有改善腹痛的效果,对P物质的释放有抑制作用。有关研究指出,奥曲肽可有效改善AP患者的血流变学,从而纠正微循环障碍,加速患者的康复[9]。
低分子肝素是常用的一种新型抗凝剂,具有改善胰腺的血液微循环、溶栓的效果,且其适应证广,能调节脂代谢、炎症反应和腺泡细胞的凋亡,从而改善AP患者的预后,另外治疗过程中其可以预防胰腺缺血和坏死症状的发生[10]。此药的主要作用就是对血栓的形成进行抑制,用药后,对凝血酶的活性和分泌进行有效的抑制,从而改善患者的血液微循环。有研究指出,低分子肝素还可以降低毒素导致的炎症反应[11]。低分子肝素还可以有效地改善血液高凝状态,降低血流灌注和机体中的TG水平,从而保护血管的内皮细胞,有利于内皮细胞结构和功能的恢复,从而加速患者康复。有研究指出,低分子肝素可以有效改善机体微循环的灌注,抑制疾病的进展[12]。低分子肝素的抗FXa活性高于普通肝素,且生物利用度高,半衰期长,且相较于普通肝素,其血栓形成及血小板减少的发生率低,长期应用无骨质疏松及脱发等副作用。
IL-1β、IL-6、hs-CRP均为炎性因子,其中IL-6、IL-1β的特异性、灵敏度均较高,而hs-CRP能对机体中的炎症状态进行精准的反应。有研究指出,AP患者机体中的炎性因子水平会明显升高。本次研究对照组应用奥曲肽,研究组在此基础上应用低分子肝素,结果显示,研究组治疗后IL-1β、hs-CRP、IL-6水平均低于对照组(P<0.05),说明联合用药效果较好,可以改善患者的炎性因子水平,从而控制炎症反应。小肠的标志酶即DAO,可以体现肠道的完整性和损伤程度,AP患者均存在黏膜屏障受损的情况,因此机体中的DAO水平会升高[13]。L/M是评价黏膜屏障的主要指标,肠道黏膜会分泌D-乳酸,如果黏膜有损伤,其会进入血液,因此AP患者的L/M和D-乳酸水平均会提高[14]。本次研究结果显示,研究组治疗后L/M、DAO、血浆D-乳酸水平均低于对照组(P<0.05),说明联合用药可以改善黏膜屏障相关指标,从而改善黏膜屏障受损情况。本次研究结果还显示,研究组治疗后血小板黏附率、血浆黏度、全血黏度高切均低于对照组,血栓长度短于对照组(P<0.05),说明和单独用药相比,联合用药效果更佳,可以改善患者的血流动力学,改善微循环机制,加速患者康复。分析原因为奥曲肽和低分子肝素均能对胰酶的分泌进行抑制,两者联合应用可以发挥协同作用,从根本上控制疾病的进展,通过对胰酶的活化、分泌进行抑制,有效避免脏器受损和自身消化,抑制炎性反应,改善病情[15]。本次研究结果还显示,研究组AMS、血脂肪酶、腹痛、尿淀粉酶改善时间均早于对照组,住院时间短于对照组(P<0.05),说明相较于单一用药,联合用药治疗效果更好,可以促进病情的改善,缩短住院时间。
综上所述,低分子肝素联合奥曲肽治疗AP的效果较好,可以改善血流动力学、炎性因子和肠道功能相关指标,促进病情改善,缩短住院时间,值得推广和应用。

