超高效液相色谱串联质谱法测定蜂蜜中氯霉素、氟甲砜霉素、甲砜霉素、甲硝唑
于浩洋,祁珍祯,朱冰雅,李颜岩
(辽宁省疾病预防控制中心,沈阳 110005)
氯霉素、甲砜霉素和氟甲砜霉素属于氯霉素类抗生素,对革兰氏阴性菌和革兰氏阳性菌具有很强的活性,能抑制细菌蛋白质的形成,表现出广谱抗菌能力,因其良好的抗菌性能,曾被广泛应用到畜牧业及水产养殖中[1]。当人们食用了使用氯霉素类抗生素的畜牧业或水产品后,氯霉素类抗生素会残留于人体内。随着氯霉素类抗生素的大量使用,其不良作用也逐渐表露出来,可导致粒细胞缺乏症、再生障碍性贫血、灰婴综合征等,严重威胁人类健康[2-3]。当前,世界上许多国家已禁止氯霉素类药用于动物食品的生产,并规定了其在畜产品中最高残留限量,美国、欧盟规定氯霉素残留限量标准为“零容许量”,即不得检出[4]。甲砜霉素和氟甲砜霉素抗菌谱与氯霉素相似,较氯霉素毒性有所降低,被广泛用于养殖业,为保障食品安全,我国、欧盟等均制定了其在动物源性食品中的最大残留限量[5-7]。
甲硝唑(MTZ)属于硝基咪唑类抗生素,被普遍用于预防和控制蜜蜂孢子虫病,对厌氧细菌十分有效[8]。硝基咪唑类药物对哺乳动物具有致癌、致畸、致突变作用和遗传毒性,通过食品接触可能对人类健康构成潜在威胁[9-10]。欧盟EEC 2377/90 标准中,甲硝唑被列为禁止添加药物[11]。我国农业部最新颁布的第250 号公告《食品安全国家标准食品中兽药最大残留量》[12]中规定动源性食品中不得检出氯霉素、甲硝唑,动物源性食品中甲砜氯霉素的最高残留限量为50 μg/kg,氟甲砜霉素最高残留限量(以氟苯尼考与氟苯尼考胺之和计)为100~3 000 μg/kg。
尽管国家已颁布了食品中抗生素残留标准的相关政策,仍有部分蜂农罔顾法纪,受利益驱使违规使用抗生素,近几年偶有检出阳性蜂产品[13-14],给消费者的身体健康带来危害,因此加强对蜂蜜中抗生素使用的把控与监管,保障蜂蜜的食品安全非常必要。蜂蜜中甲硝唑或氯霉素类化合物的检测方法很多[15-16],主要有高效液相色谱(HPLC)法[17]、气相色谱-质谱(GC-MS)法[18]、液相色谱-质谱联用(LC-MS/MS)法[19-20]。由于甲硝唑与氯霉素类化合物的化学结构有较大差异,在溶剂中,氯霉素类化合物带负电荷,甲硝唑带正电荷,因此在使用液相色谱-串联质谱法检测时,需要分别采用正离子和负离子扫描模式进行采集,较为繁琐。目前,同时测定甲硝唑和氯霉素类化合物的方法报道较少,张琳等[21]使用液相色谱-质谱联用法同时检测动物源性食品中氯霉素和甲硝唑,但蜂蜜是一个高糖分、有机酸复杂的样品,检测的干扰性比较大,其没有使用内标或固相萃取柱净化以消除基质干扰。笔者采用超高效液相色谱-串联质谱法以氯霉素-D5和甲硝唑-D4为内标同时测定蜂蜜中甲硝唑、氯霉素、甲砜霉素和氟甲砜霉素的残留,采用固相萃取柱净化以达到消除基质干扰的目的,操作简便快捷,定性定量准确,检出限低,灵敏度高,重现性好,能满足同时检测蜂蜜中甲硝唑和氯霉素类化合物的需要。
1 实验部分
1.1 主要仪器与试剂
超高效液相色谱-串联质谱仪:3200QTRAP型,美国AB 公司。
涡旋振荡器:Lab Dancer 型,德国艾卡公司。
高速冷冻离心机:Thermo ST16R 型,美国赛默飞世尔公司。
电子天平:BS 110S 型,感量为0.1 mg,德国赛多利斯公司。
超纯水系统:MILLI-Q Gradient 型,法国默克密理博公司。
高速离心机:TGL-16A 型,上海安亭科学仪器厂。
氮吹仪:urboVap LV 型,美国Caliper Life Science 公司。
固相萃取仪:Vac Elut SPS 24 型,美国安捷伦科技有限公司。
超声波清洗器:KQ5200DB 型,昆山市超声仪器有限公司。
Pall Corpration Acrodisc 针式滤器:孔径为0.2 μm,直径为13 mm,美国颇尔公司。
固相萃取柱:Oasis MCX 型,柱容积为6 mL,填料质量为150 mg,美国沃特世公司。
氯霉素-D5:编号为H409107AL,质量浓度为100 ng/μL,德国Dr. Ehrenstorfer 公司。
氯霉素、甲硝唑-D4、甲硝唑、氟甲砜霉素、甲砜霉素标准物质:编号分别为G974527、G174488、G133045、G169577、G988144,质量分数分别为99.8%、98.5%、96.2%、99.9%、99.3%,德国Dr. Ehrenstorfer 公司。
乙腈、甲醇、乙酸乙酯:色谱纯,美国费希尔公司。
甲酸:色谱纯,美国福禄克公司。
乙酸铵:色谱纯,德国CNW 公司。
氨水:分析纯,西陇科学股份有限公司。
盐酸:分析纯,国药集团化学试剂有限公司。
实验用水水为超纯水。
1.2 仪器工作条件
1.2.1 色谱条件
色谱柱:Kinetex C18柱(100 mm×2.1 mm,2.6 μm,美国沃特世公司);柱温:40 ℃;样品室温度:4 ℃;流动相:A 相为乙腈,B 相为5 mmol/L 乙酸铵溶液(含0.05%甲酸);流量:0.4 mL/min;进样体积:10 μL;梯度洗脱条件见表1。

表1 色谱分离梯度洗脱条件
1.2.2 串联质谱条件
离子源:电喷雾离子源(electrospray ionization,ESI);离子喷雾电压:5 500 V(正离子)~4 500 V(负离子);离子源温度:550 ℃;喷雾气压力:413.7 kPa;辅助加热器压力:413.7 kPa;气帘气压力:137.9 kPa;扫描方式:甲硝唑、甲硝唑-D4为正离子扫描模式,氯霉素、氯霉素-D5、氟甲砜霉素、甲砜霉素为负离子扫描模式。4 种抗生素及内标质谱参数及保留时间见表2 所示。

表2 4 种抗生素及内标的质谱参数及保留时间
1.3 实验步骤
1.3.1 样品预处理
准确称取5 g 蜂蜜(精确至0.01 g)置于50 mL离心管中,向其中加入100 μL 20 ng/mL 的氯霉素-D5应用液、100 μL 20 ng/mL 的甲硝唑-D4应用液,加入10 mL 水,混匀溶解,再加入10 mL 乙酸乙酯,涡旋提取3 min,以10 000 r/min 离心3 min,吸取乙酸乙酯相5 mL 于10 mL 试管中,40 ℃水浴氮气吹干后,先加入0.1 mL 甲醇溶解,再加入1.9 mL 40 mmol/L 盐酸溶液,涡旋30 s,转入2 mL 离心管,15 000 r/min 离心3 min,上清液待净化。
先后用6 mL 甲醇、6 mL 水、6 mL 40 mmol/L的盐酸溶液活化平衡MCX 固相萃取柱,然后将上述上清液转移至MCX 柱内,待样品过柱后,用6 mL 水淋洗除杂,真空抽干柱内液体后加入5 mL 乙酸乙酯洗脱,收集于氮吹管内,得到洗脱液1;再用6 mL 甲醇淋洗除杂,真空抽干后用5 mL 5%氨化甲醇洗脱,收集于氮吹管内,得到洗脱液2;洗脱液1 和2 在40 ℃水浴下氮气吹干,先向其中加入0.1 mL 甲醇溶解残留物,再加入0.9 mL 10%甲醇-水溶液混匀,过0.22 μm 滤膜后上机分析。洗脱液1 用于分析氯霉素类抗生素,洗脱液2 用于分析甲硝唑。
1.3.2 溶液的配制
氯霉素、氟甲砜霉素、甲砜霉素、甲硝唑单一标准储备液:分别准确称取4 种抗生素标准物质各0.010 g(精确到0.000 01 g),以甲醇溶解并定容至10 mL,得到4 种抗生素质量浓度均为1.0 mg/mL的单一标准储备液,于-20 ℃避光保存。
混合标准储备液:准确移取4 种抗生素单一标准储备液500 μL 于50 mL 容量瓶中,用甲醇定容至标线,得到4 种抗生素质量浓度均为10.0 μg/mL 的混合标准储备液,于-20 ℃下保存。
混合标准应用液:准确移取混合标准储备液25 μL 于10 mL 容量瓶中,用甲醇定容至标线,得到4种抗生素质量浓度均为25.0 ng/mL 的混合标准应用液,于4 ℃下保存。
氯霉素-D5应用液:准确移取50 μL 质量浓度为100 μg/mL 的氯霉素-D5标准物质于50 mL 容量瓶中,用甲醇定容至标线,得到质量浓度为100.0 ng/mL 的氯霉素-D5储备液,于-20 ℃保存;后用甲醇稀释至20.0 ng/mL ,于4 ℃保存。
甲硝唑-D4应用液:准确称取0.010 g(精确到0.000 01 g)甲硝唑-D4标准物质,用甲醇溶解并定容至100 mL,质量浓度为0.1 mg/mL ,于-20 ℃保存;后用甲醇稀释至20.0 ng/mL,于4 ℃保存。
系列混合标准工作溶液:分别吸取25.0 ng/mL抗生素混合标准应用液0.01、0.02、0.04、0.1、0.2、0.4 mL,20.0 ng/mL 氯霉素-D5和甲硝唑-D4应用液各100 μL,25%乙腈-水溶液,定容至1.0 mL,制备成4 种抗生素的质量浓度分别为0.25、0.5、1.0、2.5、5.0、10.0 ng/mL 的系列混合标准工作溶液。
2 结果与讨论
2.1 质谱条件优化
在电喷雾正负离子模式下对质谱条件进行优化,发现氯霉素、氯霉素-D5、甲砜霉素、氟甲砜霉素均能在负离子条件下电离,Q1 扫描时出现丰度较高的[M-H]-峰,而甲硝唑和甲硝唑-D4可在正离子条件下电离,Q1 扫描时出现丰度较高的[M+H]+峰。分别选择[M-H]-峰作为氯霉素类的母离子、[M+H]+峰作为甲硝唑的母离子,对其进行碰撞解离。通过子离子扫描,得到碎片离子信息,再对去簇电压、碰撞电压等参数进行优化,使分子离子对的信号达到最强,每种化合物选择2 对分子离子对,以响应较强的子离子作为定量离子,另一子离子作为定性离子。化合物的质谱参数见表2。
2.2 色谱条件优化
由于甲醇和乙腈对绝大多数有机物具有较高溶解度,且二者具有低腐蚀性、低毒性、低粘性的特征,因此在液相色谱-质谱联用仪的使用中多采用甲醇或乙腈作为有机相。此外,常在流动相中加入乙酸铵,可以有效提高目标化合物的响应并改善峰型[22-23]分别以相同比例的乙腈-5 mmol/L 乙酸铵溶液和甲醇-5 mmol/L 乙酸铵溶液作为流动相进行试验,试验结果发现,在甲醇-5 mmol/L 乙酸铵溶液体系中,氯霉素、甲砜霉素、氟甲砜霉素响应较高,但甲硝唑响应偏低;在乙腈-5 mmol/L 乙酸铵溶液体系中,氯霉素、甲砜霉素、氟甲砜霉素响应虽稍有下降,但甲硝唑响应值明显升高,因此选用乙腈-5 mmol/L 乙酸铵溶液作为流动相。
由于甲酸在水中电离产生正离子,向水相中加入甲酸可以增加正离子扫描模式下甲硝唑的离子化效率,提高灵敏度。分别考察了0.01%、0.05%、0.1%三种浓度甲酸作为流动相时,对甲硝唑及氯霉素类化合物响应值的影响。试验结果表明,甲酸浓度为0.05%时,在提高甲硝唑的离子化效率的同时,对氯霉素、甲砜霉素、氟甲砜霉素的电离没有显著性影响,故B 相选用0.05%甲酸水溶液。
当样品溶液的溶剂与流动相溶剂对样品溶解度不同时,可能会造成峰展宽、峰分叉现象。为防止溶剂效应的发生,试验样品先加入0.1 mL 甲醇超声溶解残留物,再加入0.9 mL 体积分数为10%的甲醇-水溶液,混匀后进样。可有效防止溶剂效应,改善色谱峰峰型,提高响应值。
以乙腈-5 mmol/L乙酸铵溶液(含0.05%甲酸)为流动相,采用Kinetex C18柱(100 mm ×2.1 mm,2.6 μm,美国沃特世公司)对4 种抗生素混合标准溶液进行分离,结果表明,梯度洗脱比等度洗脱分析时间短、色谱峰宽更窄,且能够克服等度洗脱时待测物与干扰杂质一起流出,对待测物的离子化产生抑制作用以及色谱峰背景干扰的缺点。优化的梯度洗脱程序见表1。在优化条件下4 种抗生素提取色谱图如图1、图2 所示。

图1 氯霉素、甲砜霉素、氟甲砜霉素的提取色谱图
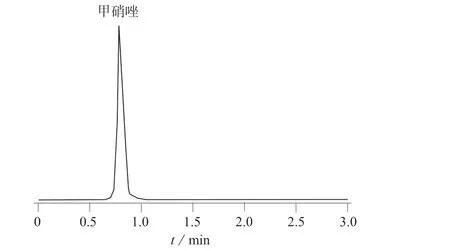
图2 甲硝唑的提取色谱图
2.3 前处理条件优化
食品样本分析过程中,样本的前处理较为费力、费时,同时明显影响分析结果的限速过程。氯霉素、甲砜霉素、氟甲砜霉素和甲硝唑属于弱极性物质,易溶于甲醇、乙腈、乙酸乙酯等有机溶剂。通过考察证明,在3 种试剂中,乙酸乙酯提取率最高,因此选择乙酸乙酯提取样品。4 种抗生素需采用正负两种扫描方式,因此采用的固相萃取小柱需对阴阳离子均有所保留。Waters Oasis MCX 固相萃取小柱属于混合型阳离子交换反相吸附剂,其填料设计可以克服传统硅胶基质混合型固相萃取吸附剂的局限性,提供了离子交换和反相离子交换的双重保留模式。因此试验采用乙酸乙酯从MCX 柱洗脱获得氯霉素、甲砜霉素、氟甲砜霉素组分,采用5%氨化甲醇从MCX 柱洗脱获得甲硝唑组分,分级净化可有效去除干扰物质,满足要求。
2.4 同位素内标的使用
在质谱分析中,同位素内标法是以稳定同位素标记化合物作为内标,利用待测物与内标的响应丰度比值(峰面积比)进行线性回归,通过对同位素丰度的准确质谱测量和对加入的内标的准确称量,做到对待测物的定量测定。该技术能有效消除基质干扰、具有检测灵敏度高的优点。
2.5 线性关系与检出限
在1.2 仪器条件下测定1.3.2 配制的系列混合标准工作溶液,以待测化合物的质量浓度(x)为横坐标,色谱峰面积(y)为纵坐标,进行线性回归,得线性回归方程及相关系数。以3 倍信噪比对应的质量浓度作为方法的检出限。计算得到的线性范围、回归方程、相关系数及检出限结果列于表5。由表5 可知,4 种抗生素质量浓度与对应的色谱峰面积线性关系良好,相关系数均大于0.995,检出限为0.08 μg/L。

表5 回归方程、线性范围、线性相关系数与检出限
2.6 加标回收与精密度试验
准确吸取18 份空白蜂蜜5 g 作为本底,分别加入高、中、低三个质量浓度水平的混合标准溶液,每个浓度水平平行6 次测定,样品处理同前,上机测定,测定结果见表6。由表6 可知,4 种抗生素的平均加标回收率为90.2%~105.7%,测定结果的相对标准偏差为3.7%~8.9%,说明方法的精密度和准确度良好。

表6 4 种抗生素的加标回收、精密度试验结果
3 结语
建立了一种HPLC-MS/MS 方法同时检测蜂蜜中甲硝唑、氯霉素、甲砜霉素和氟甲砜霉素浓度,该方法对仪器条件和净化过程进行了优化,同位素内标的使用可减少基质效应的影响,具有检测快速、准确、检出限低、灵敏度高等特点,适用于蜂蜜中甲硝唑、氯霉素、甲砜霉素和氟甲砜霉素残留量的同时检测。

