抗磷脂酶A2受体和1型血小板反应蛋白7A域在原发性膜性肾病中的表达情况及对患者预后的影响
王申伟 王黎亚 王琼
膜性肾病(MN)是导致成人肾病综合征的常见原因之一,以肾小球毛细血管袢上皮侧大量免疫复合物沉积为其主要病理改变,占原发性肾病综合征的20%~35%[1-4]。根据病因可将MN分为原发性膜性肾病(IMN)和继发性膜性肾病(SMN),IMN是非炎症性器官特异性的自身免疫性疾病,发病机制包括免疫复合物在肾小球沉积、补体激活和肾小管间质损伤[5]。抗磷脂酶A2受体(PLA2R)和1型血小板反应蛋白7A域(THSD7A)与IMN的发病相关,在IMN中PLA2R的检出率达70%以上,THSD7AM的检出率却不到10%,但特异性接近100%,对IMN的诊断具有一定参考价值[6-10]。PLA2R和THSD7AM在IMN中的研究主要集中在发病机制和诊断方面,对患者预后的影响研究较少。本文通过回顾性分析2018年1月~2019年3月在我院接受治疗的IMN患者的临床资料,探讨PLA2R和THSD7AM阳性表达对IMN临床特征及预后的影响。
对象与方法
1.对象:选取2018年1月~2019年3月在我科行肾脏组织病理活检确诊的MN患者190例,其中IMN 134例(IMN组),SMN 56例(SMN组)。IMN组中男96例,女38例,平均年龄(47.2±5.3)岁。SMN组中男39例,女17例,平均年龄(45.7±4.5)岁。两组年龄、性别比较差异均无统计学意义(P>0.05)。纳入标准:(1)经肾脏组织病理检测确定为MN;(2)首次确诊;(3)未使用过激素或免疫抑制剂。排除标准:(1)合并肿瘤及其他自身免疫性疾病;(2)急进性肾炎、合并严重肾炎损伤。再根据PLA2R和THSD7A的表达情况将IMN组患者分别分为PLA2R阳性组(102例)、PLA2R阴性组(32例)和THSD7A阳性组(20例)、THSD7A阴性组(114例)。本研究通过我院伦理委员会审核批准,所有患者及家属均签署知情同意书。
2.方法
(1)患者的一般资料及临床资料收集:收集患者的一般资料及临床资料,包括性别、年龄、24 h尿蛋白、白蛋白、总胆固醇(TC)、甘油三酯(TG)、估算的肾小球滤过率(eGFR)。根据肾脏组织病理活检结果确定患者的病理分期,收集IMN患者接受免疫药物治疗的情况。
(2)肾活检标本收集及免疫荧光检测PLA2R和THSD7A的表达:所有患者术前常规检查血常规、凝血指标,结果无异常者在超声引导下行肾穿刺活检。2%利多卡因局部麻醉,采用16 G穿刺针进针,针尖接近包膜时嘱咐患者屏气,然后进针取材。将获得的肾组织进行石蜡包埋切片,厚度约1.5 μm,烤片后脱蜡,磷酸盐缓冲液(PBS)清洗3次,每次5 min,切片上滴加蛋白酶K,置于37 ℃烤箱中静置40 min,磷酸盐缓冲液(PBS)清洗3次,每次5 min。分别滴加PLA2R和THSD7A荧光抗体(1∶200),4 ℃冰箱中过夜,用PBS溶液清洗3次,每次5 min。然后滴加带荧光素的兔抗鼠免疫球蛋白,置于37 ℃烤箱中静置40 min,再次PBS溶液清洗3次,每次5 min,滴加甘油封片剂,封片。在荧光显微镜下观察,以兔血清代替一抗作为阴性对照,加入一抗阳性而兔血清阴性者,判断为阳性表达。
(3)随访终点:完全缓解指24 h尿蛋白<300 mg/d,且血清白蛋白和血清肌酐正常,部分缓解为尿蛋白量下降50%以上,血清白蛋白上升且肾功能无变化。以患者完全缓解为随访终点,随访时间为3~36个月,中位随访时间为24个月。
结 果
1.IMN组与SMN组患者一般资料、临床资料及PLA2R和THSD7A阳性率比较:IMN组患者PLA2R和THSD7A的阳性率均高于SMN组(P<0.01)。两组患者性别、年龄、24 h尿蛋白、白蛋白、TC、TG和eGFR比较差异均无统计学意义(P>0.05)。见表1。
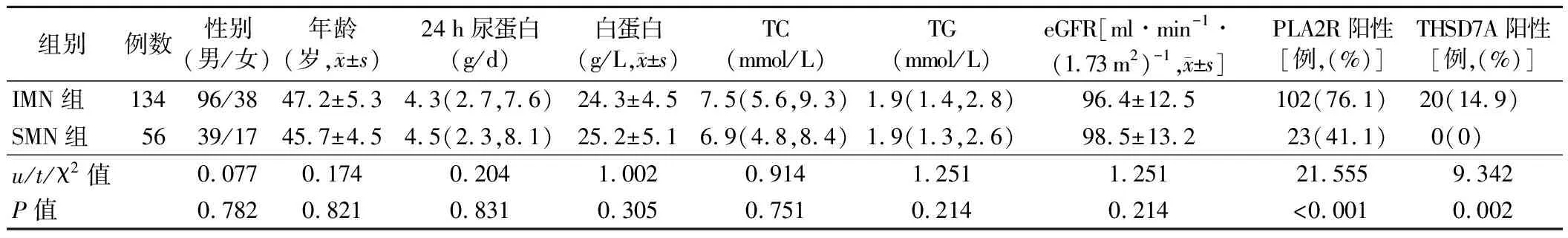
表1 IMN组与SMN组患者的临床资料比较[M(P25,P75)]
2.PLA2R阳性组、PLA2R阴性组及THSD7A阳性组、THSD7A阴性组患者一般资料及临床资料比较:PLA2R阳性组男性比例、eGFR、病理分期Ⅱ和Ⅲ期患者比例均高于PLA2R阴性组(P<0.001)。两组患者年龄、24 h尿蛋白、白蛋白、TC和TG比较差异均无统计学意义(P>0.05)。PLA2R阳性患者病理分期以Ⅱ期为主。见表2。THSD7A阳性组eGFR、病理分期Ⅰ和Ⅲ期患者比例均高于THSD7A阴性组(P<0.001)。两组患者性别、年龄、24 h尿蛋白量、白蛋白、TC和TG比较差异均无统计学意义(P>0.05)。THSD7A阳性组病理分期以Ⅰ期为主。见表3。
表2 IMN患者中PLA2R阳性组和PLA2R阴性组一般资料及临床资料比较
表3 IMN患者中THSD7A阳性组和THSD7A阴性组一般资料及临床资料比较
3.PLA2R阳性组、PLA2R阴性组及THSD7A阳性组、THSD7A阴性组患者接受治疗情况比较:PLA2R阳性组接受免疫治疗患者91例、非免疫治疗患者11例,PLA2R阴性组接受免疫治疗患者27例、非免疫治疗患者5例,组间比较差异无统计学意义(χ2=0.543,P=0.461)。THSD7A阳性组接受免疫治疗患者17例、非免疫治疗患者3例,THSD7A阴性组接受免疫治疗患者91例、非免疫治疗患者23例,组间比较差异无统计学意义(χ2=0.291,P=0.589)。
4.PLA2R阳性组、PLA2R阴性组及THSD7A阳性组、THSD7A阴性组患者治疗结果比较:PLA2R阴性组治疗后12个月完全缓解患者比例显著高于PLA2R阳性组,12个月部分缓解患者比例显著低于PLA2R阴性组(P<0.05)。见表4。而THSD7A阳性组与THSD7A阴性组治疗后3个月部分缓解、6个月和12个月的部分缓解和完全缓解患者比例比较差异均无统计学意义(P>0.05)。见表5。
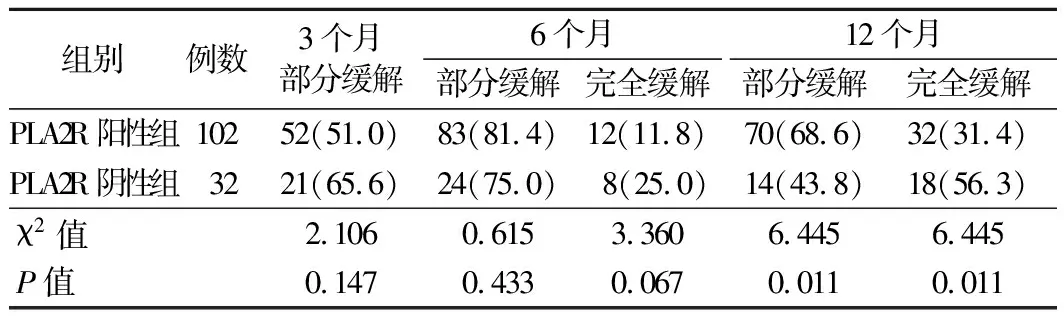
表4 IMN患者中PLA2R阳性组与PLA2R阴性组治疗结果比较[例,(%)]
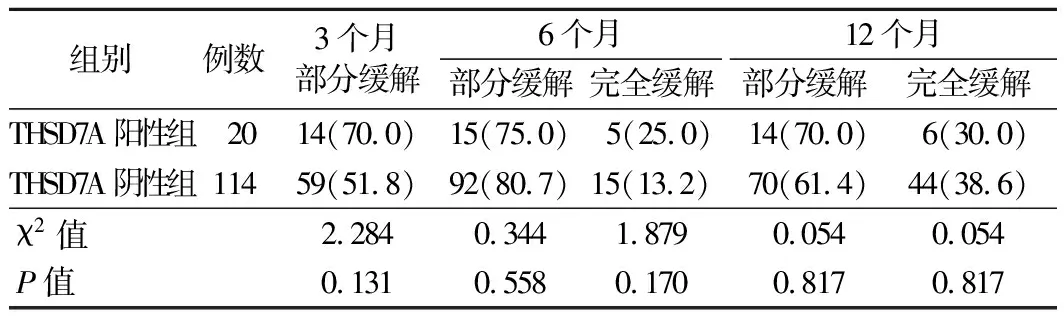
表5 IMN患者中THSD7A阳性组与THSD7A阴性组治疗结果比较[例,(%)]
5.PLA2R阳性组、PLA2R阴性组及THSD7A阳性组、THSD7A阴性组患者预后情况比较:PLA2R阳性组患者的中位完全缓解时间为10.7个月,低于PLA2R阴性组(31.0个月;χ2=7.095,P=0.007)。THSD7A阳性组和THSD7A阴性组患者的中位完全缓解时间比较差异无统计学意义(24.0个月比36.5个月,χ2=3.513,P=0.061)。
讨 论
本研究共纳入IMN患者134例,SMN患者56例,经过免疫荧光检测肾脏组织中PLA2R抗原的阳性率分别为76.1%、41.1%,THSD7A抗原的阳性率分别为14.9%、0%。IMN中PLA2R、THSD7A的阳性率显著高于SMN组。国内外研究发现,PLA2R在IMN中的阳性表达差异较大,PLA2R首次在白种人群中检测的阳性率约为70%,并表明PLA2R作为主要靶抗原参与IMN的发病[11]。一位日本学者的研究中共收集22例MN患者,其中16例PLA2R表达阳性,PLA2R阳性率为73.0%[12]。Hihara等[13]研究结果显示,IMN中PLA2R的阳性率达50%,而在SMN组中却未检测到PLA2R的阳性表达。Tian等[14]研究显示,IMN患者中PLA2R阳性率为71.7%,THSD7A阳性率为2.4%。在IMN中PLA2R的阳性表达相差较大可能与种族、样本量和纳入标准不同有关。PLA2R在IMN中阳性表达率较高,在SMN中阳性表达率较低,PLA2R在IMN诊断中具有高特异性。IMN的发病机制目前尚不明确,但有研究显示其与免疫复合物有关,PLA2R是IMN发病中主要的自身抗原,THSD7A为足细胞自身抗原,与抗体结合后形成复合物沉积在上皮细胞下,再激活补体形成膜攻击复合物,导致肾小球滤过膜受损[15-16]。THSD7A在IMN中的阳性表达率较低,在SMN中几乎没有表达,因此THSD7A阳性对IMN的诊断特异性非常高。对于有肾脏组织活检禁忌证的患者,可考虑检测PLA2R、THSD7A抗原表达,有助于其病情诊断。
目前IMN的治疗以免疫抑制治疗为主,个别年龄小、24 h尿蛋白<3.5 g、血浆白蛋白水平正常或轻度降低的患者可给予控制血压、纠正脂质代谢紊乱、利尿消肿和预防静脉血栓治疗为主。免疫治疗包括糖皮质激素联合烷化剂、钙调神经磷酸酶抑制剂、吗替麦考酚酯、利妥昔单抗治疗。Xu等[16]的研究结果显示,在IMN患者中PLA2R阳性组与PLA2R阴性组间血清肌酐、白蛋白和尿蛋白水平比较差异并无统计学意义,但PLA2R阴性组患者对免疫抑制剂的应答率高于PLA2R阳性组。国内的一项单中心回顾性研究发现,PLA2R相关的IMN患者与非PLA2R相关的IMN患者相比,在治疗后表现出更严重的蛋白尿和较低的缓解率,PLA2R的阳性表达可能与IMN的严重程度、治疗反应和预后相关[17]。在本研究中PLA2R、THSD7A阳性和阴性组接受的治疗方案没有差异,治疗12个月后PLA2R阴性组患者完全缓解比例显著高于PLA2R阳性组,而THSD7A阳性和阴性组比较差异并无统计学意义。PLA2R阳性表达组患者的中位完全缓解时间为25.0个月,显著长于PLA2R阴性表达组患者的中位完全缓解时间10.7个月。IMN患者PLA2R阳性表达以Ⅱ期为主,PLA2R阴性表达以Ⅰ期为主,PLA2R阳性表达与患者的预后相关。然而,本研究为前瞻性研究,存在收集病例数较少、随访时间较短等缺陷,为增加本研究的可靠性,我们,我们将继续随访患者,研究THSD7A、IMN对患者长期生存率的影响。
综上所述,肾脏组织PLA2R抗原表达有助于IMN的诊断,与患者的病理分期和临床预后相关,THSD7A在IMN中的阳性表达率低但特异性高,有助于临床诊断,与患者的病理分期相关,对预后的影响较小。

