痤疮丙酸杆菌生物膜形成与抗菌药物耐药的相关性分析
马 英, 刘 晔, 蒋 敏, 范逍遥, 张 臻, 韩 凌, 吴 旸, 贺轶轩
痤疮是毛囊皮脂腺单位的慢性炎症性疾病,其发病与多种因素有关[1],其中,痤疮丙酸杆菌(Cutibacterium acnes)的大量繁殖与痤疮发生密切相关[2]。系统或局部应用抗菌药物抑制痤疮丙酸杆菌是治疗痤疮的重要手段。然而痤疮丙酸杆菌对抗生素的耐药率正在不断增加,尤以对大环内酯类和林可霉素类的耐药率最高[3]。以往的研究普遍认为痤疮丙酸杆菌的耐药性主要是由于染色体变异。例如对红霉素和克林霉素的交叉耐药与编码23S rRNA 的基因发生点突变有关[4-5]。
近年来,关于细菌生物膜形成导致抗菌药物耐药的研究越来越多。体外研究发现,生物膜内细菌对抗菌药物的抵抗性是浮游菌的1 000倍[6]。有学者认为痤疮丙酸杆菌生物膜能够渗透到皮脂中,起到黏合剂的作用,导致角质细胞相互聚集和微粉刺形成[7]。最近的研究在对不同系统型痤疮丙酸杆菌菌株体外生物膜形成能力的比较分析中发现,IA1型菌株显示出比其他系统型高2~8倍的生物膜形成能力,而同时IA1型菌株又与中重度痤疮有很强的关联[8]。本研究通过体外构建痤疮丙酸杆菌临床株的生物膜,分析痤疮丙酸杆菌耐药性与生物膜形成的相关性。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2019年1—6月自复旦大学附属华山医院痤疮患者皮损处收集分离痤疮丙酸杆菌44株。本研究经本院伦理委员会审批。
1.1.2 试剂和仪器 哥伦比亚血琼脂平板购自广州迪景微生物科技有限公司,布氏琼脂肉汤、脑心浸液培养基、胰蛋白胨大豆肉汤、葡萄糖、酵母提取物购自英国OXOID公司,Live/Dead染液购自美国Invitrogen公司,CellTiter-BlueTM染液购自美国Promega公司,96孔细胞培养板(3599)、96孔酶标板购自美国Corning公司,玻璃底荧光皿(FD35-100)购自美国WPI公司,紫外分光光度计购自德国Eppendorf公司,酶标仪购自德国Biometra GmbH公司,激光共聚焦显微镜购自德国Leica公司。
1.2 方法
1.2.1 标本处理 对痤疮患者面部粉刺、丘疹和脓疱用75%乙醇消毒后,用粉刺针采集痤疮丙酸杆菌菌株。菌株接种于添加了去纤维蛋白的绵羊血和维生素K的布氏培养基,并置于厌氧箱(5%CO2, 10% H2, 85% N2)内培养 72 h。
1.2.2 细菌鉴定 经过两个纯化周期后,利用API-20A系统(法国生物梅里埃公司)对培养的微生物进行鉴定。
1.2.3 药敏试验 按照琼脂稀释法进行药敏试验,测定克林霉素、红霉素、莫匹罗星、夫西地酸、四环素的MIC。每种药物分别采用对倍稀释法制备成从128 mg/L到0.06 mg/L 12种不同浓度的琼脂板。使用多点接种器将每1 μL含有105CFU的痤疮丙酸杆菌标准菌液接种于琼脂表面,置于37℃厌氧培养箱中培养48 h后测定MIC。结果根据美国临床和实验室标准协化会(CLSI)2018年版的标准判读[9]。
1.2.4 培养基 对实验室容易获得和配置的4种培养基进行了比较,包括脑心浸液(BHI)培养基、胰蛋白胨大豆肉汤(TSB)培养基、BHI补充培养基(添加了葡萄糖和酵母提取物的BHI培养基)、TSB补充培养基(添加了葡萄糖和酵母提取物的TSB培养基)。在不同培养基中培养96 h和120 h后,用结晶紫染色法测定生物膜的生物量,并用刃天青染色评估生物膜内细胞活力。结果发现,与其他三种培养基相比,BHI补充培养基中痤疮丙酸杆菌的生物膜生物量和细胞活力均显著提高,使用激光共聚焦扫描显微镜观察时,痤疮丙酸杆菌表现出更强的黏附力和更有序的生物膜结构。BHI补充培养基是体外构建痤疮丙酸杆菌生物膜的理想培养基,其配方如下:将37 g BHI干粉和5 g酵母抽提物溶解在1 L去离子水中,并添加葡萄糖以制备1%葡萄糖溶液(pH 7.0)。
1.2.5 细菌培养 将痤疮丙酸杆菌接种于BHI补充培养基,37℃ 220 r/min振荡厌氧培养120 h。用无菌离心管收集菌体,离心后弃上清液。用BHI补充培养基重悬菌体,使用紫外分光光度计调整至D600nm=1.0,再用BHI补充培养基以1∶100稀释,加入96孔培养板(200 μL/孔),37℃厌氧培养120 h。当培养至96 h、120 h时,分别进行以下操作:弃菌液,加入PBS(200 μL/孔)洗去未黏附细菌,重复洗3次。
1.2.6 生物膜半定量检测 向上述处理好的96孔板内加入99%甲醇固定15 min,弃去液体后室温干燥。再加入1%结晶紫染色8 min,自来水冲洗至流水无色,室温干燥。10%乙酸溶液溶解生物膜,室温干燥后使用紫外分光光度计测定D570nm。不接种菌株的BHI补充培养基作为阴性对照(Dc)。
1.2.7 生物膜内活菌数量检测 在培养处理好的96孔板,每孔加入100 μL生理盐水,反复吹打使生物膜内细菌完全重悬于生理盐水中。将每孔内重悬后的菌液分别转移至白色96孔酶标板内,并向每孔加入20 μL CellTiter-BlueTM试剂,300 r/min摇1 min,37℃厌氧培养1 h,酶标仪记录荧光。CellTiter-BlueTM试剂,即溶解于缓冲溶液中的高纯度的刃天青。有活性的细胞可将深蓝色的氧化型染料(刃天青)转化为红色的还原型染料(试卤灵),并产生荧光信号。
1.2.8 生物膜结构观察 将痤疮丙酸杆菌接种于BHI补充培养基,使用紫外分光光度计调整至D600nm=1.0,再用BHI补充培养基以1∶10稀释,稀释后的菌液再加入至玻璃底荧光皿(2 mL/皿),37℃厌氧培养至120 h。弃上清液,生理盐水轻柔洗3次,加入600 μL Live/Dead染液,室温放置20 min后于激光共聚焦显微镜下观察。每个玻璃底荧光皿至少选择5处进行观察(4个角落和中央)。
1.2.9 数据分析 采用SPSS 22.0软件进行数据分析,独立样本t检验比较不同菌株D570nm、560EM/590EX荧光值之间的差异。P<0.05为差异有统计学意义。采用GraphPad Prism 6软件绘图,结果用表示。
2 结果
2.1 药敏试验
44株痤疮丙酸杆菌对莫匹罗星的耐药率为100%。对红霉素的耐药率为47.7%,对克林霉素的耐药率为56.8%。见表1。18株痤疮丙酸杆菌对克林霉素和红霉素表现出交叉耐药。将痤疮丙酸杆菌分为敏感株、克林霉素-红霉素双耐药株、红霉素耐药株和克林霉素耐药株,研究生物膜形成与耐药的关系。

表1 痤疮丙酸杆菌对抗菌药物的敏感性和耐药性Table 1 Susceptibility of Cutibacterium acnes strains to antimicrobial agents
2.2 生物膜半定量检测
培养至96 h和120 h时,结晶紫染色测量不同耐药性菌株的D570nm。Dc为阴性对照孔的D570nm,当D>Dc则判定为有生物膜形成。所有菌株D570nm均大于Dc,提示有生物膜形成。培养至96 h和120 h时,全部耐药菌株D570nm均大于敏感菌株D570nm,差异均有统计学意义(P<0.001,P<0.05)。见表2。该结果说明,耐药株形成的生物膜生物量明显高于敏感株。
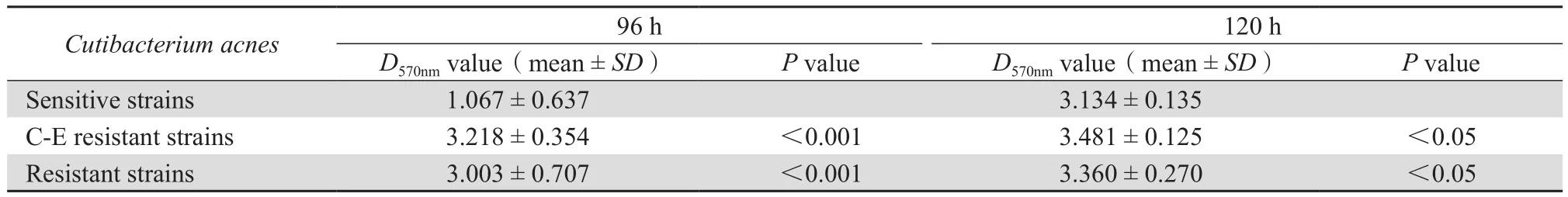
表2 培养至96 h和120 h时不同耐药性菌株生物膜生物量Table 2 Cutibacterium acnes biofilm biomass after cultivation for 96 h and 120 h
2.3 生物膜内活菌数量检测
培养至96 h和120 h时,刃天青染色测量不同耐药性菌株的560Ex/590Em,培养至96 h和120 h时,全部耐药菌株荧光值均大于敏感菌株荧光值,差异均有统计学意义(P均<0.05)。见表3。该结果说明,耐药株所形成的生物膜内活菌数量明显高于敏感株。
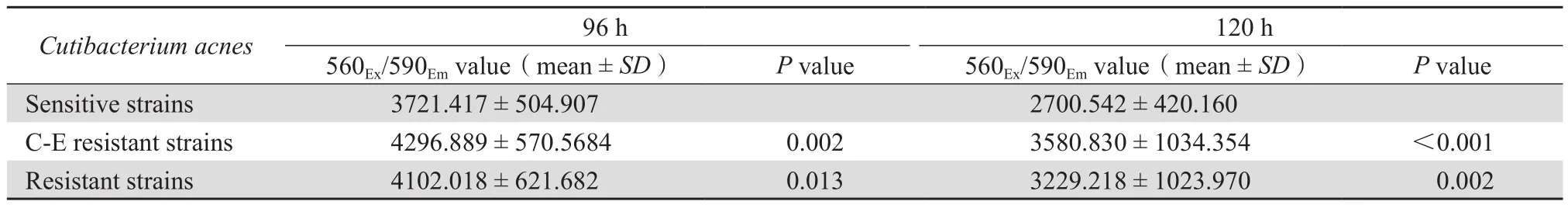
表3 培养至96 h和120 h时不同耐药性菌株生物膜内活菌数量Table 3 Live bacteria in C. acnes biofilm after cultivation for 96 h and 120 h
2.4 生物膜形态的观察
与结晶紫染色和刃天青染色结果一致,培养至120 h时使用激光共聚焦显微镜观察克林霉素-红霉素双重耐药株与敏感株生物膜形态,发现两者具有明显差异。克林霉素-红霉素双重耐药株形成的生物膜能够牢固地附着于玻璃底荧光皿底部,经PBS水洗后仍未与玻璃底荧光皿底部脱离。在激光共聚焦显微镜下可见玻璃底荧光皿底部均匀附着一层膜状结构,其内部痤疮丙酸杆菌较为整齐地排列成链条状(图1A、C)。而抗菌药物敏感的痤疮丙酸杆菌形成的生物膜附着不牢固,经过PBS水洗后大部分与玻璃底荧光皿底部脱离,分散成块状漂浮。在激光共聚焦显微镜下虽可以看到生物膜内痤疮丙酸杆菌相互聚集,但排列杂乱,无规律结构(图1B、D)。
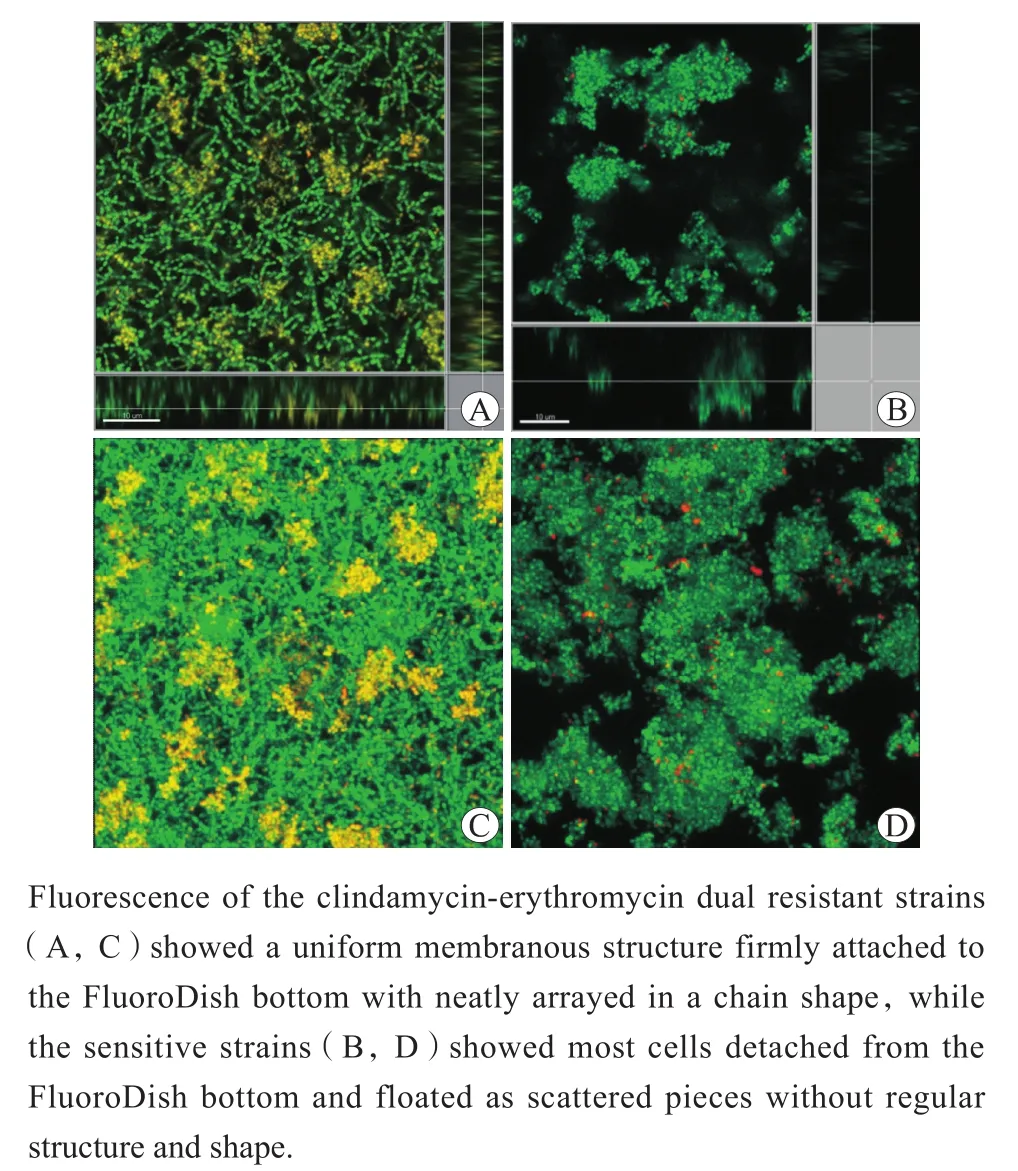
图1 培养至120 h时激光共聚焦显微镜观察不同耐药性菌株生物膜形态Figure 1 The morphological features of Cutibacterium acnes biofilm after cultivation for 120 hours observed under a confocal laser scanning microscope
3 讨论
痤疮是一种好发于青春期的毛囊皮脂腺单位的慢性炎症性皮肤病。痤疮的临床特征包括粉刺、丘疹、脓疱、结节、囊肿,愈后可留有不同程度的瘢痕,给患者身心健康带来很大影响。痤疮的发病机制仍未完全阐明,目前认为发病机制中的关键因素包括胰岛素、胰岛素样生长因子-1、雄激素等激素分泌增加、皮脂腺过度分泌、毛囊皮脂腺导管角化异常以及炎症和免疫反应[10]。其中,痤疮丙酸杆菌的大量繁殖与痤疮发生密切相关[2]。
几十年来,抗菌药物一直是治疗痤疮的关键手段。四环素类、甲氧苄啶-磺胺甲唑、甲氧苄啶、大环内酯类、阿莫西林和头孢氨苄的疗效已得到证实[11]。然而,痤疮丙酸杆菌的耐药率正在不断上升。其中,痤疮丙酸杆菌对红霉素和克林霉素的耐药率高达50%[12]。一些痤疮丙酸杆菌甚至表现出对多种抗菌药物的耐药性。一项体外实验表明,痤疮丙酸杆菌对硫酸新霉素、克林霉素、红霉素的耐药率分别为11.7%、33.4%、49.3%,对多黏菌素B和莫匹罗星则表现出了完全耐药性[13]。
细菌生物膜的存在可能在对抗菌药物耐药中起着关键作用。生物膜有三个关键的组成部分:细菌细胞、供细菌附着的平面,以及细胞外的多糖蛋白复合物。生物膜的耐药机制包括细菌分泌的多糖蛋白复合物阻碍了抗菌药物的渗透,生物膜深部的休眠细胞的生长速率和代谢率低,特定耐药基因的表达,通过自诱导分子从周围环境整合信息等[14-16]。Jahns等[17]发现痤疮患者皮损中痤疮丙酸杆菌生物膜的检出率(37%)明显高于良性色素痣患者(13%)。Kravvas等[18]发现,生物膜与痤疮、湿疹、化脓性汗腺炎、甲真菌病、粟粒疹和脓疱病的发病有关。然而,目前尚无体外研究报道痤疮丙酸杆菌生物膜形成与抗菌药物耐药的关系。
本研究比较了不同痤疮丙酸杆菌菌株的生物膜形成能力,并分析了生物膜形成与抗菌药物耐药性的关系。在我们之前的研究中发现,BHI补充培养基是体外构建痤疮丙酸杆菌生物膜的理想培养基。使用结晶紫染色法检测生物膜生物量,刃天青染色法检测生物膜内的活菌数量,使用激光共聚焦显微镜观察生物膜结构。培养96 h和120 h后,耐药株的生物膜生物量(D570nm)和生物膜内的活菌数量(560Ex/590Em)显著高于敏感株。此外,耐药株的生物膜经过洗涤后,仍能牢固附着在玻璃底荧光皿底部,形成均匀的膜状结构,并且生物膜内部痤疮丙酸杆菌整齐地排列为链条状。而敏感株的生物膜经过洗涤,从玻璃底荧光皿底部脱落,呈分散状漂浮,其内部的痤疮丙酸杆菌虽然相互聚集,但排列杂乱无章。
本研究结果表明,痤疮丙酸杆菌生物膜的形成与其耐药有关。此外,与其他耐药菌株相比,克林霉素-红霉素双重耐药菌株所形成的生物膜内部活菌数量更多,这表明生物膜的形成可能与双重或多重耐药性有关。
针对痤疮丙酸杆菌生物膜从植物提取的白藜芦醇[19]、大花红景天中提取的红景天苷等都表现出了抗痤疮丙酸杆菌生物膜的特性[20]。这些天然药物的疗效与其他抗菌药物相当,但不良反应比后者要小。自诱导分子(autoinducers,AI)是细菌群体感应(QS)机制中的一种分子信号,在细菌生物膜形成过程中发挥着重要作用。因此针对AI进行的药物研发在治疗生物膜相关疾病中具有广阔的前景。Brackman等[21]发现两种噻唑烷二酮类衍生物(TZD8和TZD10)是潜在的QS抑制剂,能够在亚抑菌浓度(sub-MIC)下促进痤疮丙酸杆菌生物膜内细菌解聚播散而不抑制细菌生长,从而减少生物膜中生物量和代谢活跃的细菌数量。其与抗菌药物联用可增强生物膜对抗生素的敏感性,有效改善耐药状况。Bumah等[22]发现450 nm脉冲蓝光照射可破坏痤疮丙酸杆菌生物膜的结构,导致生物膜解体,这表明激光治疗可能是痤疮丙酸杆菌相关疾病的一种新型治疗手段。

