氧化应激对慢性阻塞性肺疾病上皮-间质转化的影响
胡进秀,崔节达,郭晓桐,郝斌威,陈 娟
(1.宁夏医科大学临床医学院,银川750004;2.宁夏中卫市人民医院呼吸与危重症医学科,中卫755000;3.宁夏医科大学总医院呼吸与危重症学科,银川750004;4.山西白求恩医院,山西医学科学院呼吸与危重症医学科,太原030000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种不可逆的慢性炎症性肺疾病[1]。研究[2]显示,2015年COPD疾病导致320万人死亡,患病人数达1.74亿人次。我国40岁以上人群COPD患病率达13.6%[3]。因此研究COPD的发病机制显得尤为重要,探索早期干预和治疗措施是COPD防控工作的重点,也是改善COPD患者生活质量的关键。
COPD的特征是慢性支气管炎、慢性气道阻塞、气道重塑和肺气肿所导致的肺功能逐渐且不可逆转的下降[4]。气道间充质细胞(例如,成纤维细胞、气道平滑肌细胞等)通过增殖,收缩蛋白表达和释放介质(例如,介体、细胞外基质蛋白和基质金属蛋白酶)促进气道重塑[5],表明气道重塑过程中存在上皮-间质转化(epithelial-mesenchymal transition,EMT)。随着研究的深入,越来越多的证据表明EMT存在于许多疾病的发生过程中,并发挥重要作用[6]。
总抗氧化能力(total antioxidant capacity,TAOC)是抗氧化应激系统的重要构成部分,也是评估生物有机体抗氧化系统能力的综合参数[7]。COPD的主要驱动机制是通过多种相互作用的分子机制,肺部氧化应激增加实现的[8]。其中,F2异前列腺素家族被提议作为氧化应激的新指标[9]。其异构体之一的8-异前列腺素F2α(8-Isoprostaglandin F2α,8-iso-PGF2α)也是评估氧化应激的磷脂膜的重要生物标记物[10]。氧化应激作为COPD发病机制之一,也是引发气道重塑的重要机制,在COPD发生、发展中有着极为重要的作用。有报道[6]指出,EMT与COPD疾病密切相关,证明气道上皮细胞有可能发生EMT。EMT的调控机制十分复杂,本研究拟探讨COPD是否存在EMT现象及COPD中EMT的发生与氧化应激的可能关系。
1 材料与方法
1.1 材料
兔抗E-钙粘连蛋白(E-cadherin,E-Ca)抗体(Abcam公司),兔抗纤维连接蛋白(fibronectin,FN)抗体(Abcam公司),山羊抗兔、兔辣根过氧化物酶抗体、血清封闭液、苏木素、伊红等免疫组化试剂均购自北京中杉金桥生物有限公司。组织总蛋白提取试剂盒及BCA法蛋白含量测定试剂盒(南京凯基生物公司)。
1.2 研究对象与分组
收集2015年1月至2017年12月宁夏医科大学总医院心胸外科因肺部肿瘤需行肺叶切除的患者,术前完善肺功能检查,按照2017版慢性阻塞性肺疾病全球倡议(GOLD指南)分为肺功能正常(对照)组(20例)和肺功能异常(COPD)组(16例)。术前纳入所有患者一般资料:性别、年龄、吸烟史、动脉二氧化碳分压(PCO2)、动脉氧分压(PO2)、第一秒用力呼气量/用力肺活量(FEV1/FVC%)和一秒容积占预计值的百分比(FEV1 %pred)。术中获取新鲜肺组织,进行石蜡包埋及液氮冻存。本研究经宁夏医科大学总医院科研伦理委员会批准(2016-205),并获得患者知情同意书。
1.3 研究方法
1.3.1 HE染色观察COPD肺组织气道形态学改变 肺组织病理切片经脱蜡、水化、苏木素和伊红染色、梯度乙醇脱水、二甲苯透明、封片,显微镜下观察组织病理学变化。
1.3.2 免疫组织化学检测肺组织EMT标记物E-Ca和FN的表达 肺组织病理切片经脱蜡、水化、高压修复6 min待修复液自然冷却后,加3%H2O230 min,山羊血清封闭1 h,一抗4℃过夜孵育(1∶200稀释E-Ca抗体,1∶250稀释FN抗体);次日37℃复温1 h后,滴加二抗试剂1,37℃孵育40 min,滴加二抗试剂2,37℃孵育40 min,DAB显色(显微镜下观察)、苏木素复染、梯度乙醇脱水、二甲苯透明、封片、显微镜下采图。阴性对照以磷酸盐缓冲溶液(PBS)替代一抗。采用Image J软件对病理切片进行分析,得出每个视野气道上皮细胞E-Ca及FN蛋白着色的平均光密度(average optical density,AOD)值。
1.3.3 蛋白免疫印迹法检测肺组织中E-Ca和FN的表达情况 提取肺组织总蛋白后测定组织总蛋白含量,每孔蛋白上样40 μg,通过8%聚丙烯酰胺凝胶(PAAG)转移至PVDF膜,5%脱脂奶粉封闭1.5 h后,分别加入目的蛋白的抗体(兔抗人E-Ca抗体,稀释浓度1∶1 000;兔抗人FN抗体,稀释浓度1∶2 000);4℃过夜,TBST洗4次每次8 min,人抗兔二抗(1∶5 000)孵育1.5 h,洗膜,免疫印迹曝光,使用软件Image J对图像进行扫描和分析确定目标蛋白与内参的比值。
1.3.4 酶联免疫吸附剂测定(ELISA)法检测血清中8-iso-PGF2α和T-AOC的浓度 收集COPD组及对照组患者术前静脉血,1 500 r·min-1离心15 min,吸取血清进行8-iso-PGF2α和T-AOC ELISA检测,标准品和待测样品每孔50 μL,立即加入100 μL 1×辣根过氧化物酶标记的检测抗体工作液。覆盖遮光膜,在37℃温箱孵育60 min,用力甩去孔中液体,加1×洗涤液350 μL/孔,浸泡1 min/次,甩去洗涤液。重复5次(洗板机操作)。同时分别加入50 μL 1×底物A工作液,1×底物B工作液,覆盖遮光膜,放入37℃温箱孵育20 min。加入终止液50 μL,立即用酶标仪测量波长450 nm处光密度值。计算AOD值。
1.4 统计学方法
采用SPSS 26.0统计学软件进行分析,计量资料进行方差齐性检测,用均值±标准差(±s)表示,组间比较采用两组独立样本t检验,计数资料以例数或率(%)表示,组间比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 COPD组及对照组患者一般情况比较
COPD组及对照组在性别、年龄、吸烟史、PCO2及PO2方面差异均无统计学意义(P均>0.05),COPD组肺功能指标FEV1/FVC%、FEV1%pred均低于对照组(P均<0.05),见表1。
表1 COPD组及对照组患者一般情况比较(±s)
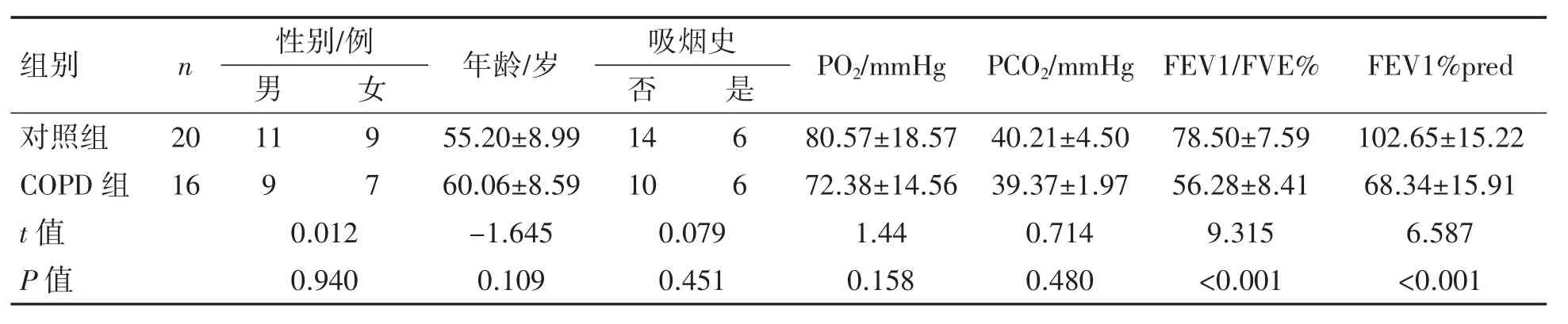
表1 COPD组及对照组患者一般情况比较(±s)
?
2.2 COPD组与对照组患者小气道的病理形态学改变情况
HE染色结果显示:与对照组相比,COPD组患者小气道上皮细胞增生明显,上皮细胞排列紊乱,小气道平滑肌细胞增生,见图1。

图1 COPD组与对照组小气道的病理形态学改变情况(HE×400)
2.3 COPD组与对照组患者肺组织中EMT标记物E-Ca及FN的表达情况
免疫组织化学结果示:E-Ca在气道上皮细胞中的表达COPD组(0.142±0.068)低于对照组(0.256±0.067)(P=0.016),见图2;FN在小气道上皮细胞中的表达COPD组(0.156±0.043)高于对照组(0.072±0.058)(P=0.035),见图3。免疫印迹检测结果显示:E-Ca蛋白表达量COPD组(0.36±0.20)低于对照组(0.84±0.46)(P=0.003),FN蛋白表达量COPD组(0.60±0.22)高于对照组(0.39±0.22)(P=0.026),见图4。
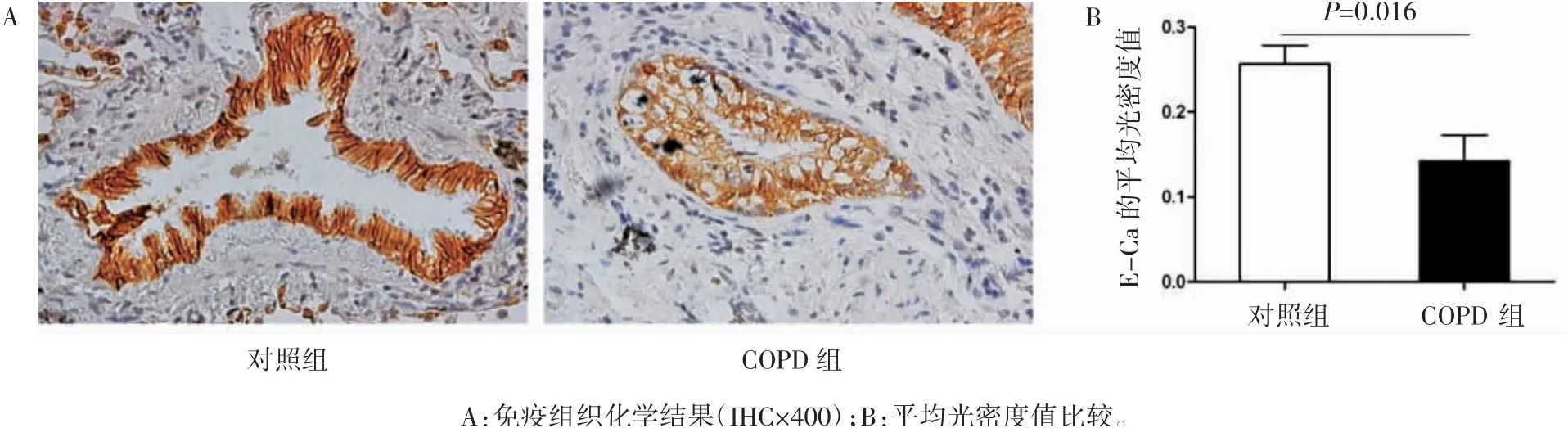
图2 肺组织气道上皮中E-Ca的表达情况

图3 肺组织气道上皮中FN的表达情况
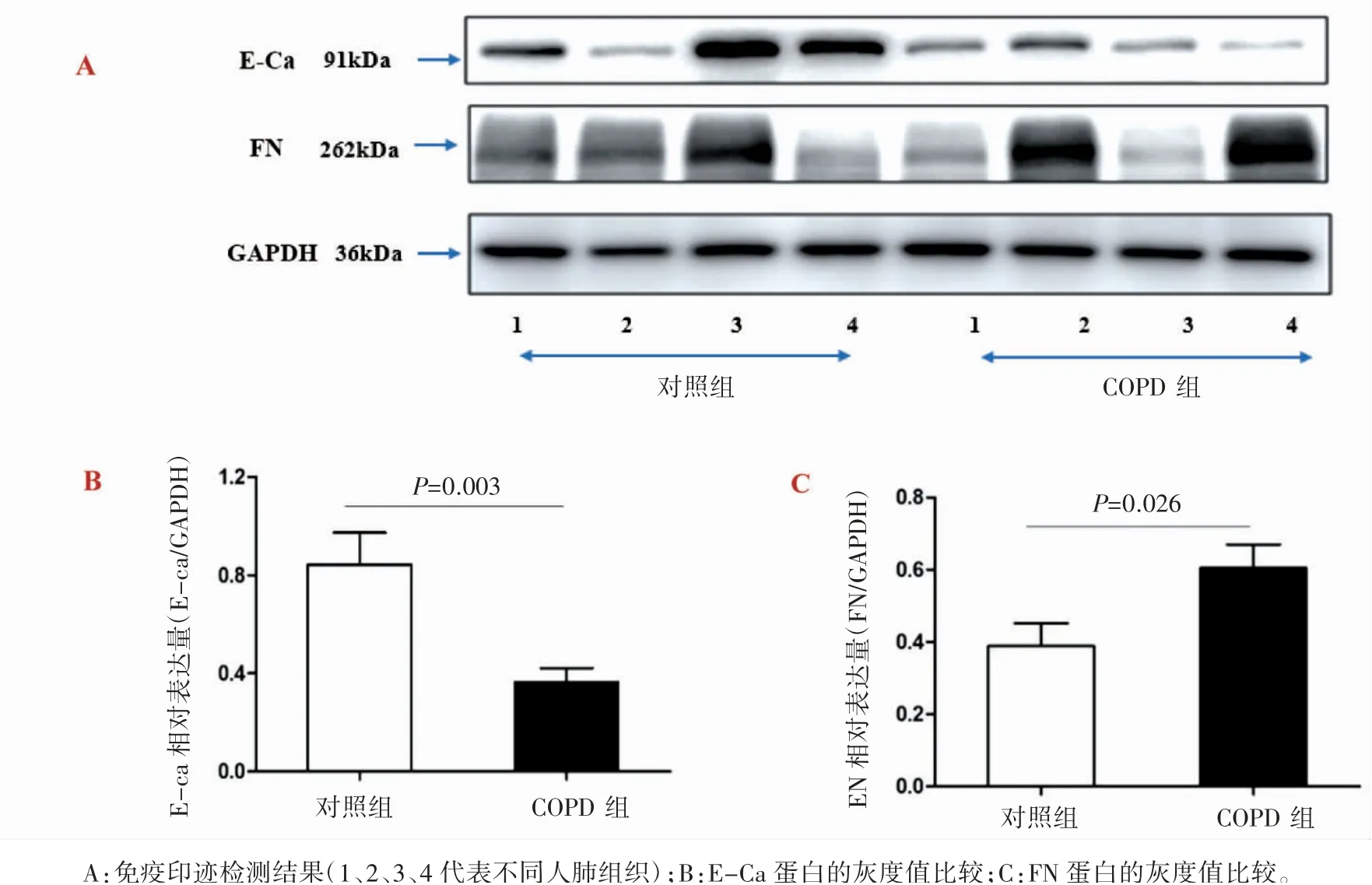
图4 肺组织气道上皮中E-Ca、FN蛋白表达情况
2.4 COPD组与对照组患者血清中8-iso-PGF2α和T-AOC水平比较
ELISA法检测结果:COPD组血清8-iso-PGF2α浓度[(45.91±21.17)pg·mL-1]高于对照组[(29.74±15.88)pg·mL-1](P=0.013);而COPD组血清T-AOC浓度[(8.49±3.43)U·mL-1]低于对照组[(13.35±4.28)U·mL-1](P=0.001)。
3 讨论
COPD是严重危及人类生命健康的慢性疾病之一,其罹患率和病死率较高,COPD发病机制较为复杂,目前尚未完全探明。气道重塑和氧化应激在COPD发生、发展中的作用已达成共识,但潜在的机制仍不清楚[11]。有研究[12-13]表明,COPD患者气道重塑有EMT出现,在COPD气道重塑过程中,上皮细胞功能的异常可促使EMT的发生,是COPD气道重塑的新发机制,但氧化应激是否参与小气道EMT在COPD中的作用目前研究较少。EMT失去上皮细胞等特性:紧密连接、纤毛和顶端基底极性,转变成具有间质细胞特性:迁移、侵袭和细胞外基质[14]。EMT发生的标志是上皮标记物细胞黏附分子E-Ca的丧失,间质标记物FN等表达的增多,大量证据显示EMT参与肿瘤的发生、发展[6],还和许多纤维化疾病有关(肺纤维化和眼纤维化),同时与乳腺癌、肺癌和胃癌等疾病也密切相关[15]。
本研究结果显示,COPD患者肺组织存在小气道上皮细胞增生和排列紊乱,气道上皮细胞的形态及结构较对照组发生明显改变,表明COPD患者存在以上皮细胞结构和功能改变为主的气道重塑;免疫化学组织染色及免疫印迹检测结果表明:COPD组中EMT间质表型标记物FN高表达、上皮表型标记物E-Ca低表达,提示COPD患者小气道上皮细胞存在明显的EMT现象,EMT的发生、发展可能在COPD气道重塑的病理机制中发挥着重要作用。氧化应激的产生是由于活性氧(ROS)的存在削弱了内源性抗氧化剂防御能力和(或)使其不堪重负[16]。有研究[17]表明,氧化应激可能推动了COPD的发病机制及其进展[18]。也有研究表明[19],氧化应激会引起小鼠气道壁增厚和胶原蛋白沉积,随后出现气道重塑及肺气肿的一系列病理改变。氧化应激是COPD重要的发病机制,氧化应激的增加是驱动COPD生理、病理的主要机制,过多的自由基会损害脂肪组织和DNA,从而导致基因表达异常、增殖障碍和细胞死亡。F2异前列腺素是由花生四烯酸的非酶自由基引发的过氧化作用产生的,常被用作脂质损伤过程中氧化应激的准确量度[17]。在F2异前列腺素中,8-iso-PGF2α具有结构稳定性、非饮食性和内源性抗氧化剂调节特性以及易于在生物学中检测液体等优势,被认为是评估内源性脂质过氧化作用的非侵入性分析因子[20]。评估生物液体中8-iso-PGF2α的水平可以被认为是研究自由基和脂质过氧化在癌症发病机制中作用的一种新颖且可靠的生物标志物[21]。T-AOC可以迅速反映出对外部刺激的补偿能力和生物体内自由基的代谢能力[22]。本研究结果显示,COPD组患者血清中氧化产物8-iso-PGF2α表达高于对照组,抗氧化产物T-AOC表达低于对照组,表明COPD患者体内存在氧化应激。
EMT的调控机制非常复杂,可表现在不同水平上(表观遗传修饰、转录控制、选择性剪接、蛋白质稳定性和亚细胞定位等),COPD患者肺组织中EMT的调控作用和机制目前不明确,Courtney等[23]研究发现,转化生长因子β可通过Smad及Wnt/β-catenin途径诱导COPD中EMT的发生,本课题组前期研究[24]数据表明,TGFβ-NOX4-ROS途径通过促进气道平滑肌增殖变性诱发气道重塑,因此推测ROS可能是EMT发生、发展的重要调控位点。本研究发现,COPD组肺组织小气道中存在明显的EMT现象,同时COPD组患者血清中伴有氧化标记物的增高和抗氧化物的降低,COPD组体内存在明显的氧化应激,推测氧化应激与EMT的发生密切相关,氧化应激通过某种途径诱发COPD患者EMT的出现,诱发COPD患者出气道重塑等病理改变。因此抗氧化药物的研究应用可能对COPD患者EMT的逆转起到一定作用。
综上所述,COPD患者肺组织存在明显的EMT及氧化应激现象,氧化应激可能通过某种机制参与调控EMT机制,参与COPD的发生、发展,其具体作用机制有待进一步研究。

