小鼠动情周期卵巢、子宫及输卵管中氧化应激水平及意义
杨延周,陈敏慧,李可可
(1.宁夏医科大学生育力保持教育部重点实验室,银川750004;2.宁夏医科大学第二临床医学院,银川市第一人民医院急诊科,银川750001)
近年来有研究[1-2]显示,氧化应激(oxidative stress,OS)和适度的活性氧(reactive oxygen species,ROS)在雌性哺乳动物生殖过程中起着重要的作用,过多的ROS可引起生殖系统疾病。有研究[3]报道,生理水平的ROS参与许多的雌性生殖过程,如卵泡发育、卵母细胞成熟和排卵。此外,累积的OS和抗氧化剂还原型谷胱甘肽(glutathione,GSH)的耗竭引起细胞凋亡,ROS引起卵泡闭锁和颗粒细胞凋亡。
动情周期是雌性哺乳动物生殖系统特征之一,动情周期中激素和生殖器官可发生节律性变化[4],而生殖器官如卵巢和子宫的节律性变化受类固醇激素的调控。小鼠血清雌二醇(estrogen,E2)水平在动情前期达到峰值,一直持续到动情期直到排卵,在动情后期降低,在间情期维持较低的基础水平,孕激素(progesterone,P4)的节律性变化与雌激素相反[5],此外,动情周期中的促乳素也发生节律性的变化[6]。近来的研究[7]发现,E2与心血管的OS密切相关,P4与人黄素化的颗粒细胞功能密切相关[8]。
尽管OS参与多个哺乳动物生殖过程[9-11],但是OS在雌性哺乳动物动情周期中的动态变化尚不清楚,动情周期OS动态变化是否与类固醇激素的变化相关也不清楚。因此,本研究主要探究了动情周期的OS水平,进而为揭示其在雌性小鼠生殖过程中的作用及机制奠定基础,对进一步揭示生殖疾病的发病机制具有重要的作用及意义。
1 材料与方法
1.1 实验动物
6~8周龄ICR雌性小鼠购自宁夏医科大学实验动物中心(动物许可证号:2020-0001)。实验动物饲养在特定的温度及适度条件下,给予标准的饲料喂养,并且自由饮食,所有的实验操作程序都严格按照宁夏医科大学动物伦理委员会的要求进行。应用阴道涂片方法确定小鼠的动情周期[12-14]。
1.2 免疫组织化学
收集小鼠动情前期、动情期、动情后期及间情期的输卵管伞部、壶腹部、峡部和子宫角,并立即固定在4%的多聚甲醛中,24 h后组织经脱水、透明及浸蜡处理之后,用石蜡包埋,切片(厚度为6 μm)。石蜡切片经过脱蜡、脱水之后进行抗原热(96~98℃)修复20 min,抗原修复液为0.1 mol·L-1柠檬酸、0.1 mol·L-1柠檬酸钠和水按9∶41∶450配制。免疫组化程序按相关文献[14-16]及试剂盒说明书(天根生化科技有限公司,北京)操作如下:0.3%过氧化氢-甲醇处理10 min消除内源性过氧化物酶,0.01 mol·L-1PBS液洗片3次,每次5 min,10%山羊血清处理30 min以消除非特异性结合。然后分别加入兔抗超氧化物歧化酶1(SOD1)(1∶200;abcam,ab183881)和兔抗8-羟基鸟嘌呤DNA糖苷酶1(OGG1)(1∶200;proteintech,15125-1-AP)抗体,4℃过夜,0.01 mol·L-1PBS洗片3次,每次5 min;加入山羊抗兔二抗,孵育1 h后,0.01 mol·L-1PBS洗片3次,每次5 min;DAB显色(天根生化科技有限公司,北京),苏木精复染细胞核后中性树胶封片。在显微镜下观察组织显色情况,棕黄色为阳性,即蛋白表达部位。
1.3 实时荧光定量(PCR)实验
收集小鼠动情前期、动情期、动情后期及间情期的卵巢和子宫角,立即加入Trizol提取卵巢和子宫总RNA,RNA提取按照本实验室常规操作进行。测定提取的RNA的OD值,并计算RNA浓度,随之进行反转录,反转录过程按照试剂盒(RR036Q,TaKaRa)操作程序进行,10 μL体系包括:5X PrimeScriptTMRT Master Mix(Perfect Real Time)2 μL,总RNA 500 ng,加无RNA酶水至10 μL;反转录条件为:37℃15 min,85℃5 s,4℃暂时保存或直接用于下游qPCR反应。荧光定量PCR程序按照试剂盒说明书(RR820A,TaKaRa)进行。20 μL体系包括:TB GreenTMPremix Ex TaqⅡ(Tli RNaseH Plus)(2×)10 μL,上游引物(10 μmol·L-1)0.8 μL,下游引物(10 μmol·L-1)0.8 μL,cDNA 2 μL,ROX Reference Dye or DyeⅡ(50×)0.4 μL,灭菌水6 μL,总体积20 μL;反应条件根据试剂盒说明书及PCR仪采用两步法:1)预变性:重复1个循环,95℃30 s;2)PCR反应:40个循环,95℃5 s,60℃30 s。引物序列见表1。
表1 引物序列
1.4 Western blot实验
动情前期、动情期、动情后期及间情期卵巢和子宫角的OGG1和SOD1蛋白表达水平应用Western blot方法进行检测,具体操作方法参考本课题组已发表文章[17]。步骤如下:提取总蛋白后应用BCA法测定蛋白浓度,然后行SDS-PAGE电泳,电泳后转膜,5%脱脂奶粉室温摇床振荡封闭1 h后,加入稀释好的兔抗SOD1(1∶1 000;abcam,ab183881)和 兔 抗OGG1(1∶1 000;proteintech,15125-1-AP)抗体,4℃摇床孵育过夜,应用TBST缓冲液洗膜3次(每次15 min),加入稀释好的山羊抗兔二抗,室温下孵育1 h后TBST缓冲液振荡冲洗3次(每次15 min)。最后根据ECL化学发光试剂盒(Thermol,美国)说明书在聚偏二氟乙烯(PVDF)膜上加入适量发光液曝光。Western blot条带灰度值应用Image J软件进行统计。
1.5 统计学方法
采用SPSS 22.0软件对数据进行分析。所有实验每个组至少重复3次,计量资料以均数±标准差(±s)表示,组间比较采用t检验或方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 小鼠动情周期不同阶段子宫角和输卵管SOD1免疫组化结果
SOD1蛋白主要定位于子宫内膜腔上皮和腺上皮细胞,定位于输卵管上皮细胞。间情期子宫角SOD1呈现高阳性表达,动情前期有弱阳性表达,动情期和动情后期无阳性。动情期所有输卵管SOD1呈现高阳性染色,动情期中输卵管壶腹部比伞部和峡部有更深的染色,在动情前期和动情后期输卵管伞部、峡部有弱阳性,壶腹部无阳性,间情期无阳性,见图1。

图1 小鼠动情周期子宫角和输卵管伞部、峡部和壶腹部SOD1的免疫组化结果(×400)
2.2 小鼠动情周期不同阶段子宫角和输卵管OGG1免疫组化结果
OGG1蛋白定位与SOD1一致。OGG1在动情前期子宫角有弱阳性表达,间情期有较高阳性的表达,动情期和动情后期呈阴性染色。OGG1在动情期所有输卵管呈现高阳性染色,但是在输卵管伞部有更深的染色,动情前期和动情后期的OGG1染色呈阴性,而在间情期输卵管壶腹部和峡部有较弱的染色,在伞部观察不到染色,见图2。

图2 小鼠动情周期子宫角和输卵管伞部、峡部和壶腹部OGG1的免疫组化结果(×400)
2.3 小鼠动情周期不同阶段血清中OS指标
ELISA方法检测动情周期血清中8-羟基脱氧鸟苷(8-OHdG)、丙二醛(MDA)、GSH和超氧化物歧化酶(SOD)的水平。结果显示:动情期血清中8-OHdG和MDA的含量高于其他实验组(P<0.05);动情前期的GSH含量高于其他实验组(P<0.05),SOD在动情周期的各个阶段差异无统计学意义,见图3。

图3 ELISA方法检测小鼠动情周期不同阶段血清中的OS指标
2.4 小鼠动情周期不同阶段卵巢和子宫角组织中SOD1和OGG1基因水平表达
PCR实验检测小鼠动情周期不同阶段卵巢和子宫角中SOD1和OGG1的mRNA表达,结果显示动情期卵巢、子宫角中SOD1和OGG1的mRNA水平低于间情期(P均<0.05),见图4。
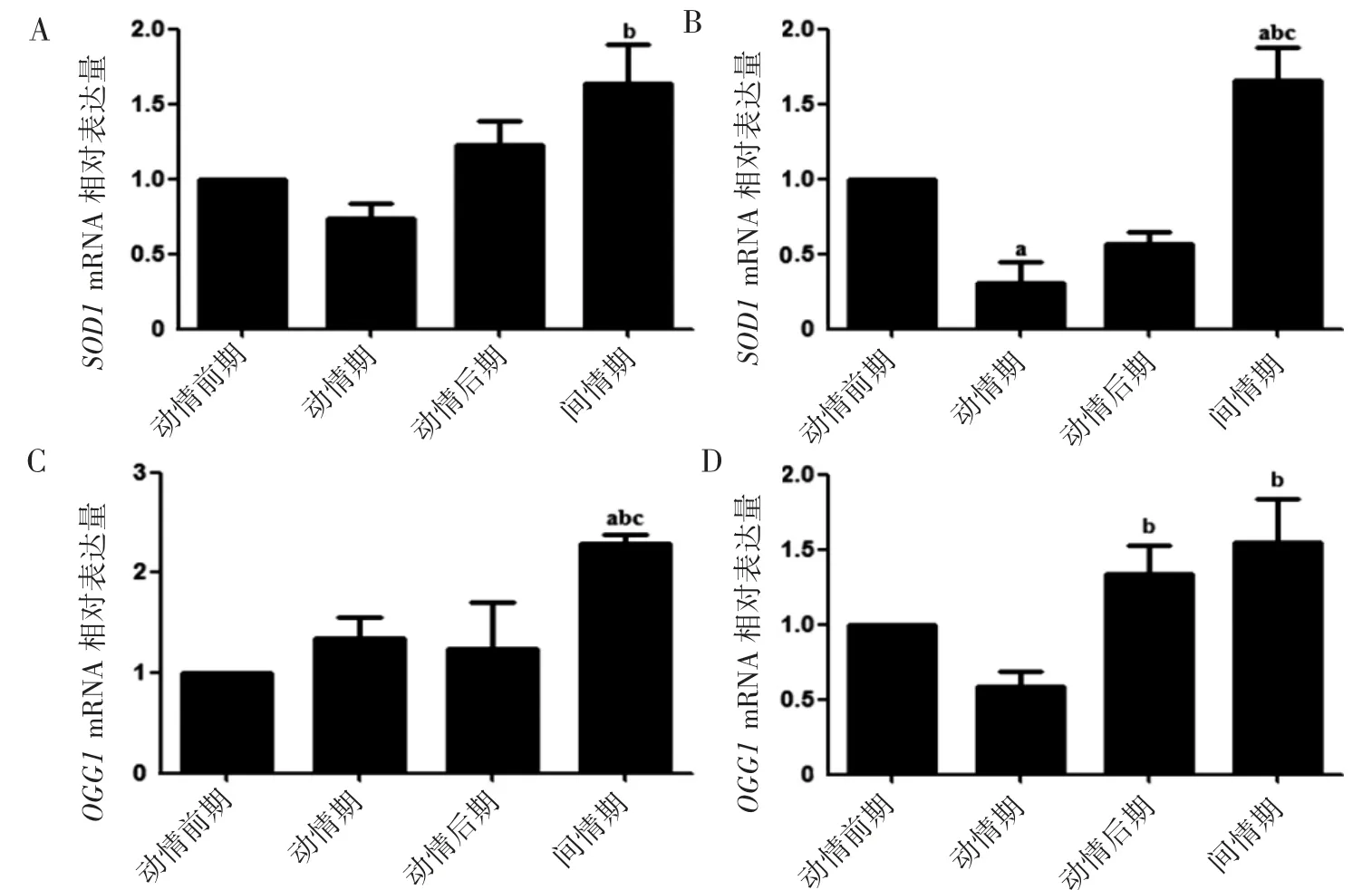
图4 PCR实验检测小鼠动情周期不同阶段卵巢和子宫角中SOD1和OGG1的mRNA表达
2.5 小鼠动情周期不同阶段卵巢和子宫角组织中SOD1和OGG1蛋白表达的结果
Western blot检测小鼠动情周期不同阶段卵巢和子宫角中SOD1和OGG1的蛋白表达,SOD1和OGG1在卵巢、子宫角组织中的蛋白表达情况与PCR结果一致,动情期SOD1和OGG1蛋白水平低于间情期(P均<0.05),见图5。
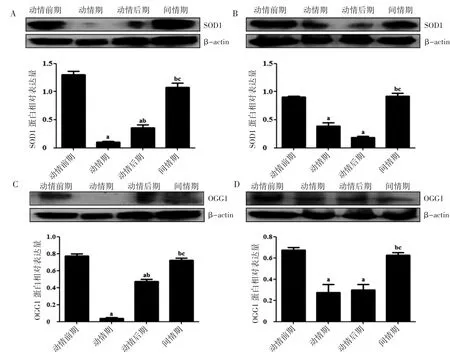
图5 Western blot检测小鼠动情周期不同阶段卵巢和子宫角中SOD1和OGG1的蛋白表达
3 讨论
OS是由于机体ROS产生过多,从而造成氧化/抗氧化失衡的状态。而机体促氧化与抗氧化失衡可导致许多生殖疾病,如子宫内膜炎、多囊卵巢综合征及一些不明原因的不孕[18],但是正常动情周期中的OS水平如何变化尚不清楚。正常小鼠动情周期中OS标记物MDA、8-OHdG以及抗氧化标记物SOD和GSH在动情周期不同阶段血清中的表达规律如何变化亦不完全清楚。本研究结果显示,MDA、8-OHdG、SOD、GSH广泛地表达于小鼠动情周期的各个阶段,证明正常小鼠卵巢组织中OS状态和抗氧化防御系统存在于动情周期的各个阶段,在动情期高水平表达的8-OHdG和MDA说明在动情期OS水平最高。而出现这种高水平的OS状态可能与正常小鼠卵巢组织中生殖活动及相关疾病有关[19]。且动情周期中的OS变化规律可能与雌激素、孕激素的变化密切相关。的确,许多研究证实雌激素、孕激素参与调节OS及ROS[20]。
SOD是抗氧化酶类,与卵母细胞质量相关,可保护卵母细胞免受损伤。哺乳动物中SOD主要有三种亚型:细胞内CuZn-SOD(SOD1)存在于胞质中,线粒体Mn-SOD(SOD2)分布于线粒体基质,细胞外CuZn-SOD(SOD3)分布于细胞外液、局部淋巴、骨液和血浆。但主要以SOD1为主,占90%。因此,本研究主要探究了SOD1在小鼠动情周期卵巢、输卵管及子宫角中的变化规律。卵泡液中高水平的SOD可有效减轻卵母细胞及卵丘细胞中OS导致的DNA损伤,从而使卵母细胞成功受精。故SOD表达于正常小鼠动情周期的各个阶段,揭示了卵巢组织、细胞抗OS的存在和SOD的抗氧化保护作用。GSH是储存于卵母细胞中的主要非酶类抗氧化物,其可保护受精卵及早期胚胎免受OS伤害。相比于未成熟卵母细胞,成熟的卵母细胞中含有更高水平的GSH,据此认为高水平GSH是卵母细胞胞质成熟的标志。GSH在维持细胞内还原状态、保护细胞免受OS伤害中起重要作用,GSH在细胞和胚胎中不仅起防御氧化损伤的作用,还发挥着多种重要作用,如参与DNA合成、转录、细胞因子活化及凋亡过程,GSH也执行多种细胞内及细胞外功能,对ROS类及外源性物质有解毒作用。所以GSH高表达在正常小鼠卵巢动情周期的前期可能与卵母细胞的成熟、抗氧化保护作用有关。因此,OS状态及ROS水平的高低在正常小鼠中可能与生殖器官中生理、病理活动密切相关。如促进卵母细胞受精作用;对卵母细胞的DNA、蛋白质、脂质有损害和及时保护作用;排卵;卵子发育;卵母细胞的成熟等。
排卵是一个复杂的生殖过程,也是一个类炎症过程[21],且受到多种因素的调控,包括前列腺素、水解酶、细胞因子、一氧化氮、类固醇激素及ROS。排卵前卵泡的ROS水平被认为是诱导排卵的主要因素之一[19],特别是在排卵的过程中产生大量的ROS[22],而排卵发生在动情期,因此,动情期高水平的氧化应激可能参与排卵过程。此外,促黄体生成素(LH)脉冲在诱发排卵过程中发挥着至关重要的作用,而LH脉冲过程中产生的炎症因子诱导ROS的产生,抑制这些炎症因子导致排卵失败。因此,ROS及OS是排卵必不可少的物质[23]。ROS水平的升高及抗氧化水平的降低可促进排卵[23]。本研究结果显示,在子宫角、卵巢中的SOD1和OGG1的mRNA、蛋白表达水平及输卵管、子宫角中SOD1和OGG1免疫组化定位,在小鼠动情周期中不断发生变化,间情期表达量较高,在动情期表达量较低,提示SOD1和OGG1在动情周期中发挥重要作用。子宫是孕育生命的场所,也是胚胎着床发生的主要场所,在动情期子宫的SOD1具有抗氧化、防衰老、防止细胞核内DNA损伤、调节氧等维持正常细胞活性的重要生理功能,还具有调节细胞、保护基因组的作用,SOD1也可以调节细胞的分裂、生长及代谢进程。所以SOD1在正常小鼠子宫角、卵巢中的表达规律与改善OS状态以及参与子宫角、卵巢器官中早期胚胎的发育和保护组织、细胞免受损害有关。OGG1基因为管家基因,在所有的组织器官中均可表达,OGG1有修复线粒体DNA损伤的功能,在子宫角、卵巢器官间情期中高表达,因而推测正常小鼠动情周期的OGG1在维持遗传物质的稳定及胚胎发育过程中发挥重要作用。
本研究结果显示,子宫角与输卵管中SOD1和OGG1的免疫组化定位在小鼠动情周期中也不断发生变化,SOD1在动情期呈高阳性表达,而且在动情期壶腹部表达更高,间情期无表达;OGG1也在动情期有高阳性表达,在伞部表达更高,动情前期和动情后期无阳性。输卵管是受精和早期胚胎发育的场所,在动情周期不同阶段,可能与配子的相互作用和早期胚胎的发育有关,SOD1和OGG1这种高表达揭示正常小鼠动情期在OS因素的影响下可能与输卵管受精和早期胚胎发育以及保护受精卵有关,进而引起输卵管在生化和生理学上发生相应的变化。
综上所述,OS水平在小鼠正常的生殖器官动情周期的各个阶段是不同的,其表达范型可能与小鼠的排卵、受精及早期胚胎发育密切相关,且受到雌孕激素的调控。

