黄芩苷修复肿瘤坏死因子-α诱导MCR-5细胞损伤的实验研究
王 丽,梁 军,张 炜,黄 菱,万巧凤
(1.宁夏医科大学基础医学院病原生物学与免疫学系,银川750004;2.宁夏医科大学药学院,银川750004)
中药黄芩富含多种黄酮类化合物,如黄芩苷、黄芩素、汉黄芩苷、汉黄芩素等,其中黄芩苷是其主要活性成分,具有消炎[1]、抗氧化等[2]多种生物学作用,迄今为止,有关黄芩苷修复损伤方面的研究鲜有报道。因前期研究发现黄芩苷对流感病毒致肺损伤小鼠具有良好的保护作用[3],所以本研究拟以人胚肺成纤维细胞(MCR-5)为研究对象,以诱导细胞损伤具有显著作用的肿瘤坏死因子(tumor necrosis factor-α,TNF-α)为诱导剂,旨在进一步探讨黄芩苷修复细胞损伤的作用及可能分子机制。
1 材料与方法
1.1 实验细胞
MCR-5购自北纳创联生物科技研究院。
1.2 药品
黄芩苷购自南京春秋生物工程有限公司,批号21967-41-9,纯度大于98%,用RPMI 1640不完全培养基(含1/1000 DMSO)将其配制成1 g·L-1的母液,用0.22 μm的滤器过滤除菌,分装后保存于-20℃。
1.3 试剂
TNF-α(Cyagen,货号HETNP-01011);β-半乳糖苷酶染色试剂盒(碧云天,货号C0602);微小RNA(miRNA)提取试剂盒(QIAGEN公司);miRNA反转录试剂盒(ABI公司);Trizol(Invitrogen公司);Real-time PCR扩增试剂盒(Roche公司);沉默信息调节因子1(SIRT1)兔抗人抗体(EPitomics,货号3894-1);周期蛋白依赖性激酶6(CDK6)鼠抗人抗体(Abcam,货号ab54576);蛋白质分子量Marker(Bio-Rad,货号161-0374);HRP标记山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司,货号ZB-2301);GAPDH一抗(Abcam,货号ab8245);Western blot其他试剂由本室配备。
1.4 方法
1.4.1 细胞培养及TNF-α诱导细胞 将MCR-5细胞用完全培养液(含10%胎牛血清、100 μg·mL-1链霉素、100 U·mL-1青霉素及DMEM)培养于37℃、5% CO2培养箱中,传代3~4次后选状态良好的细胞,以终浓度为10 ng·mL-1的TNF-α进行诱导7 d[4],采用β-半乳糖苷酶染色试剂检测TNF-α诱导的MCR-5细胞活性。
1.4.2 β-半乳糖苷酶染色检测TNF-α诱导的MCR-5细胞损伤情况 本实验设3个组。正常组为未经TNF-α诱导的MCR-5细胞按5×104个/mL接种于直径为35 mm的培养皿中,加完全培养液;另2组为将TNF-α诱导7 d的MCR-5细胞接种于6个培养皿,待细胞贴壁后分为TNF-α诱导组(TNF-α10 ng·mL-1)和黄芩苷处理组(TNFα10 ng·mL-1+黄芩苷100 μg·mL-1),每组3个皿,作用72 h,进行细胞损伤检测。根据β-半乳糖苷酶染色试剂盒规定流程,完成相关操作后采用显微镜观察,在10倍物镜下,每组每个皿中随机拍5个视野,每个视野中计数50个细胞,统计损伤细胞并计算细胞损伤率。细胞损伤率(%)=损伤细胞数/总细胞数×100%[5]。
1.4.3 RT-qPCR及Western blot实验分组[6]本实验细胞分组及药物处理同1.4.2所述,每组14个皿。于37℃、5% CO2条件下分别培养48 h及72 h后,收集各组细胞。每个时间点,每组中3个皿用来提取蛋白,另外4个皿用来提取总RNA。1.4.4 RT-qPCR检测MCR-5细胞miR-22[6]表达水平 提取各组细胞总mRNA,紫外分光光度计定量。反转录体系(15 μL):RT Master Mix 7 μL;RNA 5 μL;5×RT primer(150 nmol·L-1)3 μL。条件:16℃30 min;60℃30 min;72℃5 min。引物序列:U6上游5’-GCTTCGGCAGCACATATACTAAAAT-3’,U6下游5’-GCAGGGTCCGAGGTATTC-3’;miR-22上游5’-ATGGTTCGTGCGAAGCTGCCAG TTGAAGAA-3’;miR-22下游5’-GCAGGGTCCGAGGTATTC-3’;miR-22 RT茎 环 引 物:5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCA CTG-GATACGACACAGTTCT-3’。Real-Time PCR体系(20 μL):cDNA 2 μL;引物1和引物2各1 μL(10 pmol·μL-1);SYBR Mix 10 μL;ddH2O 6 μL。避光置于荧光定量PCR仪(ABI 7500)检测miR-22表达,U6作为miR-22内参,采用2-ΔΔCT计算各个样本目的基因的表达[7]。引物由生工生物工程(上海)股份有限公司合成。
1.4.5 Western blot检测MCR-5细胞SIRT1及CDK6蛋白表达 提取各组细胞总蛋白,BCA法蛋白定量。取总蛋白40 μg,以1×样品缓冲液配平上样体积,沸水浴5 min后上样,SDS-PAGE电泳(浓缩胶80 V,分离胶100 V),半干电转膜仪转膜(30 mA,90 min);封闭后分别加入SIRT1、CDK6及GAPDH一抗(SIRT1一抗稀释度为1∶1 000;CDK6为1∶2000;GAPDH一抗为1∶10 000),4℃过夜;TBS-T漂洗液洗膜10 min,共3次;加入HRP标记的二抗(SIRT1二抗稀释度为1∶2 000;CDK6为1∶2 000;GAPDH为1∶5 000),37℃振荡60 min;加入ECL发光液,X线胶片曝光,经显影、定影、扫描后观察结果。应用Image-Pro Plus软件对扫描图像的目的条带进行灰度分析,各目的条带与GAPDH的灰度比值为目的蛋白的相对表达量。
1.5 统计学方法
采用SPSS 16.0统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 黄芩苷对TNF-α诱导的MCR-5细胞损伤率的影响
与正常MCR-5细胞比较,TNF-α诱导的MCR-5细胞的损伤率升高(P<0.01);与TNF-α诱导的MCR-5细胞比较,黄芩苷处理组细胞的损伤率降低(P<0.05),见图1。
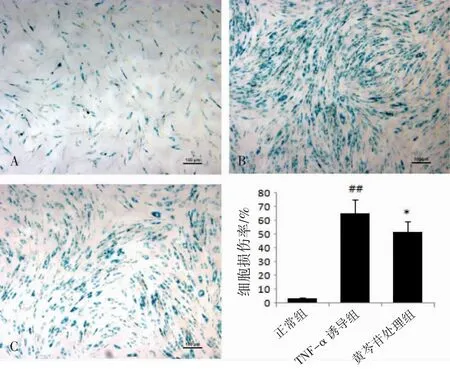
图1 黄芩苷对TNF-α诱导的MCR-5细胞损伤率的影响(±s,n=15)
2.2 黄芩苷对TNF-α诱导的MCR-5细胞miR-22表达的影响
与同时间点的正常MCR-5细胞比较,TNFα诱导的MCR-5细胞miR-22在48 h及72 h表达水平均升高(P<0.01);与同时间点的TNF-α诱导的MCR-5细胞比较,黄芩苷处理48 h、72 h的miR-22表达水平均降低(P均<0.05)。另外,正常组及黄芩苷处理组的两个时间点差异无统计学意义,而TNF-α诱导损伤组两个时间点差异有统计学意义(P<0.05);说明黄芩苷可有效抑制TNF-α诱导的MCR-5细胞miR-22的表达,见图2。
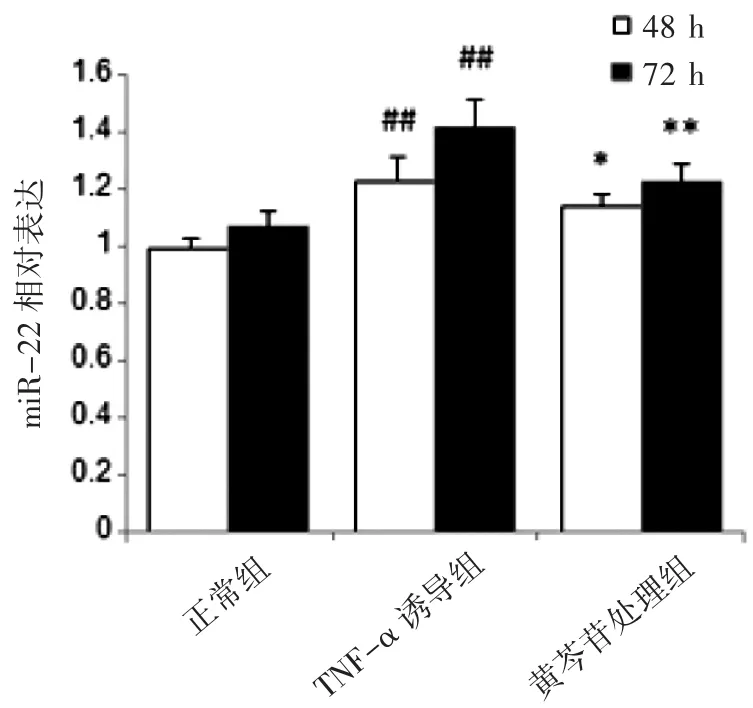
图2 黄芩苷对TNF-α诱导的MCR-5细胞miR-22表达的影响(±s,n=4)
2.3 黄芩苷对TNF-α诱导的MCR-5细胞SIRT1蛋白表达的影响
与同时间的正常MCR-5细胞比较,TNF-α诱导的MCR-5细胞组SIRT1蛋白在48 h及72 h表达水平均降低(P均<0.01),与同时间TNF-α诱导的MCR-5细胞组比较,黄芩苷处理48 h及72 h的SIRT1蛋白表达水平均升高(P均<0.05)。另外,正常组的两个时间点差异无统计学意义,而TNF-α诱导组及黄芩苷处理组两个时间点差异明显(P均<0.05)。说明黄芩苷可促进TNF-α诱导的MCR-5细胞SIRT1蛋白的表达,见图3。
2.4 黄芩苷对TNF-α诱导的MCR-5细胞CDK6蛋白表达的影响
与同时间点的正常MCR-5细胞比较,TNFα诱导的MCR-5细胞CDK6蛋白在48 h及72 h表达水平均降低(P均<0.01),与同时间点TNF-α诱导的MCR-5细胞比较,黄芩苷处理48 h、72 h的CDK6蛋白表达水平均升高(P均<0.05)。另外,正常组的48 h和72 h差异无统计学意义,而TNF-α诱导组及黄芩苷处理组48 h和72 h差异均有统计学意义(P均<0.05)。说明黄芩苷可促进TNF-α诱导的MCR-5细胞CDK6蛋白的表达,见图4。
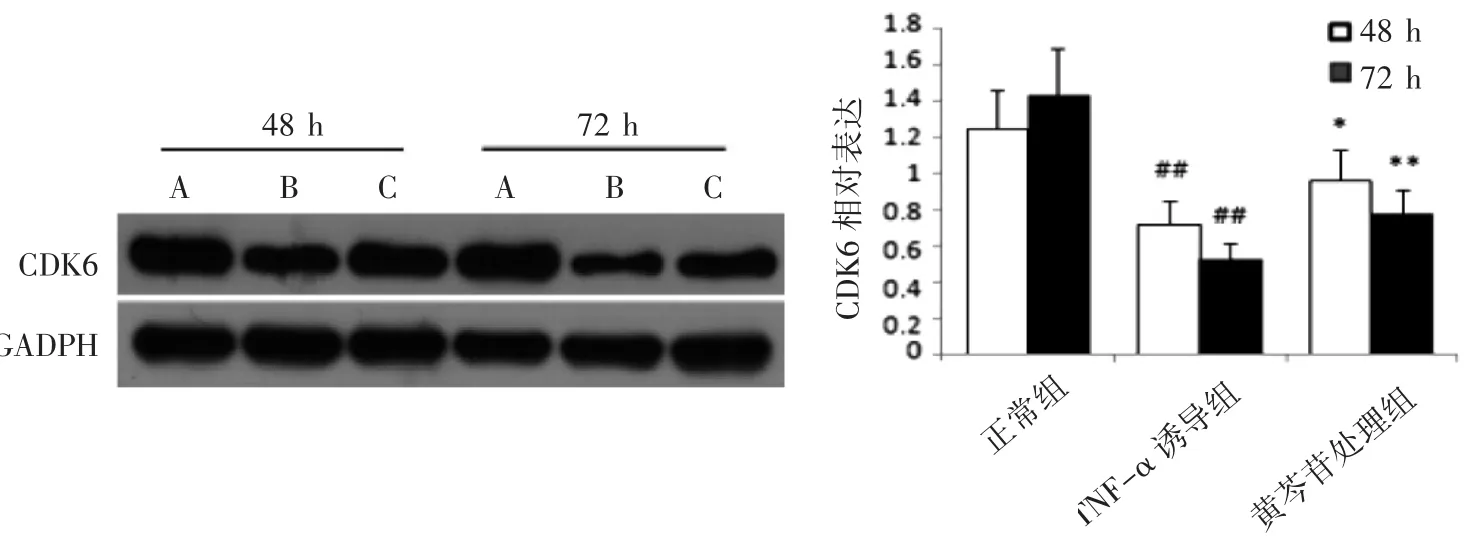
图4 黄芩苷对TNF-α诱导的MCR-5细胞CDK6蛋白表达的影响(±s,n=3)
3 讨论
TNF-α是一种重要的炎症因子,在诱导细胞衰老损伤方面作用显著[8]。过去认为细胞衰老表现为细胞生长抑制和增殖潜能衰竭,细胞的表型、结构和功能等方面发生许多不可逆的改变[9]。近期有研究表明衰老损伤可以被逆转[10]。SIRT1是NAD+依赖的Ⅲ类组蛋白去乙酰化酶[11],其生理功能是除去乙酰基,使DNA链能够紧密缠绕在一起,达到沉默基因的功能[12]。哺乳动物中,SIRT1是与SIR2同源性最高的同系物,俗称长寿基因,SIRT1蛋白主要分布在细胞核中,通过其对组蛋白和非组蛋白的去乙酰化作用调节基因转录和靶蛋白活性,与细胞衰老密切相关[13]。周期蛋白依赖性激酶(CDK),是与细胞周期进程相对应的一套Ser/Thr激酶系统。各CDK和cyclin结合形成异二聚体,其中CDK为催化亚基,cyclin为调节亚基,不同的cyclin/CDK复合物通过CDK活性,催化不同底物磷酸化,从而实现对细胞周期不同时段的推进和转化,其中CDK6与cyclin D1、cyclin D2及cyclin D3结合,促进G1/S转移[14]。
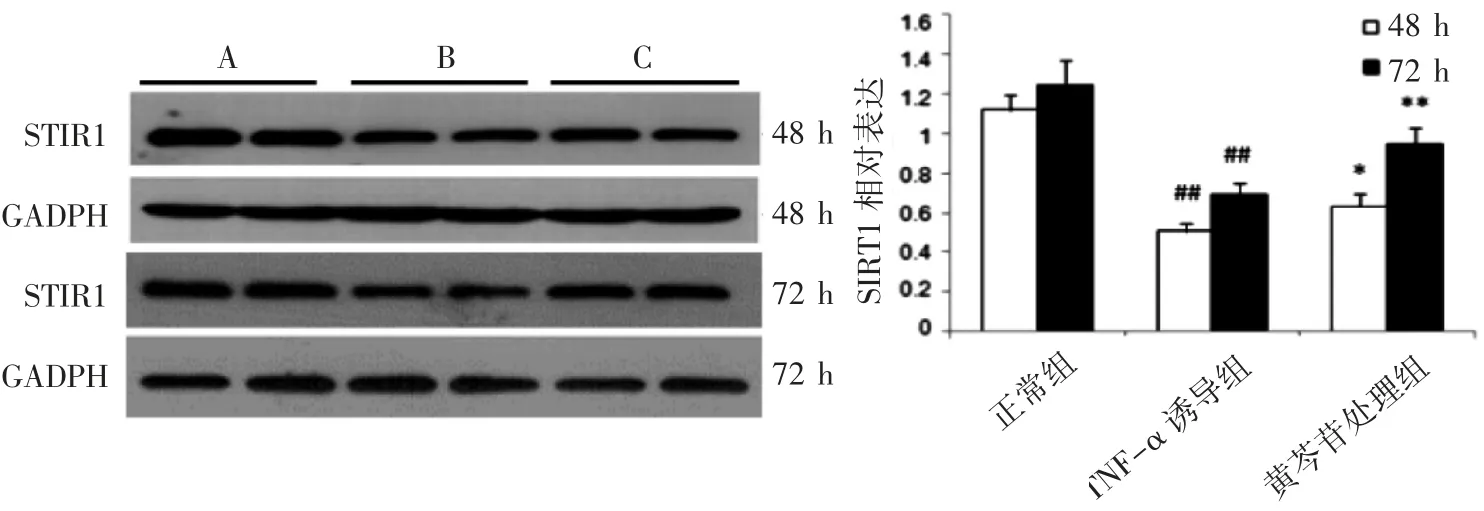
图3黄芩苷对TNF-α诱导的MCR-5细胞SIRT1蛋白表达的影响(±s,n=3)
miRNA是长度为18~25个核苷酸的非编码的小分子RNA。它可与靶基因的3’-UTR区结合,使靶基因翻译受到抑制或引起靶基因降解,从而发挥负向调节作用,在维持机体正常的生理代谢过程中发挥重要的作用[15]。miR-22是新发现的一个衰老相关的miRNA。有研究[16]发现,miR-22在人类衰老的成纤维细胞和上皮细胞中表达上调,SIRT1和CDK6是miR-22的靶基因,miR-22可通过抑制SIRT1和CDK6的表达使pRb去磷酸化,进而引起细胞损伤。
本课题组前期做了大量有关黄芩苷抗病毒、消炎及抗氧化等功效的实验研究,当发现黄芩苷对流感病毒致小鼠肺损伤具有良好的保护作用后,决定在细胞水平对黄芩苷修复损伤进行研究。
结果表明,TNF-α诱导MCR-5细胞损伤率为65.2%,黄芩苷可明显修复MCR-5细胞的损伤,损伤率为52.4%;其可通过下调损伤细胞的miR-22表达、促进SIRT1及CDK6的转录与翻译,从而促进细胞从G1期向S期转移,进而增强损伤细胞的生命活力及延长其生命周期。可见,黄芩苷具有修复损伤细胞的作用,其作用可能与下调miR-22表达、增强SIRT1-CDK6路径的信号转导相关。
本研究从细胞水平对黄芩苷修复损伤进行了初步实验研究,至于黄芩苷对损伤模型动物的影响如何,有待于进一步实验研究确定。

