miR-21拮抗剂、左炔诺孕酮对子宫内膜癌Ishikawa细胞增殖、凋亡的影响
马 钊,田春花,杨梅芳,吴 阳,金 秋,马鸿云
(1.宁夏回族自治区人民医院,西北民族大学第一附属医院,北方民族大学合作办学医院,银川750002;2.宁夏回族自治区银川市妇幼保健院,银川750002)
子宫内膜癌(endometrial cancer,EC)是女性生殖系统恶性肿瘤之一,发病率、病死率居女性恶性肿瘤首位,且呈年轻化趋势,约14%的患者发病时处于育龄期,其中约70%的患者仍有生育意愿[1-4]。以孕激素为基础的保育治疗方案为年轻且有生育要求的EC患者提供了临床选择[5-7]。但约有30%的患者对孕激素治疗产生耐药,这与孕激素激活磷酸肌醇3-激酶/蛋白激酶B(PI3K/AKT)通路产生孕激素抵抗有关[8-9],也为年轻早期EC患者保留生育功能治疗带来困难[10]。研究[11-13]发现,微小RNA(miRNA)参与EC的发生、发展。韩振坤等[14]发现,在EC组织中miR-21呈高表达,且与癌组织的恶性程度呈正相关,这与Lai、王淑芳等[15-16]研究结果一致。因此推测,拮抗miR-21表达可能具有抑癌作用。文章旨在探究miR-21拮抗剂联合左炔诺酮对EC Ishikawa细胞增殖与凋亡的影响,为年轻早期EC患者制订保留生育功能治疗的新方案提供依据。
1 材料与方法
1.1 实验细胞
本实验使用人EC细胞株Ishikawa,细胞株购买自北纳生物公司(BNCC338359)。
1.2 试剂与仪器
完全DMEM培养基(KGM12800S-500,凯基生物);Lipofectamine ? 3000 Transfection Reagent(L3000015,invitrogenTM);miR-21拮抗剂(中洪博元分子实验室提供);左炔诺孕酮(LNG)(S1727,Selleckchem):50 mg HCY干粉中加入1.6 mL DMSO溶解,得100 mmol·L-1母液,-20℃分装保存,根据实验需求剂量进行稀释;CCK-8法细胞增殖检测试剂(KGA317,凯基生物);Anti-PTEN antibody[EPR9941-2](ab170941,Abcam);辣根酶标记二抗[山羊抗兔IgG(H+L)(亲和纯化)(ZB-2301)中杉金桥];DAB显色试剂盒(CW0125,CWBIO康为世纪);中性树脂(CW0136,CWBIO康为世纪);苏木素染色(AR1180-1,博德生物);Annexin V-FITC/PI Apoptosis Kit(AP101-100-kit,MULTI SCIENCES联科生物);结晶紫染色液(G1061,Solarbio);miRNA cDNA Synthesis Kit逆转录试剂盒(CW2141S,CWBIO康为世纪);miRNA qPCR Assay Kit(CW2142S,CWBIO康为世纪);miRNA Purification Kit提取试剂盒(CW0627S,CWBIO康为世纪);Trizon Reagent(CW0580S,CWBIO康为世纪);Ultrapure RNA超纯RNA提取试剂盒(CW0581M,CWBIO康为世纪);HiFiScript cDNA第一链合成试剂盒(CW2569M,CWBIO康为世纪);UltraSYBR Mixture(CW0957M,CWBIO康为世纪);RIPA细胞裂解液(C1053,北京普利莱基因技术有限公司);BCA蛋白定量试剂盒(BCA Protein Assay Kit)(CW0014S,康为世纪);内参一抗:Mouse Monoclonal Anti-GAPDH(TA-08,中杉金桥,1/2 000);二抗:辣根酶标记山羊抗鼠IgG(H+L)(ZB-2305,中杉金桥,1/2 000);目的一抗:Rabbit Polyclonal Anti-AKT(ab8805,Abcam,1/500);目的一抗:Rabbit Polyclonal Anti-P-AKT(bs-2720R,Bioss,1/500);目的一抗:Rabbit Polyclonal Anti-PI3K(bs-0128R,Bioss,1/500);目的一抗:Rabbit Polyclonal Anti-P-PI3K(AF3241,Affinity,1/1 000);二抗:辣根酶标记山羊抗兔IgG(H+L)(ZB-2301,中杉金桥,1/2 000);倒置荧光显微镜(MF53,广州市明美光电有限公司);多功能酶标分析仪(SAFIREII,TECAN瑞士帝肯);离心机(TD4A,长沙英泰仪器有限公司);紫外可见分光光度计(UV-1600PC,上海美谱达仪器有限公司);蛋白垂直电泳仪(DYY-6C,北京市六一仪器厂);超高灵敏度化学发光成像系统[Chemi DocTMXRS+,伯乐生命医学产品(上海)有限公司];EDTA胰蛋白酶消化液(T1300 Solarbio);离心机(型号:TGL-16D,常州中捷实验仪器制造有限公司);Annexin V-FITC(AP101-100-kit,MULTI SCIENCES联科生物);十二烷基苯磺酸钠凝胶(151-21-3,西陇科学股份有限公司)。
1.3 实验方法
1.3.1 细胞培养、分组和转染 采用完全DMEM培养基在湿度饱和37℃、5% CO2常规条件的二氧化碳细胞培养箱中培养Ishikawa细胞。实验分为Ishikawa组(Control组);Ishikawa+LNG处理组(LNG组);Ishikawa+LNG+miR-21拮抗剂处理组(LNG+miR-21组);Ishikawa+LNG+miR-21无关序列处理组(LNG+NC组)。每组设置3个复孔。将对数生长期的Ishikawa细胞以106个/孔接种至6孔细胞板上,待细胞汇合达80%时转染,前一天接种或换液,取出RNA干粉离心3 000 r·min-1,5 min;使用Opti-MEMR培养基稀释LipofectamineR 3000试剂充分混匀,避光室温孵育5 min。在每管已稀释的Lipofectamine R 3000试剂中加入稀释的RNA中混匀,室温避光孵育1 h。按照上述分组,加入RNA-脂质体复合物至细胞中。37℃、5%CO2培养箱孵育细胞,转染48 h后收集各组细胞进行后续实验。
1.3.2 流式细胞仪检测Ishikawa细胞凋亡 弃Ishikawa细胞株上清液,每孔1 mL PBS润洗2遍,加200 μL含螯合剂(EDTA)胰蛋白酶消化液,放入37℃培养箱,当Ishikawa细胞消化后,用含血清的完全培养基终止子宫内膜细胞消化、吹散后收集Ishikawa细胞悬液。将Ishikawa细胞悬液在2 500 r·min-1离心3 min并弃上清液。加1 mL PBS后再2 500 r·min-1,离心3 min后弃Ishikawa细胞上清液,每管加PBS 300 μL混匀后再加5 μL Annexin V-FITC和5 μL碘化丙啶(PI),轻混匀后,待室温避光孵育10 min后上机。
1.3.3 CCK-8检测Ishikawa细胞增殖 将Ishikawa细胞消化、重悬、计数、铺96孔板(细胞密度为5×103个/孔),待EC细胞贴壁后,按照分组进行相应处理,处理24 h向待测板中每孔加入10 μL CCK-8反应2 h,分别采用酶标仪在波长450 nm吸光处检测并计算细胞的存活率。细胞存活率(%)=[A(实验组)-A(空白培养基)]/[A(对照组)-A(空白培养基)]×100%[17]。
1.3.4 Transwell实验检测Ishikawa细胞侵袭力 将Ishikawa细胞消化收集后离心,用无血清培养基重悬细胞并且计数,使每个小室细胞数为3×104个;在小室加入500 μL完全培养基,上室细胞与无血清培养基总体积约300 μL;48 h后进行结晶紫染色。去除各孔中的培养基,然后加入PBS清洗5 min,加配好的0.1%结晶紫染色1 h,染完后擦去小室的内室细胞,之后将小室倒置拍照,拍照完成后去除孔中的染色液,在每个孔中加入配制好的33%乙酸(取33 mL 100%乙酸加到67 mL纯水中,混匀)2 mL溶解细胞中的染液,充分混匀静置后,用分光光度计,以波长为570 nm,用33%乙酸调零,测定每孔中的溶液的吸光值,平行3次。
1.3.5 划痕实验检测Ishikawa细胞迁移力 待Ishikawa细胞铺板密度达到90%以上后进行细胞划痕,使用200 μL枪头在每孔进行划痕,弃去培养基,用磷酸缓冲盐溶液(PBS)清洗3次,换成无血清培养基后给每孔划痕拍照;将细胞放入培养箱中,24 h后再次给每孔的划痕拍照。测量细胞划痕宽度,进而计算出细胞的迁移速率,细胞迁移率=(0 h划痕宽度-培养后划痕宽度)/0 h划痕宽度×100%[18]。
1.3.6 Western blot检测各组PTEN、AKT、p-AKT、PI3K、p-PI3K蛋白表达Ishikawa细胞中加入裂解液,裂解30 min后,4℃下10 000 r·min-1离心10 min,吸取上清,可得总蛋白。根据蛋白浓度测定试剂盒(BCA)测定蛋白浓度。蛋白变性,上样,进行十二烷基苯磺酸钠凝胶电泳1~2 h,后湿法转膜30~50 min。一抗溶液孵育,4℃过夜;二抗溶液室温孵育1~2 h。在膜上滴加超敏化学发光液(ECL)曝光液后,在凝胶成像系统中曝光。用Quantity one软件分析各抗体条带灰度值。
1.4 统计学方法
采用SPSS 20.0软件进行统计分析。所有实验重复3次,计量资料采用均数±标准差(±s)表示。两组比较采用独立样本t检验,多组比较采用单因素方差分析,两两比较采用SNK-q法。检验水准α=0.05。
2 结果
2.1 确定LNG最佳作用浓度和时间
在LNG作用24 h,细胞凋亡率随着浓度增加升高(P<0.05),尤其100 μmol·L-1浓度凋亡率最高。并且细胞在10、50和100 μmol·L-1浓度时存活率均降低(P均<0.05),尤其100 μmol·L-1浓度凋亡率最高、存活率最低。因此以下实验选择LNG的浓度为100 μmol·L-1,作用时间为24 h,见图1。
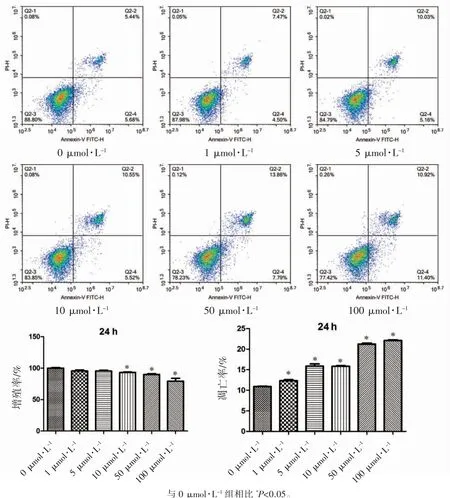
图1 确定LNG最佳作用浓度和时间
2.2 各组细胞凋亡率、侵袭力、迁移力及增殖率比较
与Control组相比,LNG+NC组和LNG+miRNA-21组的凋亡率均升高(P均<0.05);与Control组相比,LNG+miRNA-21组的侵袭和迁移能力均降低(P均<0.05);LNG、LNG+NC组和LNG+miRNA-21组的增殖能力均降低(P均<0.05),见图2。

图2 不同处理方法对子宫内膜癌Ishikawa细胞增殖、凋亡、侵袭和迁移的影响
2.3 PTEN、AKT、p-AKT、PI3K、p-PI3K蛋白在子宫内膜癌Ishikawa细胞中的表达
与Control组相比,LNG组和LNG+miR-21组PTEN、AKT、PI3K蛋白表达升高,p-AKT、p-PI3K蛋白表达均降低(P均<0.05);与Control组相比,LNG+NC组PTEN、AKT、PI3K蛋白表达升高,p-AKT、p-PI3K基因表达降低(P均<0.05),见图3、图4。
图3 聚丙烯酰胺凝胶电泳图
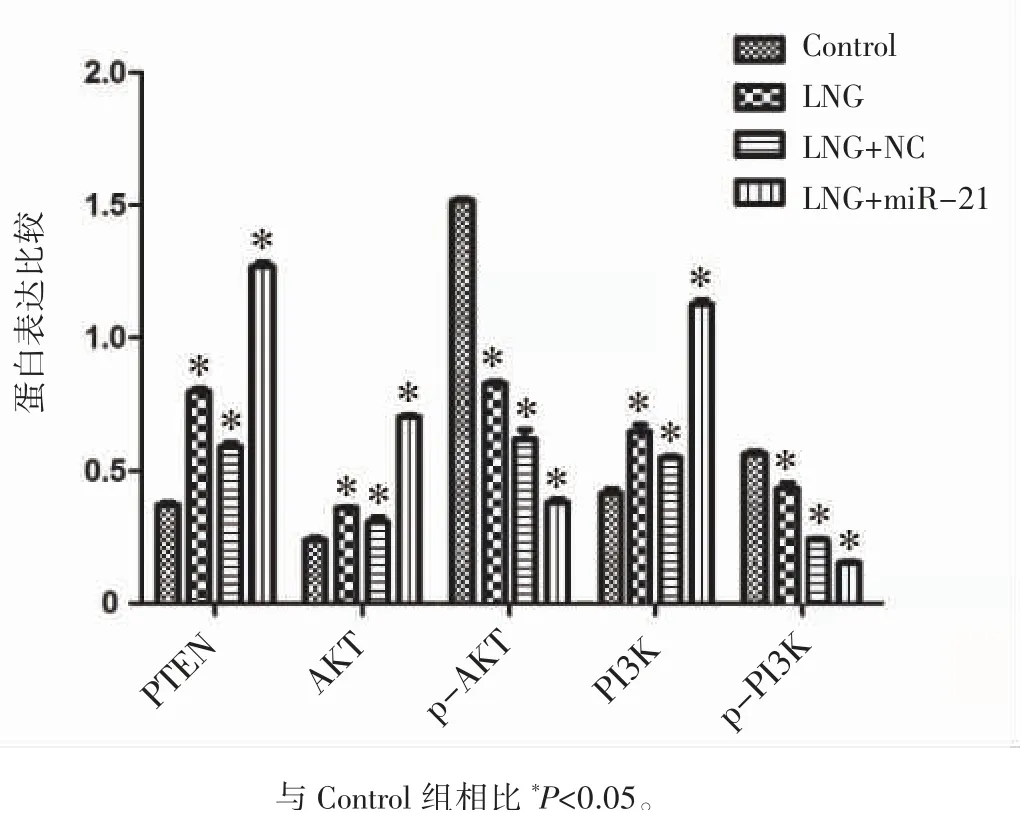
图4 PTEN、AKT、p-AKT、PI3K、p-PI3K蛋白在子宫内膜癌Ishikawa细胞中的表达
3 讨论
单独应用孕激素或联合宫腔镜病灶切除是年轻早期EC患者最常用、最有效的保留生育能力的治疗方案[1,4-5,19]。但是长期使用孕激素治疗可以导致ECPR表达下降,即产生耐药性;有研究发现,在PR阴性表达或低表达EC细胞中,孕激素可激活PI3K/AKT通路产生孕激素抵抗[8],从而使患者对孕激素治疗不敏感,这为年轻患者保留生育功能临床治疗带来巨大困难[10]。针对孕激素抵抗机制的靶向治疗可能逆转孕激素抵抗,应用孕激素联合靶向治疗可能成为有生育要求的EC患者治疗的新手段。
miRNA属于内源性非编码小分子RNA,其可通过5’-种子区与调控一个或多个靶基因miRNA的3’-非翻译区(untranslated region,UTR)碱基互补配对来调控靶基因表达,从而起到类似抑癌或促癌基因的作用[20-21]。有学者发现EC细胞内存在多种miRNA表达异常,这提示miRNA可能参与了EC的发生与发展[11-12]。miR-21是miRNA的一种,在EC患者血清、癌组织中均见miR-21高表达,且其表达的程度与淋巴转移、不良预后密切相关[15],这提示miR-21可能参与了EC的发生、发展。Gao、秦晓燕等[22-23]的研究证实了上述观点。这为临床上子宫内膜癌的基因治疗提供依据。
目前学者公认的PTEN可以抑制EC的发生、发展,多数EC的发生与PTEN功能的缺失有关[24],在最常见的EC亚型中,80%的EC都有PTEN突变[25]。miR-21在EC中过表达,miR-21可以下调PTEN的表达水平,从而促进EC的细胞增殖[26]。
本研究结果显示,与其他组相比,LNG+miR-21组采用100 μmol·L-1LNG联合miR-21拮抗剂处理EC Ishikawa细胞,其增殖率、迁移和侵袭能力最低,而细胞凋亡率最高。这说明LNG联合miR-21拮抗剂可以抑制EC Ishikawa细胞增殖,促进其凋亡;与其他组相比,LNG+miR-21组EC Ishikawa细胞的PTEN、AKT、PI3K蛋白表达最高,而p-AKT、p-PI3K蛋白表达最低,这说明miR-21拮抗剂通过上调PTEN蛋白表达,来抑制PI3K/AKT通路,增强LNG的抗癌作用,从而实现抑制Ishikawa细胞增殖、迁移及侵袭作用,最终促进Ishikawa细胞凋亡。
综上所述,miR-21拮抗剂联合左炔诺孕酮可以促进子宫内膜癌Ishikawa细胞的凋亡,抑制子宫内膜癌Ishikawa细胞的增殖,这为年轻早期EC患者的临床治疗提供了新的思路。

