平滑肌电刺激对重度盆腔子宫内膜异位症术后肠功能恢复的疗效
王静璇,卢 丹,段爱红,张宇迪,刘 冰,孙如意,吴 静,冯 怡,赵 馨
盆腔子宫内膜异位症是一种常见的妇科疾病,育龄期女性发病率为10%~15%[1]。重度盆腔子宫内膜异位症以炎性反应、粘连、局部脏器解剖结构变异及血管生成为主要特征[2],易成形盆腔重度粘连而累及肠管,术中常需行肠黏连松解,从而增加肠道损伤的风险而影响患者预后[3]。在妇科手术加速康复(enhanced recovery after surgery,ERAS)路径中,肠道功能的恢复往往是妇科腹部手术后康复的最后一步[4]。体表仿生物电刺激可通过刺激局部横纹肌或平滑肌促进胃肠蠕动,因其安全性、有效性及无创性已广泛应用于术后胃肠动力障碍性疾病。本研究回顾性分析2019-01至2020-12于首都医科大学附属北京妇产医院妇科因卵巢子宫内膜异位囊肿为主要手术指征行手术治疗的患者共150例,重度盆腔子宫内膜异位症手术后,分别采用平滑肌及横纹肌电刺激模式促进肠道功能恢复的效果。
1 资料与方法
1.1 临床资料 150例患者根据1985年美国生殖医学学会(American Society for Reproductive Medicine,ASRM)的修正分期法(r-AFS)分期为Ⅳ期(重度)者。纳入标准:(1)术前均评估有肠粘连可能并进行常规肠道准备;(2)术中无肠管及其他脏器修补;(3)麻醉、术后疼痛管理、术后液体治疗、饮食及活动均按照ERAS方案进行;(4)治疗过程中除麻醉及镇痛药物外未使用其他影响胃肠动力药物;(5)患者和家属均知情同意,并签署知情同意书。排除标准:(1)存在电刺激禁忌证者;(2)有严重消化道疾病及其他内外科合并症者;(3)治疗过程中存在电解质紊乱需治疗者;(4)围术期伴凝血功能障碍者;(5)手术创面出血风险高、腹壁切口出血及血肿者;(6)合并精神疾患或痴呆等影响语言表达者。本研究经首都医科大学附属北京妇产医院伦理委员会批准(2016-KY-044-01)。
根据术后电刺激的不同模式分为两组各75例。采用平滑肌模式者为观察组,横纹肌模式者为对照组,两组间患者年龄、体重指数(BMI)、手术入路、手术时长、r-AFS评分及术后镇痛泵使用比例差异均无统计学意义,具有可比性(表1)。
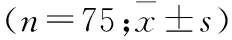
表1 两组重度盆腔子宫内膜异位症患者一般资料比较
1.2 方法 选用PHENIX 8 PLUS神经肌肉刺激治疗仪,两组患者分别于术后24 h开始电刺激治疗,电极片按照结肠走行贴放于腰腹部皮肤,治疗20 min/次,2次/d。观察组使用平滑肌电刺激模式,频率2 Hz,脉宽3 ms;对照组使用横纹肌电刺激模式,频率85 Hz,脉宽250 μs。两组患者均持续治疗至患者耐受普食并无不适症状为止。
1.3 观察指标 (1)记录手术中有无肠粘连、肠粘连的程度及部位,有无肠壁损伤及修补、肠粘连分离方式,有无新生血管形成。(2)术后肠道功能恢复指标:①于术后每日早中晚分别听诊肠鸣音,计算平均值,直至出现规律肠鸣音,了解规律肠鸣音出现的时间;②记录患者首次排气、排便以及进食普食后不适症状完全消失的时间;③记录患者术后有无腹胀以及腹胀出现、持续、消失的时间。肠粘连分级:肠粘连分级根据文献[5]中的分级标准进行:0级,无粘连;1 级,轻度粘连,可以钝性分离完成松解;2级,中度粘连,通常需要部分锐性分离,粘连中有新生血管形成;3级,重度粘连,只能以锐性分离完成松解,明确的有新生血管形成;4级,极重度粘连,仅能以锐性分离松解,粘连器官损伤往往难以避免。
2 结 果
2.1 肠粘连情况及两组间比较 150例中,肠粘连者145例,发生率为96.67%。其中轻度14例,中度43例,重度88例。观察组73例,对照组72例。最多出现的粘连部位为直肠,共121例(83.45%);其次为乙状结肠94例(64.80%);阑尾粘连5例(3.45%);小肠粘连4例(2.76%)。两组间肠粘连比例、程度及部位差异无统计学意义(表2)。

表2 两组重度盆腔子宫内膜异位症患者肠粘连情况比较 (n;%)
2.2 术后肠道功能恢复情况比较 两组均无术后肠梗阻、电刺激不良反应及腹壁切口及术后腹腔内出血等发生。观察组术后出现规律肠鸣音的时间、首次排气时间及首次耐受普食无不适的时间均早于对照组,差异有统计学意义(P<0.05);观察组首次排便时间、腹胀发生率(71.2%)与对照组(79.2%)比较,差异无统计学意义。观察组腹胀持续时间短于对照组,差异有统计学意义(P<0.05,表3)。
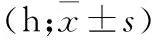
表3 两组重度盆腔子宫内膜异位症患者肠道功能恢复情况的比较
3 讨 论
盆腔子宫内膜异位症术后往往易发生肠粘连[6]。据报道,盆腔子宫内膜异位症最常见的肠粘连部位为直肠[7]。本研究重度盆腔子宫内膜异位症合并肠粘连比例为96.67%,粘连部位包括直肠、乙状结肠、阑尾及小肠。其中,直肠(83.45%)及乙状结肠(64.80%)发生比例较高。肠粘连松解术作为盆腔子宫内膜异位症手术中的重点及难点,既是手术中肠道损伤的重要原因[8],也是妇科良性手术后肠梗阻的危险因素[9]。肠道功能恢复是妇科手术ERAS的重要内容[10]。重度盆腔子宫内膜异位症大部分存在可预见性盆腔粘连、肠粘连甚至可能涉及肠道的深部浸润型病灶[11]而无法按照ERAS常规路径进行术前准备。因此,如何促进重度盆腔子宫内膜异位症术后肠道功能的恢复,对于加快术后康复至关重要。肠道动力依赖于包括肠神经元、平滑肌细胞和Cajal 间质细胞这三类细胞的功能整合。平滑肌细胞的正常工作依赖于生物电主导的离子通道的控制,从而管理细胞的兴奋性、控制胃肠道的运动模式[12]。消化道平滑肌可在外部电流的刺激下,恢复正常的电节律及运动[13],使经皮电刺激技术应用于肠道功能恢复成为理想的选择之一。
经皮电刺激目前作为一种重要的物理康复治疗手段已被广泛应用于临床,其原理为利用中低频脉冲电流刺激横纹肌或平滑肌恢复其运动及功能。肌肉电刺激分为横纹肌模式及平滑肌模式,利用横纹肌及平滑肌各自不同的电信号达到促进肌肉运动的目的。横纹肌模式的刺激目标为骨骼肌,多用于慢性便秘[14-17]的康复治疗。其中经皮电刺激可通过低频电流刺激一组或多组腹部横纹肌,诱发肌肉运动或模拟正常的自主运动,调节肌肉活动节律,从而加强肌肉的功能活动。已有国内学者将其应用于妇科手术后肠道功能恢复,证实其对于促进肠蠕动、改善腹胀等有满意疗效[18,19]。脉管平滑肌电刺激是近年来引进国内的电刺激技术,通过刺激内脏、血管及淋巴管平滑肌,使其进行规律的收缩,并增加自身的搏动频率,从而促进肌肉运动、改善组织血运及营养状态。目前在妇产科领域的应用报道主要包括产后盆底功能障碍性疾病[20]、产后腹直肌分离[21]、产后相关疼痛[22,23]、女性慢性盆腔痛[24]、外阴营养不良性疾病[25]、宫腔粘连[26]及妇科术后尿潴留[27]的物理治疗等。
肠壁肌肉为平滑肌,脉管平滑肌电刺激可以直接作用于肠壁平滑肌,增加肌肉运动的节律性;同时,刺激血管及淋巴管平滑肌促进其蠕动,促进血液及淋巴循环,有利于组织间液的重吸收而减轻组织水肿。因此,脉管平滑肌电刺激应用于手术后的肠道功能恢复理论上较横纹肌模式具备先天性优势。我科在前期研究中将横纹肌电刺激应用于妇科肠粘连松解术后的患者,提示其在促进术后肠道功能恢复的作用较传统口服促排气药物有显著优势[28]。本研究在此基础上,选择重度子宫内膜异位症这一较常合并肠粘连的疾病,比较横纹肌模式与平滑肌模式在促进术后肠功能恢复的作用差异。结果显示,观察组患者术后出现规律肠鸣音的时间、首次排气时间及耐受普食的时间均早于对照组,腹胀患者症状持续时间短于对照组。提示平滑肌电刺激对于重度盆腔子宫内膜异位症患者术后肠道功能恢复具有促进作用,治疗效果优于横纹肌电刺激模式。由于目前对于脉管平滑肌电刺激用于手术后肠道功能恢复尚缺乏成熟的经验,考虑到脉管平滑肌同时对肠壁及血管壁的刺激作用,本研究选择无肠壁损伤且无内出血风险的患者,电刺激时机在术后24 h后,观察未出现腹腔内及腹壁切口出血相关不良反应。后期可扩大样本量,优化治疗方案。另外,本研究的主要不足在于回顾性研究存在一定的研究对象选择偏倚,有待前瞻性随机对照研究进一步验证。
综上所述,平滑肌电刺激较横纹肌模式在促进重度盆腔子宫内膜异位症术后肠道功能恢复中更具优势,是值得尝试的物理治疗方法。

