核因子E2相关因子2/血红素加氧酶1信号通路介导的氧化应激反应对早期小鼠视网膜爆震伤的影响及其作用机制
杨露露 柳云恩 陈颖欣
在军事行动中,眼外伤是仅次于截肢、创伤性脑损伤和创伤后应激障碍的第四位常见的损伤[1]。爆炸物导致的眼外伤也较为常见,这不仅危害公共健康,更会增加社会的经济成本[2]。研究发现,眼爆震伤的致盲及眼球摘除率均高于其他眼外伤[3-4]。由于爆震主要损伤眼后节,因此眼爆震伤的研究多集中于视网膜和视神经。核因子E2相关因子2(Nrf2)/血红素加氧酶1(HO-1)信号通路是常见的信号转导途径,已被证实与糖尿病视网膜病变、老年性黄斑变性等视网膜氧化应激性损伤的病理生理改变有关[5-7],但其在早期小鼠视网膜爆震伤中的作用尚未完全清楚。本研究探讨Nrf2/HO-1信号通路介导的氧化应激反应对早期小鼠视网膜爆震伤的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物和分组取雄性C57BL/6小鼠60只(辽宁长生生物技术有限公司),6~8周龄,体重20~22 g,适应性饲养1周。将小鼠随机分为对照组和模型组,对照组小鼠常规饲养,模型组小鼠接受爆震冲击处理。去除建模过程中5只死亡小鼠,最终纳入对照组16只小鼠、6 h模型组19只小鼠、48 h模型组20只小鼠。
1.1.2 主要试剂和仪器蛋白提取试剂盒、BCA蛋白定量试剂盒(南京诺唯赞生物科技公司),ECL显色试剂盒、酶标仪(美国BIO-RAD公司),Nrf2、HO-1、超氧化物歧化酶(SOD) 2、诱导型一氧化氮合酶(iNOS)、白细胞介素(IL)-10抗体(英国Abcam公司),黑色素瘤分化相关基因5(MDA5)抗体(美国CST公司),免疫组织化学染色试剂盒、柠檬酸组织抗原修复液(福州迈新生物技术开发有限公司),DP80光学显微镜及摄像装置(日本Olympus公司),TP1020脱水机(德国Leica公司),TD4A离心机(长沙英泰仪器公司),ZH-3石蜡切片用冷台(沈阳纵横高技术公司)。
1.2 方法
1.2.1 小鼠视网膜爆震伤模型的制备参考文献[8-9]中所述的方法建立小鼠视网膜爆震伤模型。爆震装置由空气压缩、固定、保护装置及压力表组成,中间层螺丝固定8层厚约0.8 mm的铝膜。按照1.5 mL·kg-1体重标准腹腔注射200 g·L-1戊巴比妥钠麻醉小鼠,麻醉后将其仰卧位放置于铝膜上方保护罩内,暴露头部,套网固定。利用压缩装置压缩空气,增加气压,空气压缩至临界点时冲破铝膜,产生的冲击波使小鼠视网膜发生爆震伤。冲击波产生的压力0.10~0.14 MPa。分别于建模后6 h、48 h腹腔注射200 g·L-1戊巴比妥钠过量麻醉处死小鼠,解剖取材。
1.2.2 HE染色、视网膜神经节细胞计数和视网膜神经纤维层厚度测量摘除完整眼球后将其放入改良FAA固定液浸泡30~60 min,待眼球表面完全变硬,于角巩膜缘对称位置开孔并再次浸泡24 h[10]。常规脱水包蜡,经矢状轴切片,厚约4 μm,贴敷于载玻片上,经二甲苯、梯度乙醇脱蜡水化,行HE染色。封片后在显微镜下观察小鼠视网膜组织病理学改变情况,进行视网膜神经节细胞(RGC)计数及视网膜神经纤维层(RNFL)厚度测量。RGC计数:每组小鼠选取不同标本切片3张,每张切片随机选取6个视野,计数每200 μm内RGC数,取其平均数。RNFL厚度测量:每组小鼠选取不同标本切片3张,用ImageJ软件测量距锯齿缘1000 μm处小鼠RNFL厚度,两侧各测量3次,取其平均数。
1.2.3 免疫组织化学染色眼球包埋切片方法同上。将组织切片脱蜡水化后,灭活内源性过氧化物酶,用柠檬酸于100 ℃高压锅中行抗原修复100 s,分别加入Nrf2(1200)、HO-1(1500)、SOD2(1200) 抗体,4 ℃孵育过夜。次日行血清封闭并加入相应二抗,DAB 显色,苏木素复染、水化、封片后显微镜观察。每张切片随机选取6个高倍视野(×400),用ImageJ软件计算相应阳性细胞表达率。
1.2.4 Western blot检测不同因子的蛋白表达摘除小鼠眼球后在显微镜下沿角巩膜缘剪除角膜,取出小鼠晶状体及玻璃体,将整个视杯翻转剥取视网膜,剪碎后加入裂解液,提取总蛋白,BCA法检测蛋白浓度。配平蛋白样品并加入缓冲液,水浴煮沸致蛋白变性,经SDS-PAGE凝胶电泳、转膜并封闭,PBST洗膜3次后加入一抗Nrf2、HO-1、SOD2、iNOS、MDA5及GAPDH(11000),4 ℃孵育过夜。次日加入相应二抗(12000),室温孵育1 h,ECL显影并拍照。ImageJ软件分析条带图像,计算所检测蛋白的相对表达量。
1.3 统计学方法采用统计学软件SPSS 25.0分析数据。计量资料以均数±标准差表示,各组数据均经Levene法检验证实方差齐性,再采用独立样本t检验进行两组间比较。检验水准:α=0.05。
2 结果
2.1 各组小鼠视网膜组织HE染色结果、RGC计数及RNFL厚度对照组小鼠视网膜组织结构完整、层次分明,细胞排列紧密均匀,RGC胞体呈圆形且体积较大、胞核边界清晰。与对照组相比,6 h模型组小鼠视网膜组织结构疏松,细胞排列紊乱,RGC层、内核层及外核层出现核浓缩和空泡现象;RGC数减少(t=3.32,P<0.05),RNFL厚度增加(t=4.59,P<0.05);48 h模型组小鼠视网膜组织细胞排列更为杂乱疏松,RGC数明显减少(t=3.91,P<0.05),RNFL进一步增厚(t=4.12,P<0.05),并伴有新生血管生成(表1和图1)。

表1 各组小鼠视网膜组织RGC计数和RNFL厚度
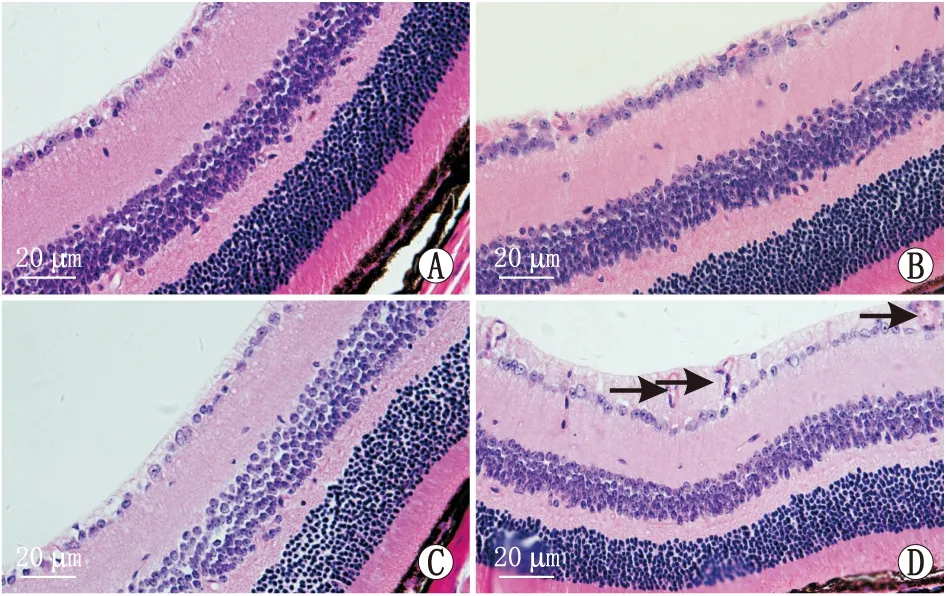
图1 各组小鼠视网膜组织HE染色结果 A:对照组;B:6 h模型组;C:48 h模型组;D:模型组小鼠视网膜组织新生血管(箭头所示)生成。
2.2 各组小鼠视网膜组织Nrf2蛋白、HO-1蛋白、SOD2蛋白表达情况免疫组织化学染色结果显示,各组小鼠视网膜组织Nrf2蛋白表达阳性细胞主要集中于RGC层、内核层、外核层(图2)。与对照组[(7.85±1.16)%]相比,6 h模型组小鼠视网膜组织Nrf2蛋白阳性细胞表达率升高至(16.78±1.38)%;48 h模型组以上指标进一步升高至(20.01±1.48)%,差异均有统计学意义(t=19.18、24.96,均为P<0.05)。

图2 各组小鼠视网膜组织Nrf2蛋白表达免疫组织化学染色结果 A:对照组;B:6 h模型组;C:48 h模型组;箭头所示为Nrf2蛋白表达阳性细胞。
各组小鼠视网膜组织HO-1蛋白、SOD2蛋白表达阳性细胞主要集中于RGC层、内核层(图3和图4)。与对照组[(4.67±0.98)%、(4.15±1.11)%]相比,6 h模型组小鼠视网膜组织HO-1蛋白、SOD2蛋白阳性细胞表达率分别升高至(7.95±1.27)%和(6.14±0.90)%;48 h模型组以上指标继续升高,分别为(12.34±1.48)%、(10.25±1.46)%,差异均有统计学意义(均为P<0.05)。此外,与对照组相比,6 h模型组、48 h模型组小鼠视网膜组织HO-1蛋白、SOD2蛋白表达阳性细胞着色更深,并从视网膜内层逐渐向外扩散。
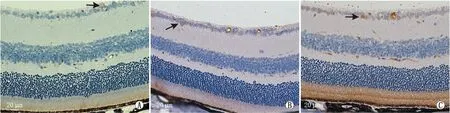
图3 各组小鼠视网膜组织HO-1蛋白表达免疫组织化学染色结果 A:对照组;B:6 h模型组;C:48 h模型组;箭头所示为HO-1蛋白表达阳性细胞。
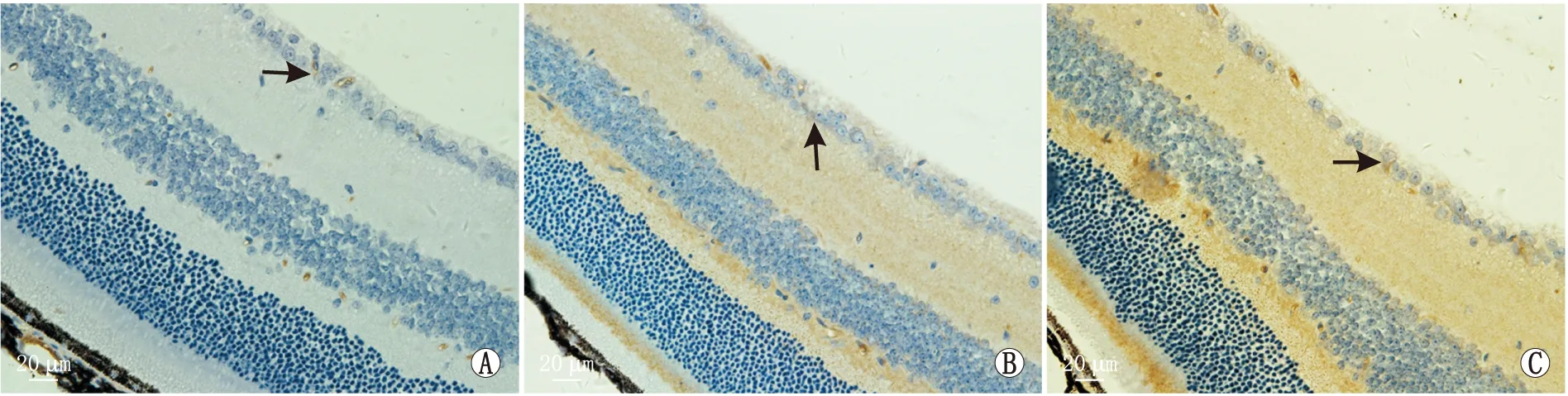
图4 各组小鼠视网膜组织SOD2蛋白表达免疫组织化学染色结果 A:对照组;B:6 h模型组;C:48 h模型组;箭头所示为SOD2蛋白表达阳性细胞。
2.3 各组小鼠视网膜组织Western blot检测结果与对照组相比,6 h模型组小鼠视网膜组织Nrf2蛋白、HO-1蛋白、SOD2蛋白、iNOS蛋白、MDA5蛋白相对表达量均升高,差异均有统计学意义(均为P<0.05);48 h模型组以上指标进一步升高,差异亦均有统计学意义(均为P<0.05)(表2和图5)。
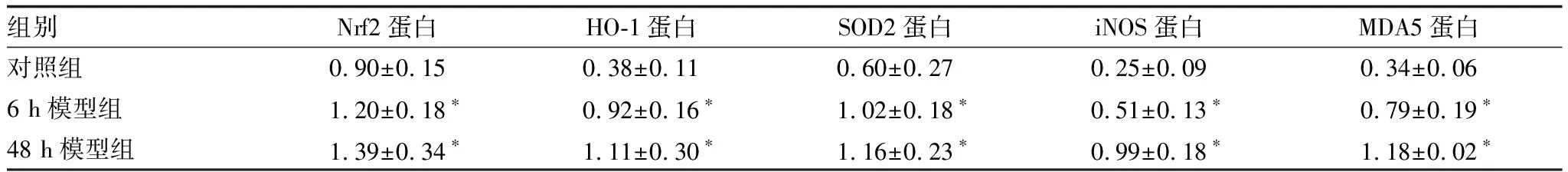
表2 各组小鼠视网膜组织Nrf2蛋白、HO-1蛋白、SOD2蛋白、iNOS蛋白、MDA5蛋白相对表达量

图5 Western blot检测各组小鼠视网膜组织不同因子的蛋白表达
3 讨论
视网膜是视觉传导通路的重要一站,易遭受爆震冲击导致视力障碍。据调查,超80%的眼爆震伤患者合并创伤性脑损伤[11]。视网膜和中枢神经系统在组织结构上的密切联系表明探讨视网膜爆震伤机制的必要性。目前,国内外对视网膜爆震伤的研究以模拟冲击波的动物实验为主[12],多围绕病理学改变展开研究,针对分子生物学的研究鲜有报道。视网膜爆震伤的致病机制尚未完全明确,免疫系统激活、活性氧增多、线粒体功能障碍、谷氨酸兴奋性毒性增加等均可导致损伤发生[13]。本研究利用空气压缩装置模拟爆炸实况建立视网膜爆震伤动物模型,观察发现爆震伤后小鼠视网膜组织疏松、细胞排列紊乱、RGC数减少、RNFL增厚,这与既往研究[14-15]结果一致。但我们并未发现先前研究[16]所述的爆震伤后视网膜内层、全层厚度增加及视网膜下出血,这些差异可能是由于爆炸压力、观察时间以及爆炸暴露部位、体位的不同所致。
Nrf2是一种氧化还原活性因子,属于CNC-bZIP家族,由6个功能结构域组成。生理条件下,Nrf2的Neh2结构域与其负调控因子Keap1结合于细胞质,促进Nrf2的泛素化和降解以维持活性氧浓度的动态平衡;应激时,活性氧促使Nrf2与Keap1解离并转移至细胞核内,与抗氧化反应元件结合[17],通过调节相关靶基因活性清除活性氧。其中,HO-1作为Nrf2调控的下游II相解毒酶,已被发现参与多种组织器官的内源性反应[18-20],包括抗炎抗氧化、减少线粒体损伤、调节Ca2+内流及细胞凋亡等,是目前氧化应激损伤的研究热点[21]。
研究发现,损伤的心肌细胞可通过Nrf2/HO-1轴过表达产生内源性一氧化碳,刺激SOD2表达上调,同时促进生物合成及抗氧化基因表达以抵抗线粒体损伤和细胞凋亡[22-23]。甲烷可降低氧化应激标志物8-羟化脱氧鸟苷、4-羟壬烯醛、MDA5水平,增加SOD、过氧化氢酶、谷胱甘肽过氧化物酶活性,减小视网膜缺血-再灌注损伤后发生RGC凋亡、视网膜变薄的可能性[24]。敲除Nrf2基因可加重视网膜缺血-再灌注后RGC的损伤,最终导致视觉障碍[25-26]。另外,视网膜缺血-再灌注损伤后视网膜组织Nrf2蛋白和HO-1蛋白表达明显升高,在7 d后回落,表明损伤后Nrf2/HO-1信号通路的适应性激活是暂时的[27]。鉴于以上研究结果,我们推测Nrf2/HO-1信号通路的激活可能在早期视网膜损伤中起重要作用。本研究结果表明,爆震伤后48 h内视网膜损伤不断加重,相关Nrf2/HO-1信号通路蛋白表达持续升高,诱发视网膜内源性氧化应激反应,且随着时间推移,损伤从视网膜内层向外蔓延,这与相关研究结果一致[28-29]。
综上所述,Nrf2/HO-1信号通路介导的氧化应激反应参与早期视网膜爆震伤的发生,其作用机制与上调SOD2蛋白、MDA5蛋白、iNOS蛋白表达有关。据此推测,干预Nrf2/HO-1信号通路可能预防或治疗视网膜爆震伤。

