PTEN/SOCS3缺失对视神经损伤大鼠视网膜神经节细胞存活和轴突再生的影响△
楚 妙 熊朝晖 赵丽娜 李康宁 巨朝娟
临床上视神经损伤又称外伤性视神经病变,是颅脑损伤常见的并发症,占颅脑外伤的2%~5%[1]。视神经损伤分为直接损伤和间接损伤[2],直接损伤是指锐器刺伤视神经引起的损伤,但在临床上比较少见。目前约90%视神经损伤为间接损伤,如打击伤、坠落伤、车祸伤等,损伤特点是没有出现眼球或者视神经损伤,但会伴有严重的视力降低。视神经损伤的病理基础是视网膜神经节细胞(RGCs)进行性死亡和神经纤维的丢失[3]。损伤后RGCs生长程序再激活能力较弱,RGCs中促进轴突再生的相关基因及营养因子的表达不足[4]。虽然许多转录因子、信号通路与视神经损伤后RGCs生长程序再激活和轴突再生有关,但是关于它们的作用机制目前尚不完全清楚。磷酸酶-张力蛋白同源物(PTEN)和细胞因子信号转导抑制蛋白3(SOCS3)是重要的信号转导通路的调控因子,除了具有调节细胞增殖和存活能力外,还具有调节细胞迁移、基因组稳定性等作用[5]。本研究通过建立视神经损伤模型,探讨PTEN/SOCS3缺失对改善视神经损伤大鼠RGCs存活的作用机制,为深入阐述视神经损伤的发病机制和治疗提供新思路。
1 材料与方法
1.1 实验动物PTENflox/flox大鼠、SOCS3flox/flox大鼠、神经元特异性表达黄色荧光转基因(Thy-1 YFP)大鼠均从美国Jackson 实验室引进。Thy1-YFP/PTENF/F、Thy1-YFP/SOCS3F/F和Thy1-YFP/PTENF/FSOCS3F/F大鼠各20只分别由Thy-1 YFP与PTENflox/flox大鼠、SOCS3flox/flox大鼠交配获得,需要基因鉴定后才能使用。所有大鼠饲养环境温度保持在21 ℃,光照和黑暗交替各12 h,所有大鼠自由饮食。
1.2 方法
1.2.1 敲减大鼠PTEN和SOCS3基因大鼠玻璃体内注射腺相关病毒(AAV)介导PTEN或SOCS3基因缺失,大鼠通过腹腔注射氯胺酮麻醉,使用微量移液管向大鼠一眼玻璃体内注射的AAV 1 μL,注射后涂抗生素软膏,注射AAV后24~48 h对动物进行密切监测,了解动物的正常反应以及饮水、进食行为。
1.2.2 动物分组Thy1-YFP/PTENF/FSOCS3F/F大鼠为对照组;玻璃体内注射AAV介导PTEN基因缺失的Thy1-YFP/PTENF/F大鼠为PTEN-/-组;玻璃体内注射AAV介导SOCS3基因缺失的Thy1-YFP/SOCS3F/F大鼠为SOCS3-/-组;玻璃体内注射AAV介导PTEN和SOCS3基因缺失的Thy1-YFP/PTENF/FSOCS3F/F大鼠为PTEN-/-SOCS3-/-组;每组各20只大鼠。
1.2.3 大鼠视神经夹伤模型制备大鼠视神经夹伤模型制备参照文献[6],用10 g·L-1戊巴比妥钠腹腔注射麻醉大鼠,置于40倍视野的显微镜下手术,剪开左眼眶皮肤,分离眶内脂肪,碰触眶内静脉窦,向着眼球的方向分离,暴露视神经,同时要控制小血管出血;采用5号钟表镊划开视神经鞘膜背侧,距离神经根部1 mm夹闭5 s,术后涂抗生素软膏。
1.2.4 各组大鼠视网膜HE染色各组大鼠造模后48 h腹腔注射水合氯醛麻醉处死,显微镜下取出大鼠部分视网膜组织固定于40 g·L-1多聚甲醛中,PBS溶液清洗;积分数70%乙醇蒸馏1 h,用体积分数60%~90%乙醇梯度脱水;体积分数2.5%、 3.0%二甲苯溶液梯度脱水,静置30 min;将石蜡组织包埋,切成3 μm的厚度,二甲苯中脱蜡;乙醇脱水,苏木精染色液染色30 min,PBS清洗,伊红溶液染色,组织切片进行透明清洗操作,中性树胶封片,光学显微镜观察记录和拍照。
1.2.5 各组大鼠RGCs分离参照文献[7]分离大鼠RGCs,各组大鼠造模后48 h腹腔注射水合氯醛麻醉处死,取出大鼠部分视网膜,溶解于0.2 g·L-1左旋/右旋半胱氨酸、15 U·mL-1木瓜蛋白酶和0.04 g·L-1脱氧核糖混合液中,离心处理,加入兔抗巨噬细胞抗体(175)和IgG 抗体(1400)孵育30 min,然后将贴壁的RGCs采用胰蛋白酶消化、离心后,将RGCs接种于已包被多聚赖氨酸和层粘连蛋白的96孔板中,置于37 ℃、体积分数5% CO2培养箱中培养,3 d换液 1次,流式细胞术检测活化星形胶质细胞、小胶质细胞和RGCs,并计算RGCs纯度。
1.2.6 免疫荧光染色鉴定各组大鼠RGCs存活情况将各组大鼠RGCs用40 g·L-1多聚甲醛固定20 min,室温下将细胞用体积分数0.3%Triton X-100透化,添加免疫荧光封闭液室温孵育 60 min,加入一抗8-羟基脱氧鸟苷(1500),4 ℃孵育过夜,PBS 清洗;将细胞与Alexa Fluor 488标记山羊抗兔IgG(H+L)二抗(1500)孵育1 h,DAPI染色10 min,PBS漂洗;利用Image-Proplus软件对荧光图像进行分析,计算RGCs存活率。
1.2.7 流式细胞仪检测各组大鼠RGCs凋亡情况采用胰蛋白酶消化各组RGCs,调整细胞密度为300×103个·mL-1,采用400 μL Annexin V结合液悬浮细胞,添加5 μL Annexin V-FITC着色液并混匀,静置15 min,加入10 μL PI着色液,上流式细胞仪检测,并计算RGCs凋亡率。
1.2.8 各组大鼠视神经损伤后轴突再生数量观察各组大鼠造模后30 d腹腔注射麻醉,左眼注射1 μL霍乱毒素B型亚单位进行顺行示踪标记,48 h后给予麻醉并灌注40 g·L-1多聚甲醛,摘取视神经样品,40 g·L-1多聚甲醛固定4 h,分别在50 g·L-1、150 g·L-1和300 g·L-1蔗糖溶液中进行梯度脱水,然后用包埋剂进行包埋,冰冻切成约8 μm厚的切片,选择5个视神经切片,距离视神经挤压部位不同距离处估算逆行示踪剂霍乱毒素B型亚单位标记轴突的数量。
1.2.9 Western blot检测各组大鼠RGCs中GFAP和GAP-43蛋白的表达采用RIPA细胞裂解液提取各组大鼠RGCs的总蛋白,BCA法测定蛋白浓度,聚丙烯酰胺凝胶电泳分离蛋白,然后转移到PVDF膜,将膜浸入50 g·L-1脱脂奶粉的封闭液中,封闭2 h。分别加入GFAP (以1500稀释)和GAP-43 (以11000稀释)一抗,置于4 ℃的恒温环境,过夜处理;添加HRP标记的山羊抗兔IgG (以15000稀释),置于28 ℃孵育1 h,将PVDF膜放入电化学发光显色液内显色处理,使用Image-Pro Plus 6.0分析蛋白质灰度值。
2 结果
2.1 各组大鼠视网膜组织病理学观察HE染色分析结果显示,对照组大鼠视网膜细胞炎症反应明显,细胞之间层次结构混乱、连接差、分散性强;PTEN-/-组和SOCS3-/-组大鼠视网膜整体结构较规则,层次较清晰,炎症反应有所减轻;PTEN-/-SOCS3-/-组大鼠视网膜结构清晰,较规则,细胞之间连接紧密,炎症反应明显减轻(图1)。
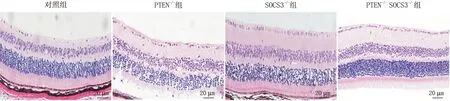
图1 各组大鼠视网膜组织HE染色结果(×200)
2.2 各组大鼠RGCs存活情况分析对照组、PTEN-/-组、SOCS3-/-组和PTEN-/-SOCS3-/-组大鼠RGCs存活率分别为(47.29±5.16)%、(76.54±11.95)%、(73.27±12.53)%和(99.64±1.07)%,PTEN-/-组和SOCS3-/-组大鼠RGCs存活率均显著高于对照组(均为P<0.001),PTEN-/-SOCS3-/-组大鼠RGCs存活率均明显高于PTEN-/-组和SOCS3-/-组(均为P<0.001)(图2)。
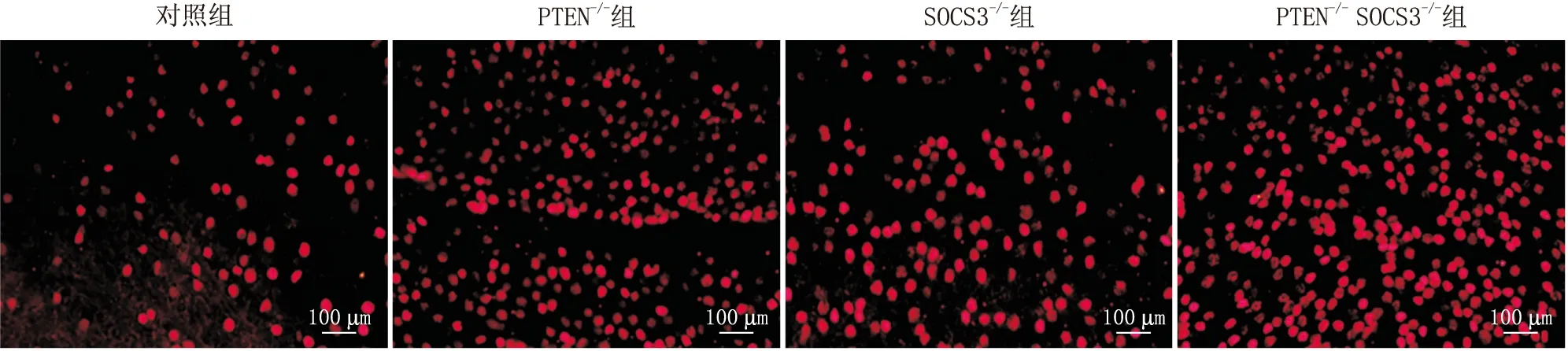
图2 各组大鼠RGCs存活情况
2.3 各组大鼠RGCs凋亡情况分析对照组、PTEN-/-组、SOCS3-/-组和PTEN-/-SOCS3-/-组大鼠RGCs凋亡率分别为17.96%、6.85%、12.37%和4.81%,PTEN-/-组和SOCS3-/-组大鼠RGCs凋亡率均显著低于对照组(均为P<0.001),PTEN-/-SOCS3-/-组大鼠RGCs凋亡率均明显低于PTEN-/-组和SOCS3-/-组(均为P<0.001)(图3)。
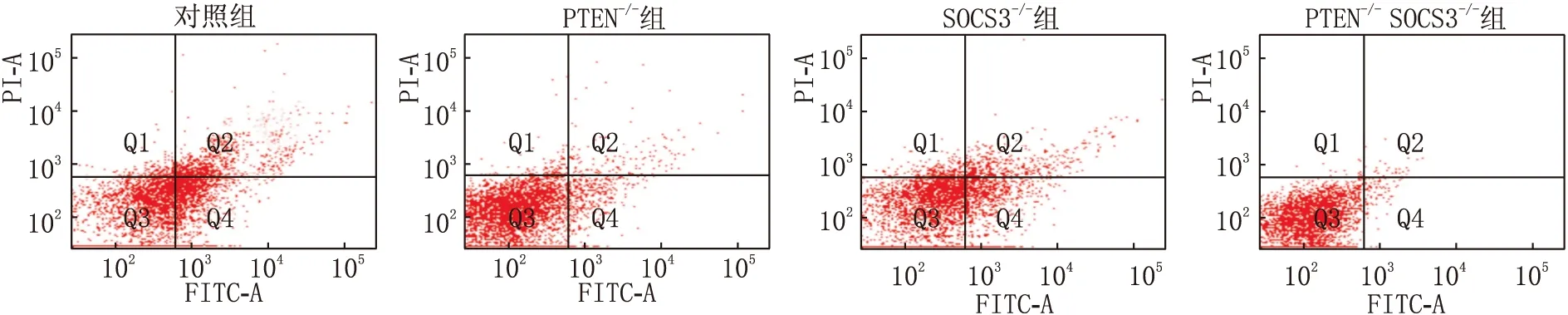
图3 各组大鼠RGCs凋亡情况
2.4 各组大鼠视神经损伤后轴突再生情况对照组大鼠视神经轴突数目为(36.27±11.58) 个,PTEN-/-组大鼠视神经轴突数目为(553.15±89.32)个,SOCS3-/-组大鼠视神经轴突数目为(126.48±37.53)个,PTEN-/-SOCS3-/-组大鼠视神经轴突数目为(954.03±87.59)个,PTEN-/-组和SOCS3-/-组大鼠视神经轴突数目均显著多于对照组(均为P<0.001),PTEN-/-SOCS3-/-组大鼠视神经轴突数目均明显多于PTEN-/-组和SOCS3-/-组(均为P<0.001)(图4)。
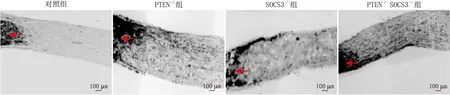
图4 各组大鼠视神经损伤30 d后轴突再生情况 注:红色箭头所指为视神经轴突。
2.5 各组大鼠RGCs中GFAP和GAP-43蛋白的表达PTEN-/-组和SOCS3-/-组大鼠RGCs中GFAP和GAP-43蛋白表达均显著低于对照组(均为P<0.001),PTEN-/-SOCS3-/-组大鼠RGCs中GFAP和GAP-43蛋白表达均明显低于PTEN-/-组和SOCS3-/-组(均为P<0.001)(图5)。
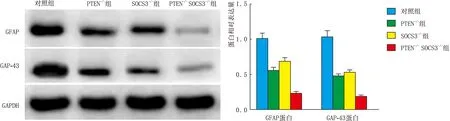
图5 各组大鼠RGCs中GFAP和GAP-43蛋白表达
3 讨论
视神经损伤后发生视觉功能减退不可逆的重要因素是RGCs在视神经损伤后继发性的变性。有研究显示,RGCs在视觉损伤后再生能力有限,所以抑制RGCs继发性的变性、阻滞其凋亡,对视神经损伤具有重要的意义[8]。另外,视神经再生与RGCs内轴突结构的再生在一定程度上关系密切,视网膜主要由RGCs层、内核层和外核层组成[9]。其中RGCs轴突投射至视神经,视神经元损伤后可能会分泌炎症因子,或者干扰营养因子的供应,导致RGCs启动凋亡的过程[10]。视神经的结构、发育特征以及相关功能与中枢神经系统具有一定的相似性,传统生物学研究认为,动物的中枢神经组织受损一般是不可再生的[11],所以说,视神经损伤后视觉功能是不可逆的。因此,研究中枢神经系统再生能力的内在机制是非常重要的。
PTEN是具有蛋白磷酸酶和脂质磷酸酶双重磷酸酶活性的基因,该基因除了具有调节细胞增殖和存活能力外,还具有调节细胞迁移、基因组稳定性和细胞周期等的作用[12]。SOCS-3 是JAK/STAT细胞因子信号转导通路的负性调控分子家族,能够负向调控细胞因子的转录,避免过度的炎症反应造成的组织损伤,在细胞免疫中发挥至关重要的作用[13]。目前PTEN和SOCS-3在RGCs存活和轴突再生中作用尚未完全清楚。在本研究中,我们杂交了PTENflox/flox、SOCS3flox/flox和Thy-1YFP大鼠转基因得到Thy1-YFP/PTENF/F、Thy1-YFP/SOCS3F/F和Thy1-YFP/PTENF/FSOCS3F/F大鼠,然后进行视神经损伤建模处理,研究PTEN、SOCS3基因缺失或者共同缺失对大鼠RGCs存活和轴突再生的影响。
本研究首先通过HE染色对各组大鼠视网膜组织的病理学进行对比分析发现,未做PTEN和SOCS3基因敲减的大鼠视网膜出现大量的炎症反应,细胞之间的结构混乱、连接差、分散性强,而分别敲减PTEN和SOCS3的大鼠视网膜炎症反应有所减轻,整体结构较规则,层次较清晰;PTEN和SOCS3共同敲减的大鼠视网膜炎症反应明显减轻,视网膜结构清晰有规则,细胞之间连接紧密,从而说明了PTEN和SOCS3缺失对大鼠视网膜形态学的变化有一定影响。为了证明PTEN和SOCS3缺失在RGCs中存活和凋亡的作用,本研究利用免疫荧光染色和流式细胞仪检测验证了RGCs存活和凋亡状况,结果发现,分别敲减PTEN和SOCS3大鼠RGCs存活率均显著高于未做PTEN和SOCS3基因敲减的大鼠,同时敲减PTEN和SOCS3大鼠RGCs存活率均明显高于分别敲减PTEN和SOCS3大鼠;分别敲减PTEN和SOCS3大鼠RGCs凋亡率均显著低于未做PTEN和SOCS3基因敲减的大鼠,同时敲减PTEN和SOCS3大鼠RGCs凋亡率均明显低于分别敲减PTEN和SOCS3大鼠。为了进一步验证PTEN和SOCS3缺失在大鼠视神经损伤后轴突再生中的作用,本研究结果发现,分别敲减PTEN和SOCS3大鼠视神经轴突数目均显著高于未做PTEN和SOCS3基因敲减的大鼠,同时敲减PTEN和SOCS3大鼠中视神经轴突数目均明显高于分别敲减PTEN和SOCS3大鼠。结果提示,同时敲减PTEN和SOCS3基因不仅可以促进大鼠RGCs活性,抑制其凋亡,还可以促进大鼠视神经损伤后轴突的再生功能。研究报道,特异性敲减小鼠体内的PTEN,提高了mTOR通路的活性,在皮质脊髓束损伤模型和成年小鼠视神经损伤中都观察到了大量的轴突再生[14]。也有研究报道,SOCS3在大鼠视网膜神经元内过表达,会损耗损伤神经元的再生和存活能力[15]。另有研究表明,视神经损伤后4周,同时敲减PTEN和SOCS3基因,与单独PTEN或SOCS3基因敲减相比,轴突再生的能力更强[16]。
GFAP是神经组织特异性磷酸蛋白,是神经生长、神经元发育、神经再生、突触形成和重建的标志蛋白[17]。GAP-43 是神经特异性的钙调素连接蛋白,可促进神经纤维的再生和分化,调节突触生长[18]。本研究通过Western blot检测结果发现,同时敲减PTEN和SOCS3基因大鼠RGCs中GFAP和GAP-43蛋白水平表达均明显降低,这说明敲减PTEN和SOCS3基因能够抑制GFAP和GAP-43的表达。
综上所述,PTEN和SOCS3基因缺失与视神经损伤大鼠RGCs存活和轴突再生具有一定的关系,不仅能够促进RGCs的增殖,抑制其凋亡,还能够促进视神经轴突再生,同时敲减PTEN和SOCS3基因则作用最为显著。

