柴油车尾气亚慢性暴露致小鼠肺部炎症反应、氧化损伤和细胞凋亡的作用研究
程志斌,刘艳菊,,*,郭青云,杨峥,钟震宇,李俊芳,单云芳,孟玉萍,王欣欣
1. 北京麋鹿生态实验中心,北京 100076 2. 北京市科学技术研究院分析测试研究所(北京市理化分析测试中心),北京 100089
城市化和工业化的发展导致了严重的全球性大气污染问题,其中,极端的“雾霾”污染天气对人类健康的危害成为近年来社会各界普遍关注的焦点[1-5]。机动车作为最重要的交通工具,其产生的尾气已经成为城市道路大气细颗粒物PM2.5(空气动力学直径≤2.5 μm的颗粒物)污染的主要来源[6-8]。其中,柴油车尾气(diesel engine exhaust, DEE)排放的污染物包含一氧化碳、氮氧化物、碳氢化合物、二氧化硫、多环芳烃和柴油车尾气颗粒物(diesel exhaust particles, DEPs)等有害物质[9-10]。研究表明,在同等功率下,柴油车尾气的毒性是汽油车尾气毒性的100倍[11],严重危害人体健康,导致呼吸系统[12]、神经系统[13]和泌尿系统[14]等的组织细胞氧化、炎症和DNA损伤,甚至诱发癌变[15-17]。
大气细颗粒污染物给健康造成危害的致病机制一直是科学家探索的命题[18-21]。研究者认为,DEPs具有重要的生物学毒性作用,长期暴露的情况下,会侵入小鼠肺组织细胞、诱导Th2型炎症反应,造成肺组织DNA损伤,原因在于DEPs的表面电荷达-39.1 mV且具有许多粒径<1 mm的颗粒物(有的粒径为20 nm),以及其化学组分中含有大量的铜和钙等金属氧化物[22]。研究发现,在暴露箱中暴露于1 mg·m-3或6 mg·m-3柴油车尾气4周后,雄性Lambda/LacI转基因鼠的肺组织DNA损伤程度和LacI基因的突变频率均显著高于对照组[23]。体外细胞实验表明,DEPs会引起人的A549肺细胞和小鼠原始巨噬细胞的氧化应激反应,导致膜泄露、脂质过氧化、细胞炎症等,致使细胞DNA受到损伤[24]。尽管人们已从不同侧面获取了大气细颗粒物污染给健康造成危害的信息,但复杂的致病机制仍无定论[25]。本研究通过自制暴露箱对小鼠进行亚慢性暴露实验,采用柴油发动机模拟未安装净化设施的柴油车尾气暴露场景,研究柴油车尾气对小鼠肺组织的氧化炎症损伤和病理损伤作用,同时观测暴露过程中柴油燃料尾气的主要污染气体及PM2.5化学成分含量,分析其对肺组织细胞凋亡及凋亡相关Bcl-2与Bax蛋白表达的影响情况,为探索柴油车尾气排放对动物机体的健康危害机制提供重要的实验依据。
1 材料与方法(Materials and methods)
1.1 主要仪器设备与试剂耗材
主要仪器设备:拖拉机(福田欧豹400型,中国)、中流量颗粒物采样器(崂应2030,青岛崂山应用技术研究所,中国)、离子色谱仪(ICS 2000,Dionex公司,美国)、元素碳/有机碳分析仪(DRI Model 2001A,Atmoslytic公司,美国)、X射线荧光分析仪(MESA-50,HORIBA公司,日本)、气相色谱-质谱联用仪(7890A-5977C,安捷伦公司,美国)、全自动生化仪(TBA-120FR ACCUTE型,东芝公司,日本)、可见光分光光度计(7200,上海优尼柯仪器有限公司,中国)、放射免疫仪(XH6080,西安核仪器厂,中国)、光吸收酶标仪(SunriseTMF50,帝肯,瑞士)、倒置显微镜(Nikon Ci-S,尼康公司,日本)、体视显微镜(SZ61,Olympus有限公司,日本)、稳压稳流电泳仪(Powerpac HQ,Bio-Rad公司,美国)、数码凝胶成像系统(2020D,BINTA公司,中国)、计算机图像分析仪(Image-Pro Plus Analysis Software)、烟气分析仪(Testo 340,德图,德国)、烟气探针(Testo 0409 1202,德图,德国)、CO检测仪(EM-20,香港澳洲新仪器,中国)。
主要试剂耗材:石英滤膜(1851-090,Whatman公司,英国)、柴油(0#中国石化);小鼠白细胞介素6(interleukin-6, IL-6)、乳酸脱氢酶(lactate dehydrogenase, LDH)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、转化生长因子β(transforming growth factor-β, TGF-β)试剂盒(北京冬歌生物科技有限公司,中国);总抗氧化能力(total antioxidation capacity, T-AOC)试剂盒(100T/96S,苏州科铭生物技术有限公司,中国)、超氧化物歧化酶(superoxide dismutase, SOD)试剂盒(9670087,苏州科铭生物技术有限公司,中国)、丙二醛(malonic dialdehyde, MDA)试剂盒(0041235,苏州科铭生物技术有限公司,中国)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒(A005,南京建成生物工程研究所,中国)、Bax抗体(2772S,上海江林生物科技有限公司,中国)、Bcl-2抗体(3498S,上海江林生物科技有限公司,中国)、GAPDH抗体(KM9002,天津三箭生物技术有限公司,中国)、罗氏TUNEL检测细胞凋亡试剂盒;自制的50 L铝箔气袋;自制的1 m×1 m×0.5 m的聚四氟乙烯可密封的暴露箱。
1.2 暴露实验气体制备和PM2.5样品采集与化学成分测定
1.2.1 暴露气体制备和PM2.5样品采集
以柴油为燃料的拖拉机怠速运行10 min废气排放状态稳定后,把不锈钢采样管伸入排气管内3 cm处,以100 L·min-1的流速把尾气吸入自制的50 L铝箔气袋至饱满,备亚慢性暴露实验用。用配有PM2.5采样头的中流量颗粒物采样器在石英膜上同步采集2份PM2.5平行样品,以备分析质量浓度和化学物质。参照文献[26-27]对采样前后的滤膜进行预处理并用十万分之一天平称重,获得PM2.5的质量浓度。
1.2.2 化学成分的测定
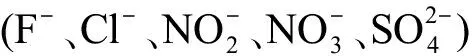
1.3 实验动物及亚慢性暴露实验
1.3.1 实验动物
购买北京华阜康生物科技股份有限公司(合格证号:11401300053484)的30只雄性7周龄SPF级ICR(Institute of Cancer Research,费城癌症研究所)小鼠,体质量38 g±2 g,每个鼠笼饲养2只鼠。实验在室温(22~29 ℃)下进行,饲养场所每日消毒,操作人员穿着防护服,以保证洁净的生长环境。小鼠实验前适应性饲养1周。
1.3.2 亚慢性暴露实验
将小鼠随机分为4个处理:1个对照组(blank control group, BCG),即小鼠直接暴露于室内空气中(6只小鼠);另外3个柴油暴露组均在可密封聚四氟乙烯暴露箱(1 m×1 m×0.5 m)内完成,分别为0.5 h柴油暴露组(0.5 h diesel engine exhaust exposure groups, 0.5 h DEEG) (8只小鼠,箱内柴油车尾气日暴露0.5 h)、1 h柴油暴露组(1 h DEEG) (8只小鼠,箱内柴油车尾气日暴露1 h)、2 h柴油暴露组(2 h DEEG) (8只小鼠,箱内柴油车尾气日暴露2 h)。用不锈钢波纹管密封连接已采集有柴油车尾气的毒气袋及暴露箱,通过控制PVC球阀、采用慢速气泵,把袋内气体缓慢泵入已放置了小鼠的暴露箱内,袋内气体完全泵入暴露箱后密封接口,让小鼠按上述处理设计在柴油车尾气中分别暴露0.5、1和2 h后,取出小鼠笼,打开密封盖,完全置换为新鲜空气,至此完成1 d的暴露实验。亚慢性染毒时间参考汪正东等[29]的大鼠亚慢性呼吸染毒效应研究,连续暴露实验95 d。
1.3.3 暴露气体化学组分测定
柴油车尾气亚慢性暴露的过程中,用烟气分析仪和烟气探针(泵速0.6 L·min-1)随机测量暴露箱内(每天小鼠进入暴露箱开始暴露的阶段和暴露快结束之前阶段)的O2、NOx、NO2、NO和SO2,CO检测仪随机测量暴露箱内CO的气体浓度。
1.4 动物样本制备及指标测定
亚慢性暴露实验结束后,使用乙醚将实验鼠麻醉,然后采用颈椎脱臼法处死实验鼠。(1)采集右侧鲜肺组织,-80 ℃下保存,根据相应试剂盒提供的方法,采用双抗体一步夹心法检测炎症指标IL-6、LDH、TGF-β和TNF-α,微量法检测T-AOC、MDA和SOD,比色法检测GSH-Px;每组随机选择5只小鼠的鲜肺组织,用Western blot检测凋亡相关蛋白Bax、Bcl-2的表达;(2)采集左侧鲜肺(同一部位),用福尔马林固定,制作蜡块;HE染色后制作肺组织病理切片,观察病理变化情况;每组随机选择4只小鼠的肺组织蜡块,用TUNEL法检测肺组织细胞凋亡率。
细胞凋亡率分析方法:从每个处理组的每张切片随机挑选5个200倍视野进行拍照。应用Image-Pro Plus 6.0软件选取相同的棕黄色细胞核作为判断所有照片阳性细胞的统一标准,选取相同的蓝色细胞核为总细胞,对每张照片进行分析,得出每张照片阳性细胞数以及总细胞数,并求出阳性细胞百分比((阳性细胞数/总细胞数)×100)即为凋亡率(%)。
1.5 数据分析
用Excel和SPSS 17.0软件计算平均值和标准差,对各组之间IL-6、LDH、TNF-α、TGF-β、T-AOC、SOD、MDA和GSH-Px等炎症反应和氧化应激指标,Bax蛋白、Bcl-2蛋白和细胞凋亡率,以及暴露箱内污染物浓度的差异性进行单因素方差分析(One-Way ANOVA),CO因均超过仪器量程无法统计差异性。方差齐性采用LSD检验,方差非齐性采用Dunnett’s T3检验,并绘制柱状图(平均值和标准误)。
2 结果(Results)
2.1 亚慢性暴露箱内柴油车尾气中的氧气和各类污染物浓度
统计分析表明,各组暴露箱在每天小鼠进入暴露箱的开始暴露阶段和暴露快结束之前阶段内O2浓度和污染物浓度差异均不显著(P>0.05)。暴露箱内O2浓度为20.7%(表1),达正常空气中的浓度值;柴油车尾气污染物浓度均偏高(表1),污染物浓度平均值严重超过《环境空气质量标准》(GB3095—2012)中二级小时浓度限值,是其限值的数倍,例如,NOx可达15倍,NO2为18.5倍,SO2为8.64倍,CO为10.4倍。柴油车尾气PM2.5中所测定的各类污染物中,OC浓度最高,高达2 309.53 μg·m-3,占PM2.5中总化学物质浓度的51.95%;其次是EC,为2 035.05 μg·m-3,占45.78%;再次是阴离子和阳离子,分别为57.43 μg·m-3和42.37 μg·m-3,各占1.29%和0.95%,最低的为7种重金属,为0.023 μg·m-3,占0.0005‰。PAHs中芘的含量最高,为218.56 ng·m-3,其次为荧蒽,为166.83 ng·m-3,苯并(a)芘的含量高达98.17 ng·m-3(表2)。
2.2 柴油车尾气亚慢性暴露对小鼠肺炎症指标的影响
统计分析表明,1 h柴油暴露组、2 h柴油暴露组小鼠肺组织的LDH分泌水平均显著高于对照组(P<0.05),3个柴油暴露组小鼠肺组织的IL-6、TNF-α和TGF-β的分泌水平与对照组无显著差异(图1)。这表明,柴油车尾气亚慢性暴露会导致小鼠肺组织LDH的分泌显著升高,但对IL-6、TNF-α和TGF-β的分泌无显著影响。
2.3 柴油车尾气亚慢性暴露对小鼠肺的氧化损伤
统计分析表明,1 h柴油暴露组、2 h柴油暴露组小鼠肺组织的T-AOC活性均显著低于对照组(P<0.05);2 h柴油暴露组的GSH-Px活性显著低于对照组(P<0.05);各组之间MDA含量和SOD活性无显著差异(图2)。这表明,柴油车尾气亚慢性暴露导致小鼠肺组织的T-AOC和GSH-Px活性降低,造成肺组织氧化损伤。
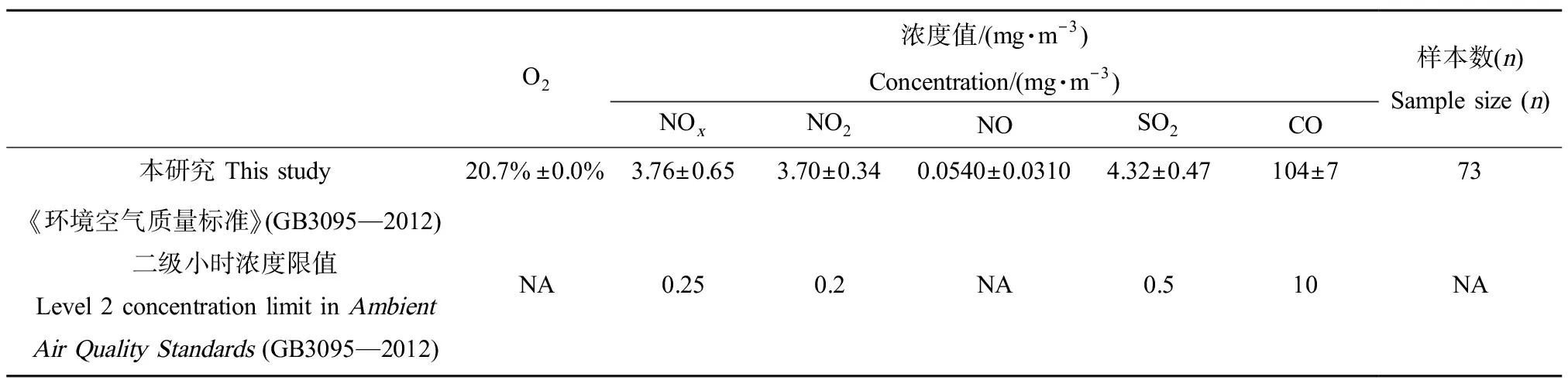
表1 亚慢性暴露箱内氧气及污染物浓度Table 1 Oxygen and pollutant concentration in subchronic exposure box

表2 亚慢性暴露箱PM2.5几种主要化学组分浓度Table 2 Main chemical components in PM2.5 for subchronic exposure box

图1 柴油车尾气亚慢性暴露后小鼠的肺炎症指标水平注:BCG表示对照组,0.5 h、1 h和2 h DEEG表示0.5 h、1 h和2 h柴油暴露组,IL-6表示白细胞介素6,LDH表示乳酸脱氢酶, TNF-α表示肿瘤坏死因子α,TGF-β表示转化生长因子β;同一参数具有相同字母的2个处理之间无显著差异(P>0.05), 不具有相同字母的2个处理之间有显著差异(P<0.05)。Fig. 1 The inflammatory factors in mice lung after subchronic exposure to diesel engine exhaust Notes: BCG means blank control group; 0.5 h, 1 h and 2 h DEEG means 0.5 h, 1 h and 2 h diesel engine exhaust exposure group; IL-6 means interleukin-6, LDH means lactate dehydrogenase, TNF-α means tumor necrosis factor-α, and TGF-β means transforming growth factor-β; there is no significant difference between two treatments with same letter at P>0.05, and there is significant difference between two treatments without same letter at P<0.05.
2.4 柴油车尾气亚慢性暴露后小鼠肺组织的病理损伤
组织病理观察结果表明(图3),柴油车尾气对小鼠肺组织的损伤随暴露时间的增加而加重,损伤程度表现为:2 h柴油暴露组>1 h柴油暴露组>0.5 h柴油暴露组。随着暴露时间的延长,小鼠肺出现损伤的细胞数量增多、损伤程度加重,如充血较重,出现大量淋巴细胞、中性粒细胞浸润,肺泡间质增生明显,1 h柴油暴露组和2 h柴油暴露组可见肺泡细支气管黏膜细胞脱落。
2.5 柴油车尾气亚慢性暴露对小鼠肺组织细胞凋亡的影响
细胞凋亡TUNEL染色研究表明,各柴油暴露组小鼠的肺组织细胞均出现异常,1 h柴油暴露组和2 h柴油暴露组的细胞凋亡情况更加严重(图4)。统计分析表明,0.5 h柴油暴露组与对照组之间的小鼠肺组织的细胞凋亡率无显著差异(P>0.05),而1 h柴油暴露组的细胞凋亡率显著高于0.5 h柴油暴露组和对照组(P<0.05)。这表明,柴油车尾气亚慢性暴露可导致小鼠肺组织细胞凋亡,长期每天长时间柴油暴露可导致小鼠肺组织细胞凋亡率增加。
2.6 柴油车尾气亚慢性暴露对小鼠肺组织细胞凋亡相关蛋白Bax、Bcl-2表达的影响
表征各暴露组小鼠肺组织细胞凋亡相关蛋白Bax、Bcl-2表达的电泳结果如图5所示(每组5个测试样本中随机选择4个作图)。统计分析表明,小鼠肺组织的细胞凋亡蛋白Bax、Bcl-2的表达以及Bcl-2/Bax比值在不同处理组之间均不存在显著差异(P>0.05)(图4)。但细胞凋亡Bax蛋白表达水平上,0.5 h柴油暴露组显著高于1 h柴油暴露组和2 h柴油暴露组(P<0.05);细胞凋亡Bcl-2蛋白表达水平上,1 h柴油暴露组显著高于2 h柴油暴露组(P<0.05);细胞凋亡Bcl-2/Bax比值上,1 h柴油暴露组显著高于0.5 h柴油暴露组(P<0.05)。这表明,柴油车尾气亚慢性暴露使小鼠肺组织细胞凋亡相关蛋白Bax、Bcl-2表达产生异常。
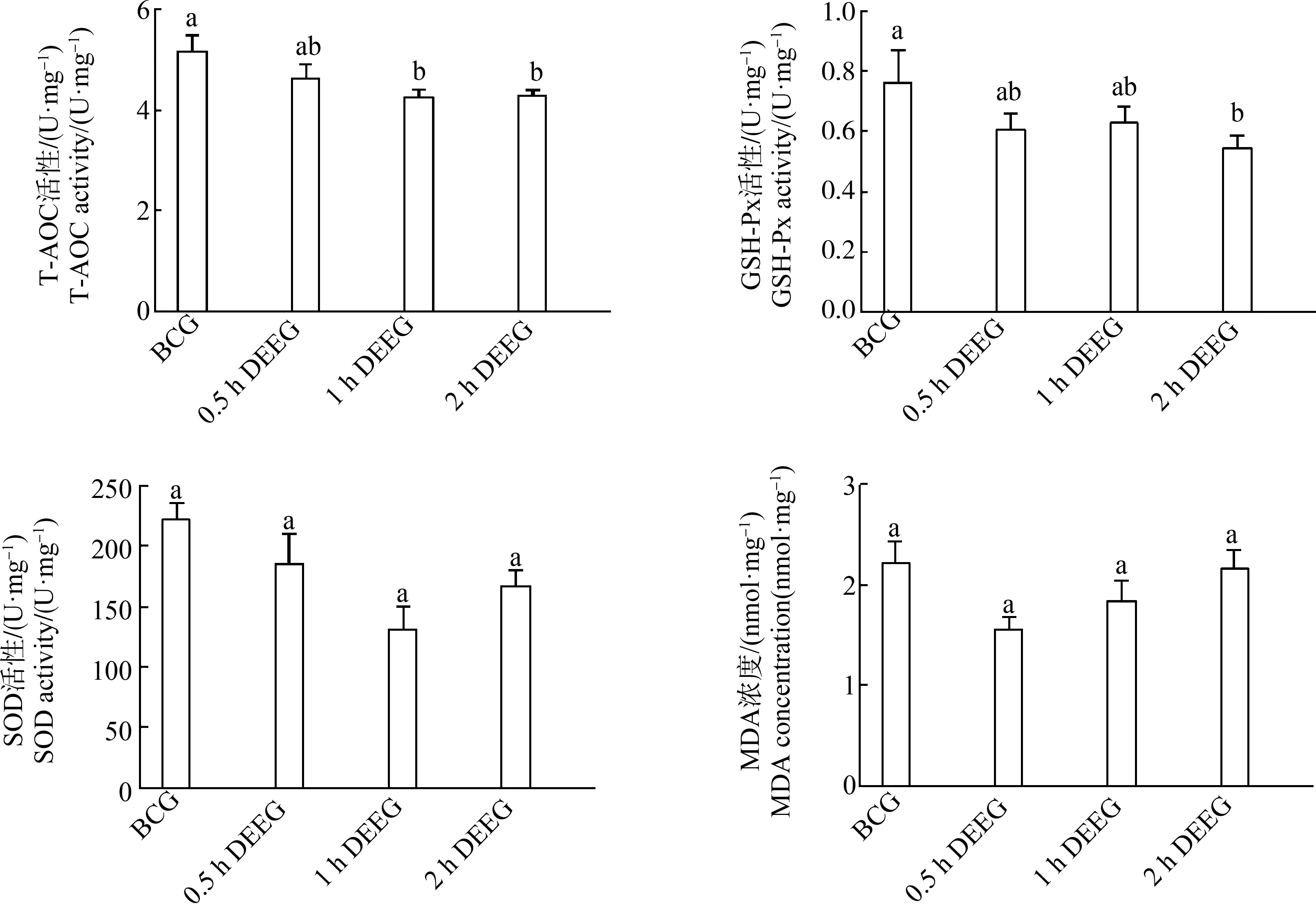
图2 柴油车尾气亚慢性暴露后小鼠肺的氧化应激指标水平注:T-AOC表示总抗氧化能力,GSH-Px表示谷胱甘肽过氧化物酶,SOD表示超氧化物歧化酶,MDA表示丙二醛; 同一参数具有相同字母的2个处理之间无显著差异(P>0.05),不具有相同字母的2个处理之间有显著差异(P<0.05)。Fig. 2 The oxidative stress factors in mice lung after subchronic exposure to diesel engine exhaustNotes: T-AOC means total antioxidant capacity, GSH-Px means glutathione peroxidase, SOD means superoxide dismutase, and MDA means malonic dialdehyde; there is no significant difference between two treatments with same letter at P>0.05, and there is significant difference between two treatments without same letter at P<0.05.
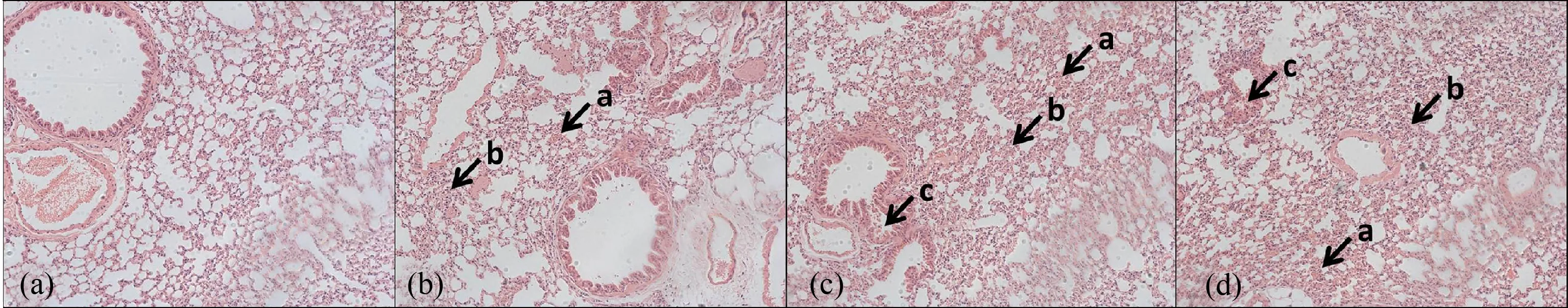
图3 柴油车尾气亚慢性暴露后小鼠肺组织病理切片HE染色图(10×10)注:(a)空白对照组(BCG),(b) 0.5 h柴油暴露组(0.5 h DEEG),(c) 1 h柴油暴露组(1 h DEEG),(d) 2 h柴油暴露组(2 h DEEG); a肺泡组织充血,b淋巴细胞、中性粒细胞浸润,肺泡间质增生,c肺泡细支气管黏膜细胞脱落。Fig. 3 The pathological changes (HE stain) of lung in mice after subchronic exposure to diesel engine exhaust (10×10)Note: (a) blank control group (BCG), (b) 0.5 h diesel engine exhaust exposure group (0.5 DEEG), (c) 1 h diesel engine exhaust exposure group (1 h DEEG), (d) 2 h diesel engine exhaust exposure group (2 h DEEG); a, alveolar congestion; b, lymphocyte and neutrophil infiltration, alveolar interstitial hyperplasia; c, exfoliation of alveolar bronchiole mucosal cells.
3 讨论(Discussion)
3.1 柴油车尾气亚慢性暴露导致肺组织病变
病理变化研究表明,在柴油车尾气暴露箱每天暴露0.5、1和2 h的情况下,连续暴露95 d后,小鼠肺组织会受到损伤,表现为肺组织充血,大量淋巴细胞、中性粒细胞浸润,肺泡间质增生,1 h柴油暴露组和2 h柴油暴露组可见肺泡细支气管黏膜细胞脱落,损伤随日暴露时间增加而加重。这与杨玲等[30]的研究结果相一致,该研究中,每天暴露在排量为1.4 L和2.8 L的柴油机尾气中0.5 h,连续暴露28 d后,小鼠的肺气道上皮细胞脱落,支气管周围炎性细胞浸润。急性暴露研究也观察到这一现象,利用气管滴注法将小鼠急性暴露于小剂量DEPs,会引起小鼠短暂的急性轻、中度肺部炎症和组织损伤,表现为中性粒细胞和肺泡巨噬细胞浸润,局灶性肺泡炎,可见DEPs渗入至肺组织造成伤害[25]。
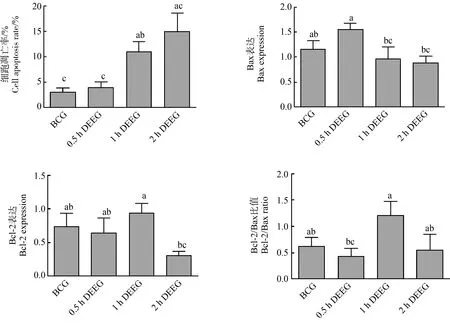
图4 柴油车尾气亚慢性暴露后小鼠肺组织的细胞凋亡率、细胞凋亡相关蛋白Bax、Bcl-2的表达注:同一参数具有相同字母的2个处理之间无显著差异(P>0.05),不具有相同字母的2个处理之间有显著差异(P<0.05)。Fig. 4 Cell apoptosis rate and its relative protein Bax, Bcl-2 expression level of mice lung after subchronic exposure to diesel engine exhaustNotes: There is no significant difference between two treatments with same letter at P>0.05, and there is significant difference between two treatments without same letter at P<0.05.

图5 柴油车尾气亚慢性暴露后小鼠肺组织细胞凋亡相关蛋白Bax、Bcl-2的表达电泳图Fig. 5 The electrophoresis results for expression of Bax, Bcl-2 related to cell apoptosis in mice lung after subchronic exposure to diesel engine exhaust
3.2 TUNEL染色结果显示暴露组细胞凋亡指数升高
本研究中,TUNEL染色结果表明,长期每天长时间暴露于柴油车尾气的情况下,1 h柴油暴露组和2 h柴油暴露组细胞凋亡较对照组严重;统计细胞凋亡指数发现,柴油车尾气亚慢性暴露(1 h·d-1和2 h·d-1)会导致小鼠肺组织细胞凋亡率增加。细胞凋亡又称程序性细胞死亡,指为维持内环境稳定,由基因控制的细胞自主的有序死亡,它是细胞对环境的生理性或病理性刺激信号等产生的应答有序变化,也是细胞在各种内外信号激活细胞死亡程序后发生的一种自杀行为[31]。细胞凋亡是DEPs对动物组织病理损伤的重要机制之一。例如,经DEPs急性暴露12 h后,人脐静脉内皮细胞降低了mdm2癌基因的表达,导致p53抑癌基因表达增加,从而引发细胞凋亡,最终导致内皮功能障碍[32]。丁香酚能够减弱DEPs急性暴露24 h后对caspase-3基因的细胞凋亡信号的激活,减少细胞凋亡,进而避免DEPs引起小鼠肺组织炎症和肺泡塌陷的变化[9]。
3.3 细胞凋亡重要环节中氧化应激和炎症反应相关指标的表达和分泌水平
氧化应激和炎症反应是导致细胞凋亡的重要环节[33-34]。PM2.5被吸入机体后,遇到肺部表面的巨噬细胞、支气管上皮细胞后促使其释放大量炎症细胞因子,如IL-6、IL-8,从而引发机体炎症反应[21]。有研究认为,PM表面携带的铁、铜、锌和锰等金属元素、多环芳烃和超细颗粒物等激活了机体自身的防御途径,导致炎性因子释放过多,产生炎性反应,引起细胞破坏甚至死亡[35-37]。本研究中,柴油车尾气亚慢性暴露会导致小鼠肺组织LDH的分泌显著升高,而IL-6、TNF-α和TGF-β分泌水平未见显著变化。这与以往DEPs急性暴露的研究结果相似,采用急性气管滴注暴露方式,每只小鼠的DEPs暴露剂量为5、35和50 mg·kg-1,气管滴注1、7和30 d后肺泡灌洗液中LDH的分泌水平均显著高于对照组;在急性暴露1 d后IL-6的mRNA表达水平显著升高,但在7 d和30 d后回归至正常水平;炎症指标中TGF-β和TNF-α的mRNA表达水平始终未见显著变化[38]。体外细胞暴露研究结果表明,柴油车尾气颗粒物提取物使中国仓鼠肺成纤维细胞内的LDH漏出率增加,造成细胞损伤[39]。然而经鼻滴注法滴注低剂量DEPs(15 μg DEPs每只小鼠),亚慢性暴露90 d(每周连续滴注5 d),实验结果表明,DEPs的炎症指标分泌水平与对照组没有显著差异,但是暴露组的组织病理变化显著增大[40]。暴露时间长短不一,会导致LDH、IL-6、TNF-α和TGF-β等炎症指标水平出现差异[38],这也许是造成本研究中炎症指标表达水平异常的原因。氧化应激方面,有研究表明,气管滴注法进行3次PM2.5暴露后(间隔48 h滴注1次),雄性大鼠暴露组的SOD和GSH-Px活性水平显著下降,反映脂质过氧化的MDA水平则显著增加[41]。采用气管滴注法将小鼠急性暴露于DEPs 24 h后(暴露剂量为每只小鼠15 μg、20 μg的DEPs),小鼠肺泡灌洗液和肺组织的SOD和GSH-Px活性水平、MDA含量也有相同变化规律[42-43]。本研究中,虽然柴油暴露组之间SOD水平无显著差异,但1 h柴油暴露组和2 h柴油暴露组中T-AOC水平均显著低于对照组;2 h柴油暴露组的GSH-Px活性显著低于对照组;仅MDA水平在各组之间差异不显著。组织氧化损伤一般会表现出细胞膜脂质的过氧化,表现为过氧化产物MDA分泌增多,但这种过氧化一般作为氧化损伤前期表现,本研究中的小鼠在柴油车尾气环境下暴露时间长达95 d,这可能是MDA没有差异性的主要原因。而且本研究中污染物除了柴油燃烧排放的颗粒物外,还有有毒气体成分,因而表现出不同的氧化炎症效应。
3.4 作为细胞凋亡信号之一的Bcl-2蛋白、Bax蛋白表达水平
细胞凋亡的信号途径具有多样性,这使得凋亡的发生及调控机制非常复杂[44-45]。Bcl-2蛋白家族被认为是线粒体凋亡信号通路中关键的调节因子,分为抗凋亡Bcl-2亚家族,主要包括Bcl-2、Mcl-1和Bcl-xL;促凋亡Bax亚家族,主要包括Bax、Bak和仅含BH3结构域的BH3-only亚家族[46]。Bcl-2家族蛋白可通过与本家族或其他家族蛋白的相互作用促进或抑制细胞凋亡,其中,Bcl-2蛋白可通过与Bax形成稳定的化合物抑制后者的促凋亡功能,影响线粒体凋亡通路介导的细胞凋亡,而且Bcl-2蛋白还可以抑制或阻断Fas和Fas-L所介导的死亡受体凋亡通路,从而达到抑制或阻断细胞凋亡的作用[47]。本研究中,3个柴油暴露组Bcl-2蛋白、Bax蛋白表达水平及Bcl-2/Bax比值,虽然与对照组之间均不存在显著差异,但是各暴露组之间存在显著差异,说明柴油车尾气亚慢性暴露对小鼠细胞凋亡调控蛋白Bcl-2和Bax的表达具有影响。以往体外细胞暴露实验结果表明,小鼠单核巨噬细胞经DEPs暴露后,Bax蛋白水平持续上调,认为DEPs通过激活p53基因,继而激活Bax,触发J774A.1巨噬细胞凋亡[48]。但是通过人体暴露实验发现,哮喘患者、鼻炎患者在柴油车尾气环境下(100 μg·m-3)暴露2 h,暴露后再经过18 h,取支气管活检样品,与健康对照者比较,促凋亡和抗凋亡蛋白(如Bak、Bcl-2)表达水平无显著差异,未见支气管上皮细胞凋亡或增殖,认为接触交通来源的污染并不会加重哮喘患者的呼吸症状[49]。
3.5 柴油车尾气亚慢性暴露导致的小鼠肺部毒理伤害
柴油车尾气的有害成分较多,DEPs中90%的颗粒物直径<22.60 μm,50%的颗粒物直径<6.80 μm,10%的颗粒物直径<1.54 μm[9]。PM2.5毒理研究已表明,PM2.5颗粒物小,能够进入到肺组织细胞,造成氧化损伤、炎症反应,导致细胞凋亡等[50-51]。本研究中,亚慢性暴露箱内柴油车尾气PM2.5中,OC含量最高,占51.95%;其次是EC,占45.78%;然后是阴阳离子,分别占1.29%和0.95%;暴露箱中NO2浓度为3.705 mg·m-3,CO浓度为104.087 mg·m-3,均超过《环境空气质量标准》(GB3095—2012)的浓度限值;PAHs中致癌性最强的苯并(a)芘含量高达98.17 ng·m-3。这些污染物均是造成小鼠肺部毒理伤害的重要因素。以往研究表明,DEPs的物理化学性质,如表面电荷、粒径和化学成分,在生物毒理反应中起着至关重要的作用,一次性气管滴注急性暴露后,1、7、14和28 d后小鼠肺泡灌洗液和血液中的IL-6、TNF-α分泌水平均显著升高,肺组织病理学观察结果表明,DEPs的PM2.5渗入肺组织细胞之间[22]。暴露于高浓度DEE的地下旷工,由于吸入EC、挥发性有机物(VOCs)、NO2和DEPs,肺功能指标一秒率(FEV1/FVC)的Z分值与EC和DEPs显著相关,但与VOCs、NO2无关,地下旷工的肺功能显著下降[52]。
本研究通过模拟柴油车尾气污染环境,对小鼠进行亚慢性染毒研究,结果表明,柴油车尾气亚慢性暴露可通过显著升高LDH、降低T-AOC和GSH-Px的活性而造成小鼠肺组织炎症损伤和氧化应激,导致细胞凋亡率升高,且存在时间效应,造成凋亡蛋白Bax和Bcl-2表达水平显著异常。暴露导致小鼠肺组织病理损伤,严重的肺充血、大量淋巴细胞和中性粒细胞浸润,肺泡间质增生明显,且损伤程度随着暴露时间的增加而增加。小鼠亚慢性暴露过程中受到的氧化炎症和病理损伤可能与柴油车尾气中高浓度NO2、CO和PAHs等有毒气体以及细颗粒物中高浓度的OC、EC等污染物的作用有关。

