微塑料对双齿围沙蚕生理代谢的影响研究
张涛,刘凯,孙一鑫,王孝天,方涛,吴亚平,冯志华,*
1. 江苏海洋大学江苏省海洋生物资源与环境重点实验室,连云港 222005 2. 华东师范大学河口海岸学国家重点实验室,上海 200241 3. 江苏海洋大学江苏省海洋生物技术重点实验室,连云港 222005 4. 江苏海洋大学江苏省海洋生物产业技术协同创新中心,连云港 222005
微塑料通常指粒径<5 mm的塑料颗粒或碎片[1],自被发现以来备受国内外研究者关注。海洋中的微塑料主要包括聚丙烯(PP)、聚氯乙烯(PVC)、聚酰胺(PA)、聚乙烯(PE)、聚苯乙烯(PS)和聚对苯二甲酸乙二酯(PET)等材质[2]。其中,PP材质的塑料既被广泛应用于汽车行业,也常用于制作薄膜和管材;PVC不仅在管材方面多有应用,还可作为电线电缆的制作原料[3];PA则在日常办公生活、机械工程和物流运输等领域多有应用[4-6]。研究发现,微塑料在海洋垂直断面中均有分布,海水表层中主要漂浮着密度较低的微塑料,深海和海底沉积物中的微塑料则主要为高密度微塑料,还有一些低密度微塑料在潜流和风力等的作用下向深海转移,最终聚集在海底沉积物中[7]。Lattin等[8]研究发现美国圣莫妮卡湾和加州海域中,海底微塑料丰度高于中部和表层海水中微塑料丰度,且进入海底的微塑料不易返回上层水体,海底沉积物最终将成为微塑料的储藏库[9-10]。此外,微塑料具有多种环境行为,例如,微塑料能够在生物体内长期积累,并对其繁殖等活动产生影响[11]。并且,部分微塑料可在海洋环境中稳定存在数百年至几千年,也可能对海洋生物有慢性毒性效应[12]。
底栖多毛类动物双齿围沙蚕(Perinereisaibuhitensis)主要栖息于潮间带,以沉积物中的有机物为食,是多种海洋生物的捕食对象[13]。有研究发现,双齿围沙蚕易受环境中毒害物质影响,且在海洋生态系统的食物链中起重要的传递作用[14]。温度、氨氮、pH、重金属和持久性有机污染物(POPs)等对双齿围沙蚕生理和代谢能力可造成一定影响[15-18]。此外,沙蚕可作为指示生物用于评价河口生态系统中重金属、石油烃等有毒污染物的污染程度[18-20],其体内乙酰胆碱酯酶(AchE)活性可评价环境污染物的毒性效应[18,21-22]。有研究者认为沙蚕比浅沟蛤(Scrobiculariaplana)更适合作为沉积物污染状况评价的指示生物[23]。
微塑料作为一种新型污染物,近几年一直是国际海洋环境研究的热点话题。大量的研究已经证实微塑料广泛存在于我国近海及河口区的沉积物中[24-26]。沙蚕摄食微塑料并由此引发的一系列不良影响可能通过食物链的传递对近岸海洋生态系统的稳定性产生影响。虽然已有研究证实了微塑料对沙蚕行为的不良影响[27],但是关于微塑料对双齿围沙蚕生理代谢的影响尚未见报道。因此,探究微塑料对沙蚕的生理代谢的影响对于评估微塑料对近岸海域的生态环境效应具有重要意义。
1 材料与方法(Materials and methods)
1.1 材料与实验条件
实验所用海水、海沙、海淤泥和双齿围沙蚕均取自江苏省连云港市高公岛乡潮间带,海水通过孔径为0.45 μm的醋酸纤维滤膜过滤后曝气24 h;海沙在采样现场经孔径为880 μm的筛网初步筛分去除大颗粒物质后密封保存,转移至实验室后冷冻(-22 ℃)保存,海沙在使用前用上述过滤后的海水进行浸泡洗涤;海淤泥经1 mm孔径的不锈钢标准筛过滤后装于冰盒中,将双齿围沙蚕转移至冰盒中进行1~2周的投喂暂养。
实验前停止投喂,饥饿处理48 h。每组选择1只体长约10 cm,体质量约2 g且体形完整健康的双齿围沙蚕置于烧杯中,放于培养箱中于21 ℃无光条件下连续实验16 d,并定期使用漩涡式充气增氧机进行1 h微曝气,实验前后称取双齿围沙蚕质量(图1)。
实验所使用的微塑料颗粒经Mastersize 2000激光粒度仪分析粒径。实验选用不同粒径的PP、PA和PVC微塑料颗粒(均为广东省东莞市樟木头乐华塑胶商行产品),具体参数如表1所示。3种不同材质的微塑料与海沙分别以不同质量比混合均匀,设置0.1%(1 000 mg·kg-1)、1%(10 000 mg·kg-1)和5%(50 000 mg·kg-1)共3个不同浓度组[28],最后加入约0.5 mm海沙覆盖,以防止微塑料上浮。空白对照组不添加微塑料颗粒,对照组与实验组使用经相同步骤处理的海沙,实验组和对照组均设置3个重复。实验参数的测定时间分别为0.5、2、4、8和16 d。
1.2 酶活性的测定
本研究分别测定过氧化氢酶(CAT)和乙酰胆碱酯酶(AchE)的活性。测定前制备组织匀浆,迅速称取0.5 g的双齿围沙蚕头部约15体节置于玻璃匀浆器中(冰水浴,0 ℃),然后按1∶9(m∶V)比例加入0.9%的生理盐水进行机械匀浆,置于高速冷冻离心机中于4 ℃、2 500 r·min-1条件下离心10 min,取上清液,立即稀释,用试剂盒(南京建成生物技术有限公司)测定CAT和AchE活性。
1.3 排氨率的测定

排氨率(N) (mg·(L·g·d)-1)计算公式为:
N=(Nt-N0)/(m×t)
式中:Nt为实验时水体的氨氮质量浓度(mg·L-1);N0为对照组起始时水体的氨氮质量浓度(mg·L-1);m为沙蚕的质量(g);t为实验持续时间(d)。
1.4 呼吸速率的测定
能量代谢以双齿围沙蚕的氧气消耗速率,即呼吸速率来表征,单位为mg·(L·g·s)-1。测定之前用过滤海水将双齿围沙蚕洗净,置于盛有100 mL干净海水的玻璃锥形瓶中,瓶底部放有磁转子用以均质化水中的溶解氧。氧电极探头放入锥形瓶中充分浸入海水(水温20 ℃),并以封口膜封住瓶口。将20 ℃时蒸馏水中的饱和溶解氧值8.82 mg·L-1设定为100%,测定在该温度下双齿围沙蚕的耗氧量,时间间隔为5 s,共计数11次[31]。
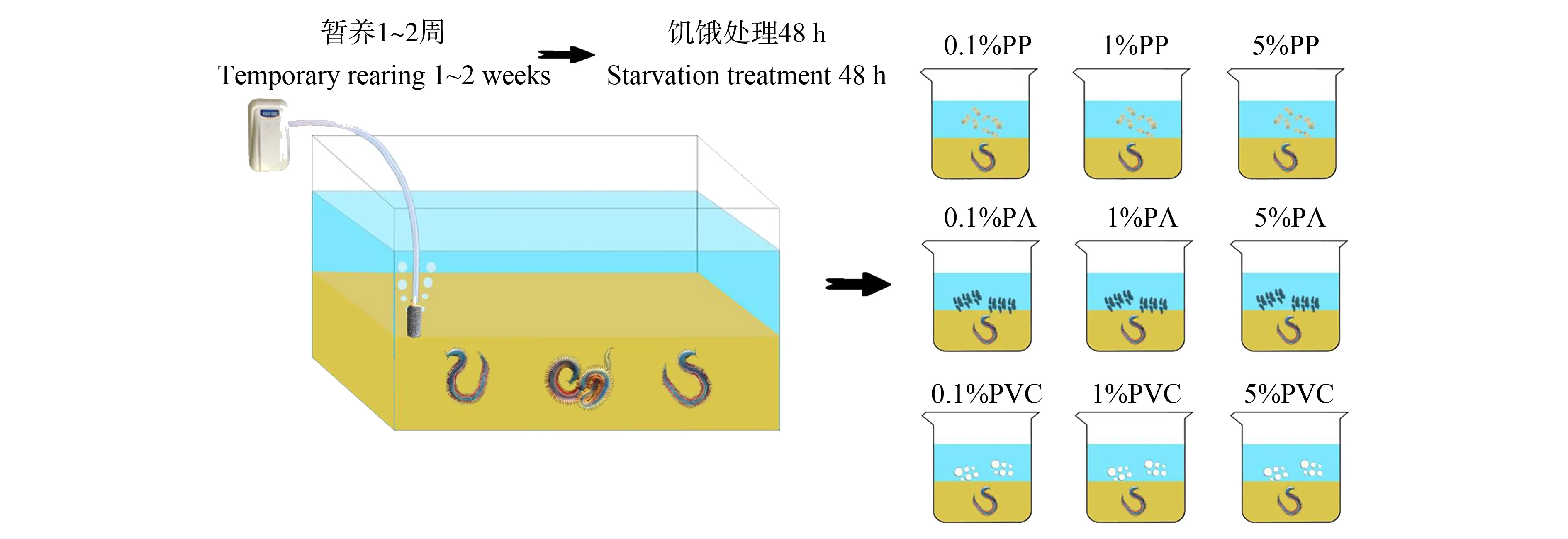
图1 不同浓度微塑料作用于双齿围沙蚕实验示意图注:PP表示聚丙烯,PA表示聚酰胺,PVC表示聚氯乙烯。Fig. 1 Schematic diagram of the experiment of different concentrations of microplastics on P. aibuhitensis Note: PP means polypropylene; PA means polyamide; PVC means polyvinyl chloride.

表1 实验中微塑料材质、粒径和密度Table 1 Components, size and density arrangement of microplastics in experiment
耗氧率(R)(mg·(L·g·s)-1)计算公式为:
R=(Dt-D0)/(m×t)
式中:Dt为实验时水样的溶解氧浓度(mg·L-1);D0为对照组起始时水样的溶解氧浓度(mg·L-1);m为沙蚕的质量(g);t为实验持续时间(s)。
1.5 数据处理与分析
所有数据转换和分析均在SPSS 23.0软件上进行,采用秩和检验(Wilcoxon-Mann-Whitney),显著性水平为P<0.05或P<0.01,运用Origin pro 2019绘制图表。
2 结果(Results)
2.1 微塑料对双齿围沙蚕CAT和AchE活性的影响
实验过程中双齿围沙蚕在培养1 d后均潜入沙土中,在16 d的实验中无死亡且无明显排泄物产生,实验前后双齿围沙蚕体质量未出现明显变化(<0.02 g)。实验前后对照组中的双齿围沙蚕在实验前后CAT活性变化波动较小,处于较稳定的状态,在(12.00±0.70)~(15.00±0.73) U·mg-1浓度范围内。实验组双齿围沙蚕体内CAT活性变化如图2所示,随着实验时间的延长,PP和PVC实验组整体呈现先增高后降低趋势。对于PA实验组,在低浓度(0.1%)下总体呈现先增高后降低又增高趋势,在中高浓度(1%和5%)下则呈现出降低再增高又降低的趋势。在为期16 d的实验过程中,微塑料浓度对双齿围沙蚕CAT活性存在显著影响(P>0.05),且随着微塑料浓度升高,CAT活性随之升高。在5%浓度不同材质微塑料环境下双齿围沙蚕CAT活性均于实验4 d出现最大值。在实验4 d时,摄入5%浓度PP微塑料后双齿围沙蚕CAT活性达到最高,为(45.00±2.49) U·mg-1,是对照组CAT活性的3.46倍。
如图3所示,对照组中双齿围沙蚕在实验前后AchE活性处于相对稳定状态,浓度范围在(0.75±0.04)~(0.96±0.05) U·mg-1。随着实验时间的延长,实验组双齿围沙蚕AchE活性呈现先升高后降低趋势,并在高浓度(5%)微塑料下,双齿围沙蚕AchE活性与对照组相比显著升高(P<0.05)。在摄入5%浓度PP微塑料后,双齿围沙蚕AchE活性于4 d达到最高,为(2.20±0.10) U·mg-1,与对照组相比增长了193.33%;而在4 d摄入5%浓度PVC微塑料后双齿围沙蚕体内AchE活性,仅为(1.14±0.05) U·mg-1,与对照组相比增长了34.11%。除此之外,在低浓度(0.1%)PVC实验组出现抑制双齿围沙蚕AchE活性的情况,在16 d时与对照组相比AchE活性降低了34.11%,仅在高浓度(5%)微塑料环境下较对照组双齿围沙蚕体内AchE活性有明显提高。

图2 不同材质微塑料暴露下双齿围沙蚕体内过氧化氢酶(CAT)活性变化Fig. 2 Catalase (CAT) activity of P. aibuhitensis exposed to different materials of microplastics

图3 不同材质微塑料暴露下双齿围沙蚕体内乙酰胆碱酯酶(AchE)活性变化Fig. 3 Acetylcholinesterase (AchE) activity of P. aibuhitensis exposed to different materials of microplastics
2.2 微塑料对双齿围沙蚕排氨率的影响

2.3 微塑料对双齿围沙蚕呼吸速率的影响
由图5可知,对照组双齿围沙蚕的呼吸速率在(0.011±0.001)~(0.014±0.001) mg·(L·g·s)-1之间变化,且不随时间推移有显著波动(P>0.05)。在实验组中,随着实验时间的延长,双齿围沙蚕呼吸速率在0.5~4 d有明显提高,在8 d之后,1%浓度不同材质微塑料暴露下双齿围沙蚕呼吸速率维持在0.050 mg·(L·g·s)-1左右,约为对照组的5倍。本研究发现,由于双齿围沙蚕摄入微塑料的材质不同,其呼吸速率有显著差异(P<0.01)。但是,暴露时间的长短对双齿围沙蚕呼吸速率并未产生明显影响(P>0.05),而与环境中微塑料的浓度存在明显的剂量关系,随微塑料浓度的增加,5%浓度实验组双齿围沙蚕的呼吸速率显著提高(P<0.01)。
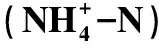
表2 不同微塑料暴露组水体氨氮浓度变化Table 2 Changes of ammonia nitrogen concentration exposed to different materials of microplastics (mg·L-1)
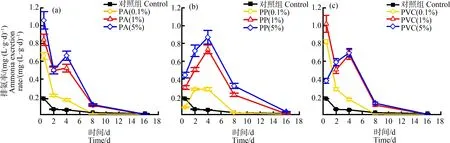
图4 不同材质微塑料暴露下双齿围沙蚕的排氨率变化Fig. 4 The ammonia excretion rate of P. aibuhitensis exposed to different materials of microplastics

图5 不同材质微塑料暴露下沙蚕的呼吸速率变化Fig. 5 Respiration rate of P. aibuhitensis exposed to different materials of microplastics
3 讨论(Discussion)
生物体在受到重金属、持久性有机污染物等环境污染物胁迫时,细胞内会积累大量活性氧分子(ROS),并且激活机体内活性氧防护系统(过氧化氢酶、超氧化物歧化酶和过氧化物酶)以保护机体。此类酶主要参与将组织中有毒的H2O2转化为无毒性的H2O和O2的代谢过程,因此其酶活大小反应机体能否正常生存[32]。本研究发现,双齿围沙蚕在摄入微塑料后组织中CAT活性显著提高,具体表现为先升高后降低,表明沙蚕在不同微塑料浓度作用下细胞可能受到一定程度的损伤,沙蚕体内抗氧化物酶对微塑料颗粒产生的氧化胁迫作用作出响应。并且,不同浓度的微塑料与CAT的活性之间存在显著的剂量-效应关系,Cd2+和苯并芘等污染物对沙蚕的酶活影响具有类似的规律[33],但是作用机制不同。重金属的生物毒性主要表现为细胞中累积并长期产生毒性效应,而微塑料作为一种颗粒态环境污染物主要通过生物的口进入消化道累积,同时生物体对于微塑料也具有一定的清除能力。目前的研究也表明,微塑料对生物体的不良影响主要包括磨损或阻塞消化道造成机械损伤、降低滤食率和生长率、导致能量消耗和氧化胁迫等[34-35]。本研究中,随微塑料浓度提高至高浓度水平时,双齿围沙蚕体内的CAT活性并没有进一步提高而是维持在与中浓度实验组活性相当的水平,表现为机体对于氧化胁迫的适应性。
乙酰胆碱酯酶(AchE)在神经系统的信息传导中起着关键作用,是生物体内一种极为重要的水解酶。国外有研究者以海洋无脊椎动物体内AchE活性为指标,评价并揭示环境污染程度[36]。Oliveira等[37]研究发现,鰕虎鱼(Pomatoschistusmicrops)体内的AchE在微塑料与芘复合作用下活性显著下降,表明微塑料与芘复合后会对鰕虎鱼产生生物毒性作用。本研究中,暴露于低浓度微塑料中的双齿围沙蚕体内的AchE活性出现了抑制现象,最大的抑制率达50%,表明微塑料对双齿围沙蚕神经系统存在胁迫作用。而与高毒性物质有机磷农药相比[32],在为期16 d的暴露实验中,不同浓度微塑料环境中双齿围沙蚕均未出现死亡现象,可能由于PP、PA本身无毒性,但PVC材质的微塑料颗粒能够释放含氯的有毒物质,从而对生物体产生毒性效应。目前微塑料的毒性效应多集中于对浮游生物、贝类和鱼类的生长、存活等方面的影响[34,38-40]。本研究发现PP和PA对沙蚕无显著毒性效应,但是对于酶活具有刺激效应。原因可能是暴露时间较短或者沙蚕长期生活于复杂的地质环境中对于微塑料本身具有较高的耐受性,因此,有必要在更高浓度中以及更长的暴露时间下进行试验。此外,也可能由于本研究使用的方法与检测的指标不够敏感,未能反映出微塑料对生物体的毒性效应。
本研究中,不同材质微塑料对双齿围沙蚕呼吸速率均有显著影响。Holloway等[41]认为生物机体通过提高自身呼吸速率从而获得额外能量以对抗外界污染环境的胁迫作用,这很好解释了本实验中暴露于微塑料中的双齿围沙蚕呼吸速率较对照组高。并且,微塑料的摄入显著增强双齿围沙蚕的物质能量代谢效率,实验组水体中的铵盐含量较对照组出现了高积累现象。Green等[28]发现将双齿围沙蚕暴露于微塑料后,其代谢效率明显增强,且不同材质的微塑料产生的影响程度亦不相同。但是,本研究实验结束后双齿围沙蚕体质量变化<0.02 g,这可能是由于暴露时间较短,养殖所用沙土中仍有大量有机质供双齿围沙蚕摄食,微塑料的存在并未对其短期生长产生明显抑制作用。此外,实验组双齿围沙蚕较对照组分泌粘液更多,且随微塑料浓度的升高而增多。该结果与暴露于重金属的沙蚕体表粘液分泌较多类似,是双齿围沙蚕对微塑料胁迫响应的一种生理适应机制[42]。
研究表明,微塑料因其粒径较小,易进入生物体内并在鳃、胃、肝脏和胰腺等不同器官积累,从而严重威胁机体正常生长发育和物质能量代谢[43]。随着微塑料在环境中丰度的日益升高,其可能造成的生物毒性效应和随食物链的传递和累积更应该值得关注。然而,目前所知微塑料对于生物的毒性机制仍然十分有限,需要开展更多的研究以应对微塑料污染可能对生态系统的功能性和稳定性造成的潜在危害。
本研究发现,随环境中微塑料浓度的提高,双齿围沙蚕体内CAT活性显著提升。摄入PVC的双齿围沙蚕体内AchE活性在低浓度(0.1%)时受到抑制,在高浓度(5%)下受到促进,而摄入PP和PA的双齿围沙蚕体内AchE酶活性在不同浓度下均表现为促进作用。随暴露时间的推移,双齿围沙蚕的排氨率发生显著变化,且随微塑料浓度的提高,呼吸速率也有显著提升。因此,微塑料在高浓度情况下,可以对双齿围沙蚕产生氧化胁迫作用,并一定程度上影响其排氨率和呼吸速率。但是,微塑料对沙蚕的毒性作用机制仍需进一步研究,在后期研究中有必要深入进行双齿尾沙蚕的组织、细胞和基因水平的试验。

