定量有害结局路径(qAOP)评估环境化学物质毒性的研究进展Ⅱ:类二噁英物质及AhR-qAOP
田明明,彭颖,2,*,张睿,张瀚心,张效伟,#
1. 污染控制与资源化研究国家重点实验室,南京大学环境学院,南京 210023 2. 流域环境生态工程研发中心,北京师范大学自然科学高等研究院,珠海 519087 3. 济南大学水利与环境学院,济南 250022 4. 生态环境部固体废物与化学品管理技术中心化学品部,北京 100029
二噁英及类二噁英物质(dioxin-like compounds, DLCs)通常具有高毒性,通过激活芳香烃受体(aryl hydrocarbon receptor, AhR),进而引起生物体的生殖发育毒性、免疫毒性、肝毒性及致癌等生物毒性[1-3]。环境中不断检出具有二噁英结构并存在潜在生物毒性的新型类二噁英物质,评估其生态与健康风险对化学品风险防控具有重要意义。传统的化学品毒性测试已不能满足当前化学品风险评估的需求,针对环境中大量具有明显类二噁英结构的新型污染物和未知污染物,其生态危害和风险具有很高的不确定性,缺乏系统的毒性评估,急需对现有的化学物质毒性评估方法和策略进行创新。
在对DLCs致毒机制的研究基础上,基于芳香烃受体(aryl hydrocarbon receptor, AhR)的有害结局路径(adverse outcome pathway, AOP)(AhR-AOP)的发展为准确评估潜在DLCs的生态与健康风险提供了新的策略,可指导预测新型类二噁英污染物的毒性及建立以生态物种保护为目标的环境基准[2]。但要实现该目的,首先要在发展成熟定性的AhR-AOP基础上进一步发展定量AOP。定量AOP(quantitative AOP, qAOP)可在化学品风险评估中提供从描述性知识到预测有害结局的桥梁,它是有一个或多个基于生物学的计算模型组成,通过计算模型描述分子启动事件(molecular initiative events, MIEs)、关键事件(key events, KEs)与有害结局(adverse outcomes, AOs)之间的关键事件的关联(key events relationships, KERs),并提供定量的剂量响应和时间信息,能为毒害污染物的健康和生态风险管控提供有效的决策依据[4]。构建的定量关系不仅包括分子水平,也包括个体、种群及以上水平。Perkins等[4]认为qAOP可用于解决2类主要问题:(1)理解和评估新的、未经测试的化学品对特定物种的风险;(2)了解和评估某一特定(组)化学物质对未经检验的新物种的风险。
本文在课题组前期研究的基础上,综述了AhR-AOP的最新研究进展,总结了DLCs及“AhR激活-胚胎毒性”定量AOP的最新进展,并探讨了AhR-qAOP发展过程中的问题与潜在解决方案,对其在DLCs生态危害与生态风险评价的应用进行了展望。
1 DLCs的生态危害与风险评估(Ecological hazards and risk assessment of DLCs)
DLCs的致毒机理主要通过激活AhR受体通路进行调控。正常情况下存在于细胞质中的AhR处于不活跃状态,当外源性配体如二噁英及DLCs进入细胞后,与AhR结合。接着进入细胞核,AhR从Hsp 90复合体上解离下来,再与AhR核转位因子(aryl hydrocarbon receptor nuclear translocator, ARNT)形成异质二聚体结构。而由于Hsp 90复合体的解离使得AhR的DNA结合位点暴露出来,此DNA结合位点可特异性地识别结合DNA上的二噁英响应元件(dioxin response element, DRE),从而AhR/ARNT异质二聚体结合在DRE上并启动下游靶基因的表达,如编码CYP1A1、醌还原酶的基因表达,由此诱导相应的生物毒性[5-6]。值得关注的是,AhR受体具有物种差异性,进而导致DLCs对生物体毒性效应的物种差异性。在无脊椎动物中并没有结合二噁英及DLCs的能力,但在脊椎动物中,二噁英及DLCs可以作为配体结合并激活AhR受体。人类和哺乳动物体内只有AhR1,而其他脊椎动物有多种其他AhR受体[7-8]。例如,鸟类具有AhR1、AhR1 beta和AhR2,但只有AhR1行使主要功能[9]。鱼类一般至少具有3种AhR受体,即AhR1、AhR2和AhR3,且由于进化过程中保守程度较低,鱼类每种AhR受体均包含多种亚型[10-11]。
二噁英及DLCs主要包括氯二苯并对二噁英(poly-o-chlorinated dibenzodioxin, PCDD)、多氯二苯并呋喃(polychlorinated dibenzofurans, PCDFs)、多氯联苯(polychlorinated biphenyls, PCBs)和多环芳烃(polycyclic aromatic hydrocarbons, PAHs)等持久性有机污染物。虽然从20世纪70年代开始,全球范围内开始禁止这些物质的生产和使用,但由于其环境持久性、亲脂性及高度的生物蓄积性,在环境介质中,尤其是沉积物中,二噁英及DLCs物质的污染仍较为严重。已有报道表明,全球PCDD/Fs和PCBs在沉积物中的检出浓度范围为0.1~300 pg TEQ·g-1(toxic equivalent, TEQ)[12-13]。尽管已有大量针对此类物质的研究,环境中是否存在其他类似生物毒性的污染物仍然是广受关注的问题。新型有机污染物的种类和数量每年不断增长,随着仪器检测技术的发展,环境中越来越多的化学物质被发现具有类似二噁英的结构,如多氯代二苯硫醚(polychlorinated diphenyl sulfides, PCDPSs)、甲氧基化多溴联苯醚(methoxylated polybrominated diphenyl ethers, MeO-PBDEs)、羟基化多溴联苯醚(hydroxylated polybrominated diphenyl ethers, OH-PBDEs)等新型污染物,可随食物链在生物体内富集,造成生态风险[14-16]。在全球水生环境中,PBDEs的检出浓度范围为0.01~69 300 ng·g-1干质量(沉积物),0.03~1 380 ng·g-1湿质量(鱼类),0.06~17.4 ng·L-1(水)[14]。已有研究发现PCDPSs、MeO-PBDEs和OH-PBDEs对大鼠、小鼠、鸟类和鱼类具有AhR活性,能在分子水平上激活AhR,被认为是潜在的DLCs[17-18]。Zhang等[17]发现这3类物质中的部分化学品对于鸟类表现出显著的物种敏感性差异。PCDPSs对鸡、环颈雉和日本鹌鹑的毒性效力均随着氯代水平的提高呈现上升趋势。部分PCDPSs和MeO-/OH-PBDEs的AhR活性的鸟类种间敏感性排序与典型二噁英的情况不同。
针对环境中大量具有明显类二噁英结构的新型污染物和未知污染物,其生态危害和风险具有很高的不确定性,对这类污染物开展毒性测试与生态风险评价具有重大研究意义。传统毒性评估方法和策略(动物实验)已经不能满足不断增加的未知毒性化学物质的风险评估,亟待对现有的化学物质毒性评估方法和策略进行创新。AOP基于化学品的性质,从系统生物学的角度概括了化学品从所诱导的分子水平反应,细胞、组织、器官的响应和毒性效应,进而到个体、种群上的有害结局之间的时间先后和因果逻辑关系。近10年来,AOP框架逐渐发展成熟,被认为是将生物信息组织成一种可用于人类健康和生态环境的化学品安全评估的强大方法,其开发的最终目的是用于化学品的评估和监管工作,从化学品的优先级评估到危害性预测,最终实现风险评估并应用于管理决策[4,19-20]。
2 基于AhR的定量有害结局路径研究进展(Research advance of quantitative adverse outcome pathway based on AhR)
随着对AhR分子毒理学机制和二噁英及DLCs的致毒模式的深入研究,逐渐形成了二噁英及DLCs通过激活AhR受体诱导生物毒性的AOP,可为预测新型类二噁英物质的毒性及建立以生物物种保护为目标的环境基准提供指导[2]。已有的AhR-AOP框架把二噁英及DLCs通过激活AhR受体介导下游分子事件和在细胞、组织、器官和个体乃至群体水平上的有害结局联系起来,即二噁英及DLCs首先激活AhR受体,这是这类AOPs的共同MIE,通过形成AhR/ARNT异源二聚体,诱导相关I相和II相代谢酶的表达,进而引起一系列分子级联响应,最终对器官和个体乃至整个种群产生毒害效应[2, 21]。定性AOP系统地构建了分子事件级联的知识,但不能实现准确的风险评估。因此仅仅有定性AOP是不够的,还需要发展定量AOP,在明确的毒性机制信息和已有的AhR-AOP的基础上,通过构建分子启动事件、关键事件与有害结局之间的定量关系,才能实现通过体外测试新型类二噁英物质与受体的结合效力,预测其对生物个体、种群和群落水平的有害结局,为建立以生物物种保护为目标的环境基准提供指导。
2.1 AhR-AOPs的发展现状及定量关联
近期,研究者达成共识,认为在短期内开发较多的qAOP是不合理的,未来qAOP的开发工作应该将目标聚焦在已经具有完整信息的定性AOP[22]。完整的qAOP模型从数学上描述了关键事件之间的联系,将MIE激活的剂量-反应与KERs的反应-反应动力学以及有害结局的表现联系起来。qAOP模型的原始结构(MIE、KE和KER等)可以基于科学证据从头构建,也可以从AOP数据库中的定性AOP中获得。目前在AOP wiki[23](https://aopwiki.org/)中展示的与AhR相关的有害结局通路共有7条,每条AOP的状态、MIE、KE和AO等信息汇总于表1中。AhR-AOP框架总结了二噁英及DLCs通过AhR介导的分子效应以及在细胞、器官、个体或种群水平上观察到的有害结局。7条AOP中已通过经济合作与发展组织(OECD)专家评审、开放引用与评论的有3条,可用于化学物质的筛选与生态风险评估,其AOP ID号分别为21、150和131。
(1)AOP 21,受AhR调控的环氧化酶-2(cyclooxygenase 2, COX-2)表达上调,导致心血管发育和功能的改变,从而导致心脏泵血效率降低、血流减少,最终导致心脏衰竭和死亡。用于构建该AOP的大部分生物学证据是使用COX-2的选择性激动剂和拮抗剂,利用斑马鱼(Daniorerio)的AhR、ARNT或COX-2靶向敲除进行的机制研究获得的。有重要证据表明,至少16种不同鱼类和8种不同鸟类在多氯联苯、平面多氯联苯和多环芳烃暴露下,其心血管发育和功能改变的发生率、严重程度及随后的死亡率的剂量响应是一致的[24],但是关于二噁英(TCDD)暴露与COX-2转录水平的剂量-反应关系的一致性尚不清楚。目前除了心血管发育和功能改变的共同表型外,没有可用的机制信息来推断跨物种的外推。
对于AOP21,AhR激活与早期死亡之间表现出较强的定量关系。PCDDs、PCDFs和平面PCBs与AhR结合亲和力之间的定量构效关系与这些物质的毒性效力之间有着很强的定量关系。具有更大结合亲和力的同源物一般具有更大的毒性效力。这在一定程度上促进了毒性当量因子方法在风险评估中的成功开发。不同物种的AhR受体与DLCs之间的结合亲和力具有显著差异,这决定了DLCs的物种敏感性差异。携带不同AhR受体的鸟类对于TCDD的物种敏感性差异高达40倍。另一方面,COX-2的上调表达与TCDD暴露导致青鳉心脏畸形发生率和严重程度之间具有定量关联。COX-2的表达和心脏面积之间有较强的线性关系(r2=0.88),但仍然缺乏多化学品和多物种的相关信息。
(2)AOP 150,通过AhR激活,与ARNT二聚间接抑制血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达,从而减少心肌细胞和内皮细胞的增殖,改变心血管形态学和减少心输出量,因此影响了正常血管的生成,最终导致充血性心力衰竭和早期生命死亡[25]。
对于AOP 150,每个关键事件之间的关联(KERs)的定量关系仍不清楚。但是,对于鸟类来说,AhR激活(MIE)和胚胎死亡(AO)之间有很强的相关性。鸟类AhR1配体结合域(ligand-binding domain, LBD)序列可用于预测DLCs诱导的胚胎致死率。LBD中2个关键位置的氨基酸(Ile324和Ser380)决定了DLCs的结合亲和力,进而决定了AhR激活的程度。
(3)AOP131描述了化学物质通过激活AhR受体导致的啮齿动物肝脏尿卟啉症。AhR的激活诱导了下游基因Ⅰ相代谢酶-细胞色素P450 1A2的表达,导致尿卟啉原的过度氧化,产生一种抑制剂尿卟啉原脱羧酶(uroporphyrinogen decarboxylase, UROD)阻止尿卟啉原转化为共混卟啉原,并在正反馈回路中增加UROD抑制剂的合成;导致尿卟啉原积累,进而导致其优先氧化以及高羧酸化卟啉(highly carboxylated porphyrins, HCPs)在各器官的积累(尿卟啉症)[26]。
AOP131的定量关系只适用于哺乳动物,不适用于其他物种。目前已有定量模型可以预测各种化合物的AhR活性,但产生卟啉症所需的AhR激活程度尚不清楚。在哺乳动物中,UROD活性至少要降低70%才能导致明显的尿卟啉症。此外,大量的体外测试方法已经开发出来,可以同时研究卟啉的积累和UROD的抑制,UROD抑制与卟啉的积累之间具有强关联性。
另外正在接受审查的2条AOP分别是AOP 41与AOP 57。AOP 41描述的是DLCs作为AhR配体与之绑定形成二聚体,持续的暴露(数周或数月)会导致AhR持续激活,导致啮齿动物肝脏肿瘤。AOP 57则描述了通过AhR激活,引起一系列基因表达发生变化,如CD36上调、PCK1下降、低密度脂蛋白受体(low density lipoprotein receptor, LDLR)上调导致的低密度脂蛋白增加等早期关键事件,进而导致了脂肪酸的累积,SCD-1表达上调导致肝脏中甘油三脂增加,然后引起脂肪酸、甘油三脂的增加与线粒体脂肪酸β氧化受到抑制等生物学变化,最终导致最后的危害结局,形成脂肪肝。但该AOP正在进一步开发过程中,可接受评价与建议。最新开发的2条目前只是处于提交后的状态,尚不接受引用与评价。AOP 310描述的是AhR的激活导致DNA甲基转移酶、促性腺激素释放激素受体(gonadotropin releasing hormone receptor, GnRHR)启动子区高甲基化等关键事件的变化,因此导致一系列表观遗传变化,最终导致繁殖受损如累积繁殖力和产卵量减少导致种群数量下降等有害结局;AOP 51是关于AhR信号传导和胎盘血管破裂之间的一系列事件。

表1 AOP Wiki中由AhR介导的有害结局通路(AOPs)汇总表Table 1 The adverse outcome pathways (AOPs) mediated by AhR in AOP Wiki
在上述AOP中,研究较多且毒性机制信息最丰富的是AOP 21、151和131,为后续qAOP模型开发提供基本信息与重要数据。
2.2 定量AhR-AOPs的研究进展
2.2.1 基于“AhR-胚胎毒性”定量AOP的开发
定量AOP的构建需要分子启动事件、关键事件和有害结局之间的定量响应数据对关键事件关系进行建模和参数化,且精确的KERs的模型开发需要详细的浓度-响应和响应-响应关系,以此建立数学统计模型。根据已有数据的可用性以及对KERs的了解程度,数学统计模型可以是简单的线性回归模型,也可以是一系列连续的非线性模型描述生物组织在不同水平的响应[27]。在上述3条受到广泛认可的AhR-AOPs中,胚胎死亡或生命早期阶段的死亡是最受关注的末端终点(或有害结局),对物种的种群健康发展至关重要,这也是生态风险评估中的研究重点。而且,3条AOPs的分子启动事件均为AhR激活(ID:18),与关键事件或有害结局之间具有较强相关性的KERs包括AhR激活与胚胎死亡、UROD活性水平与肝脏尿卟啉症的发生。在前期的研究中已在淡水、海洋硬骨鱼、非硬骨鱼以及鸟类中发现AhR激活与生命早期阶段死亡率之间存在直接或间接的关系[28-29]。另外,UROD的抑制与卟啉积累之间也存在定量关系,有研究证实在哺乳动物中UROD活性至少降低70%才能导致明显的尿卟啉积累[30],该定量关系只适用于哺乳动物,且定量模型仅限于UROD的活性与卟啉积累之间的关联[31],而分子启动事件与最终有害结局之间的定量关系还有待进一步研究。这些KERs内部之间的强相关性为后期qAOP的构建提供重要支撑。
在上述研究基础上,针对典型的二噁英及DLCs(TCDD、四氯二苯并呋喃(TCDF)和共面PCBs)以及AhR激活-胚胎毒性间的关联,Doering等[10, 27, 32]收集文献报道中这些物质在胚胎暴露实验和体外AhR活性测试中的浓度-响应数据,构建了用来描述AhR激活与间接导致鸟类和鱼类生命早期阶段死亡率的定量AOP。并根据已发表文献中DLCs暴露浓度和死亡率的实际剂量响应曲线,对生命早期阶段死亡率的预测响应值进行了验证,定量AOP的预测结果与实验结果的平均比值为2.2基于“AhR-胚胎毒性”定量AOP,实现了通过测试典型DLCs与受体的结合效力来预测鸟类或鱼类模式物种个体水平的有害结局的目的,但能够用于新型DLCs与非模式物种还需要进一步的研究。
2.2.2 AhR活性的体外测试方法
与此同时,可测量分子启动事件(AhR激活程度)的高通量检测方法也相应开发,如细胞色素P450亚酶CYP1A1(ethoxyresorufin-O-deethylase, EROD)诱导法和AhR受体报告基因法。高通量体外测试技术的发展为快速发现新型DLCs提供重要的技术支撑。
EROD检测的原理是基于DLCs与AhR结合活化后,经过下游分子信号传递,诱导EROD酶表达。通过测定EROD酶的活性,来了解受试化学品激活AhR的能力。因为EROD酶不能由肝细胞内源表达,故其酶活性与二噁英的暴露量存在定量关系[33]。
受体报告基因法是近年来根据AhR受体激活机制发展起来的体外细胞测试法,其原理是利用基因重组技术,从体外把合成的报告基因(哺乳动物细胞色素P450基因和萤火虫荧光酶)重组到真核细胞内。受体报告基因法可包括不同来源的AhR受体,如在大鼠肝癌细胞(H4IIE-luc)稳定转染报告基因的H4IIE-luc细胞受体报告基因法、在COS-7细胞瞬时转染AhR质粒的鸟类AhR-荧光素酶报告基因法(luciferase reporter gene, LRG)和鱼类AhR2-LRG法,其中,鸟类AhR-LRG法的技术原理和检测流程如图1所示。在非洲绿猴肾成纤维细胞(COS-7细胞)中瞬时转染鸟类AhR1、鸬鹚ARNT、鸬鹚CYP1A5报告基因质粒和Renilla荧光素酶报告基因质粒[9, 33]。转染完成后,COS-7细胞可以表达相应的AhR1受体和ARNT。当对细胞进行DLCs暴露时,DLCs与细胞质内的AhR受体结合,并转移至细胞核内,AhR与ARNT形成异源二聚体,与荧光素酶报告基因上的二噁英响应元件(DRE)结合,启动荧光素酶基因的表达,荧光素酶的表达量与AhR激活的程度正相关[33-34]。加入荧光素底物后,荧光素酶可以催化底物反应,产生化学发光。使用微孔板酶标仪可检测其发光强度,进而实现对具有AhR活性的DLCs物质的高通量体外测试。
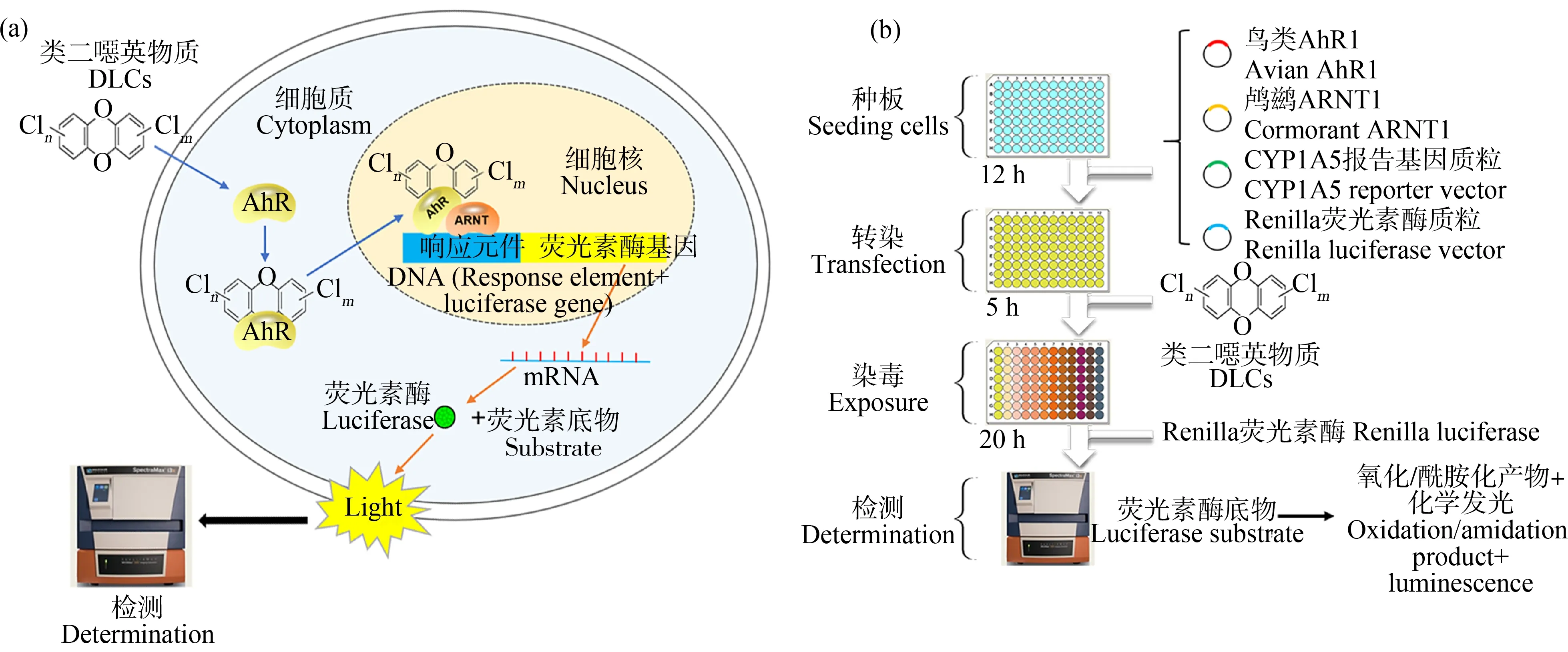
图1 鸟类AhR1-荧光素酶报告基因法(AhR1-LRG)检测类二噁英(DLCs)物质芳香烃受体(AhR) 活性的技术原理(a)和流程(b)注:ARNT表示AhR核转位因子。Fig. 1 The mechanism (a) and workflow (b) of potency test of arly hydrocarbon receptor (AhR) activation of dioxin-like compounds (DLCs) using avian AhR1-luciferase reporter gene (AhR1-LRG) Note: ARNT stands for aryl hydrocarbon receptor nuclear translocator.
与EROD法相比,受体报告基因法具有以下优势:(1)更直接地检测DLCs物质对AhR的激活效应,因为报告基因法使用外源表达的AhR受体或者CYP1A报告基因,其检测的指标来源的分子效应比诱导EROD表达更早出现[33]。因此,报告基因法灵敏度更高,检测限更低。(2)因为EROD法需要使用鸟类肝脏原代细胞,而报告基因法使用细胞系进行检测,因此,报告基因法检测周期更短,更适合高通量的化学品筛查。(3)因为LRG基于外源表达的AhR受体,因此可以预测不同物种的敏感性差异,为制定保护敏感物种的DLCs的生态安全阈值提供方法。近几年,LRG法在环境介质如飞灰、沉积物和油砂污染区等的危害评估中已得到广泛应用,为AhR激活-胚胎致死qAOP应用于未来真实环境的化学物质危害识别与筛查提供技术基础。魏凤华等[35]采用鸟类AhR-LRG和大鼠H4IIE报告基因法评估了垃圾焚烧飞灰样品有机提取物的类二噁英生物活性,垃圾焚烧飞灰样品的有机提取物能诱导显著的类二噁英活性,研究表明,利用化学检测仪器对17种DLCs进行的暴露分析不能全面反映环境介质中有毒有害化学物质的类二噁英毒性情况;而鸟类AhR-LRG法不仅能反映样品的总类二噁英活性,还可通过多种物种实现对样品较全面的生态风险评估。夏洁[36]使用大鼠H4IIE-luc报告基因法检测了长江和太湖水样、沉积物和生物样品提取物的AhR活性,并且结合化学分析方法,推断出沉积物中PCDDs的AhR活性贡献率达到50%。Mundy等[37]将鸟类原代肝细胞暴露于油砂污染区环境样品中,通过测定EROD酶活性和Cyp1A4 mRNA的表达来评估AhR活性,发现环境样品中的多环芳烃提取物能够显著诱导AhR活性增强,且可以根据体外测试结果对不同采样位点的环境样品的AhR活性进行排序。
研究者利用鸟类AhR1-LRG法开展了针对典型的DLCs(TCDD、TCDF、五氯二苯并对二噁英(PeCDF)和PCBs)和新型DLCs(OH-PBDEs)的相关研究,发现这些DLCs激活AhR的效应浓度(PC20和EC50)与鸡胚胎早期生命阶段致死LD50间具有强相关性(r2>0.84,P<0.01)[27, 38-39](图2)。以上结果说明了AhR-LRG体外检测方法在预测DLCs毒害效应的有效性,为构建以生物个体发育早期阶段死亡为有害结局终点的AhR-qAOP提供了可靠的体外检测方法。
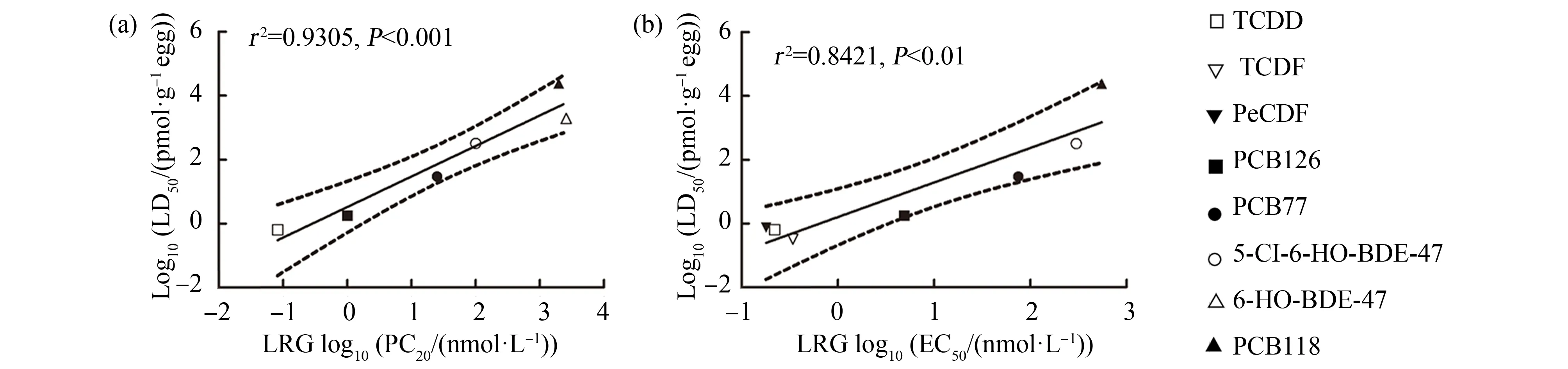
图2 AhR活性与野生型鸡胚胎致死LD50的线性回归分析注:EC50表示引起50%最大效应的浓度,PC20表示引起20%的阳性对照效应的浓度,LD50表示半数致死浓度;TCDD表示二噁英, TCDF表示四氯二苯并呋喃,PeCDF表示五氯二苯并对二噁英,PCB表示多氯联苯,5-Cl-6-HO-BDE-47表示5-氯-6-羟基-溴代联 苯醚-47,6-HO-BDE-47表示6-羟基-溴代联苯醚-47;PC20和EC50值来自LRG法测定的浓度-响应曲线。Fig. 2 The linear relationship between AhR activity and LD50 of wide-type chicken embryoNote: EC50 means the concentration for 50% of maximal effect; PC20 means the concentration for 20% of positive control effect; LD50 means median lethal dose; TCDD means dioxin; TCDF means tetrachlorodibenzofuran; PeCDF means pentachlorodibenzo p-dioxin; PCB means polychlorinated biphenyls; 5-Cl-6-HO-BDE-47 means 5-chloro-6-hydroxy-bromodiphenyl ether -47; 6-HO-BDE-47 means 6-hydroxy-bromodiphenyl ethers -47; the value of PC20 and EC50 were retrieved from dose-response curves of LRG tests.
2.2.3 基于“AhR-胚胎毒性”定量AOP对DLCs的风险评估
现有AhR-qAOP在对单一化学品暴露导致早期胚胎死亡的预测研究中,涵盖了典型的DLCs(TCDD、PeCDF、TCDF和共面PCBs)和一些新型DLCs(PBDEs、PCDPSs)。其中,低于四氯取代的PCDD/Fs和PCBs均不会激活AhR,PCDPSs诱导AhR活性的规律与PCDD/Fs和PCBs相似。此外,目前已发现羟基和甲氧基取代的PBDEs表现出显著的AhR活性,且5-C1-6-HO-BDE-47的相对毒性效力(relative potency, ReP)最大,与八氯代二苯并二噁英(OCDD)和八氯代二苯并呋喃(OCDF)的毒性当量因子(toxic equivalency factor, TEF)相当;并且发现羟基官能团和甲氧基官能团相比,可以诱导更大的AhR活性[15, 17, 36]。
Doering等[38]和Manning等[39-40]发现典型DLCs的鸟类AhR1/鱼类AhR2-LRG活性效应值与早期胚胎致死剂量之间具有强相关性。Manning等[39-40]在COS-7细胞中转染了鸡、环颈雉和日本鹌鹑AhR1质粒,通过检测TCDD、PeCDF、PCBs 126, 77, 105和118的LRG响应,发现在AhR1 LBD区域的氨基酸残基324和380是决定不同鸟类对PCBs敏感性差异的因素。此外,AhR1-LRG响应(EC50、ECthreshold和PC20)与文献报道的PCBs对9种鸟类早期胚胎死亡的毒性数据(LD50)显著相关(r2≥0.87,P<0.0001)[39-40]。
近几年,本课题组针对前期研究中筛选出来的高AhR活性的新型DLCs,基于AhR激活-胚胎致死的qAOP模型对其开展危害预测研究。利用体外高通量测试-鸟类AhR1-LRG法得到测试物质的AhR活性效应值,根据qAOP模型预测6-HO-BDE-47[41]、5-Cl-6-HO-BDE(未发表数据)等高活性物质的胚胎致死效应,并通过胚胎注射测试验证了新型DLCs对鸟类胚胎的致死毒性,与转录水平上的分子响应如CYP1A4的表达上调,具有显著的剂量效应关系。以上这些研究结果拓展了利用AhR激活-胚胎致死的qAOP模型在新型毒害污染物的毒性评估方面的应用,从大量毒性未知的环境污染物中筛选出有毒物质,为PBDEs、PCDPSs等新型污染物的生态风险管理与控制提供了方法和数据支持。
2.2.4 基于“AhR-胚胎毒性”定量AOP对不同物种的适用性研究
不同物种的AhR受体对AhR受体激动剂的敏感性和效力有很大差异,以鸟类为例,其AhR配体结合域被分为低、中、高敏感性,分别为AhR 1(Ile324_Ser380)、AhR 2(Ile324_Ala380)和AhR 3(Val324_Ala380),其代表物种分别为鸡、环形雉和日本鹌鹑[39, 42-43],具有对DLCs亲和力较高的AhRs的鸟类比具有对DLCs亲和力较低AhRs的鸟类具有更高的敏感性[44]。AhR在鸟类、鱼类的不同物种间的结合亲和力的差异和早期生命阶段死亡率对DLCs的敏感性差异也存在定量关系[27, 39, 42-44],如TCDD对鸡或者其他鸟类的毒性至少相差一个数量级,TCDD对湖红点鲑和斑马鱼早期生命阶段的致死毒性效应相差40倍[45]。因此,在利用AhR激活导致生物早期死亡的qAOP模型时需要考虑物种间差异性的定量关系[32]。
导致AhR活性物种敏感性差异的原因,目前主要认为是不同AhR亚型的蛋白序列和构象差异使得同样的DLCs与AhR受体结合能力不同,进而产生不同程度的下游分子事件[42-44, 46]。对于鸟类来说,AhR1的配体LBD区域的氨基酸序列差异是引起二噁英及DLCs效应产生鸟类种间敏感性差异的原因。研究发现,氨基酸位点Ile324和Ser380能够影响86种鸟的AhR1受体对DLCs的敏感性[39, 42-43]。对于哺乳动物,研究人员发现人类的AhR受体LBD区的苯丙氨酸318(Phe318)位点和缬氨酸381(Val381)位点在对TCDD的敏感性差异上起着关键作用[47-49]。相较于人类和鸟类,鱼类的情况较为复杂,目前还没有针对鱼类物种敏感性的机制解释。一般来说,鱼至少有3种AhR受体(AhR1、AhR2和AhR3),并且每个AhR均包括多个亚型。鱼类AhR受体在进化上的保守性较低,这也导致了鱼类较大的物种敏感性差异[50]。Zhang等[51]提出了PCDPSs会通过激活斑马鱼AhR2导致其致死毒性的假设。该研究通过体外测试-鱼类AhR2-LRG法、野生型和CYP1A转基因型斑马鱼胚胎暴露实验验证了PCDPSs诱导的致死效应是通过激活斑马鱼AhR2的表达导致的,并结合分子动力学模拟提供了几种PCDPSs在原子水平上激活AhR2的差异机制信息。综合来说,以上因素均会导致同样的DLCs与不同物种的AhR受体亲和力不同,导致分子启动事件的激活程度的差异,进而产生下游关键事件和最终有害结局的差异。因此,物种敏感性差异是AhR-qAOP后续发展及应用中一个亟待解决的重要问题。魏凤华等[2]总结了DLCs在不同物种间存在显著的敏感性差异,建议加强对我国本土物种的研究,获取本土物种的DLCs毒性数据以支持风险评价与基准研究,并进一步开展新型DLCs的毒性筛查工作等。
为了研究AhR-qAOP在不同物种间适用性,在AhR激活导致鸟类生命早期阶段死亡的qAOP的基础上,研究了TCDD对其他脊椎动物如9种鱼类的AhR受体敏感性差异[27, 52]。研究者在COS-7细胞中分别转染了鸟类AhR1和鱼类AhR2质粒,通过分析TCDD、TCDF、PeCDF和PCBs 126, 77的LRG响应和对应DLCs导致鸟类或鱼类早期胚胎死亡的数据,发现显著的线性相关仅存在于鱼类AHR2/鸟类AHR1-LRG活性效应值(EC50)与导致早期胚胎死亡的DLCs剂量(LD0、LD10、LD50和LD100),而不存在于鱼类AhR1[27, 32]。此外,研究者通过修正AhR-qAOP模型,将TCDD、PCBs 126, 77, 105的LRG效应浓度(ECthreshold)作为输入值,预测对应DLCs导致早期胚胎死亡的DLCs剂量(LD0、LD10、LD50和LD100),获得了较好的线性相关性(r2≥0.92,P<0.0001)。该研究发现AhR-qAOP可适用于不同生态物种,甚至拓展至10 000种鸟类和34 000种鱼类[38]。但是除PCDDs、PCDFs和共面PCBs之外,目前还没有研究表明这种跨物种qAOP是否适用于其他的AhR激动剂[27, 38]。
3 总结与展望(Conclusion and perspectives)
3.1 当前AhR-qAOP的不足
尽管AhR-AOP已经获得了较多的关注,促进了从机制上理解AhR在跨化学物质、跨物种和跨类群方面的危害,但是与其他大部分AOP一样,对MIE与KE、AO之间的关联、下游的关键事件仍然缺乏足够的了解。然而AhR的激活能够导致多重响应,包括与多个潜在靶基因如CYP1A、Sox9b和HIF1a/VEGF的相互作用,这些AOPs可能与COX-2的表达增加同时发生,导致心血管发育和功能改变和导致早期生命阶段死亡[53]。AOP 150是在AOP 21的基础上开发出来,AhR激活后通过HIF1a/VEGF信号通路最终导致早期生命阶段死亡[54]。因此,阐明AhR激活与早期生命阶段死亡率之间的一系列关键事件是一个挑战。此外,目前对已有KERs的定量关系理解在很大程度上只局限于AhR激活和早期生命阶段死亡率之间的间接关系,这限制了其在化学品风险管控中的应用范围。
此外,由于生物体内AhR受体的变异和多样性,二噁英及DLCs在不同的物种间存在显著的敏感性差异。这同样给AhR-qAOP的应用提出了挑战。尤其是对于野生鱼类,鱼类往往同时具有3种AhR受体,且每种具有不同亚型。目前,AhR受体已经被识别定型的鱼类只占所有鱼类的极少部分,大部分鱼类体内的AhR亚型情况尚不清楚[55]。因此,对野生物种的AhR受体的识别与定型是决定AhR-qAOP应用有效性的基础。
本文综述了AhR-胚胎毒性qAOP在预测典型DLCs和新型DLCs(PBDEs和PCDPSs)对鸟类和鱼类毒害效应的应用。但环境中仍有大量未知毒性化学污染物以及混合污染物。这些未知毒性污染物的AhR活性以及对生态物种的胚胎毒性很可能具有显著差异,因此AhR-qAOP的计算模型需要不断修正,以满足不同AhR活性的污染物的检测要求。
3.2 基于AhR-qAOP的DLCs生态风险研究展望
为识别DLCs的危害并评价其生态风险,进一步构建与完善AhR-胚胎毒性qAOP,后续可重点关注以下几方面:
(1)目前构建的qAOP已经适合于在TCDD、TCDF和PCBs等典型的DLCs,其对大量新型的和潜在未知的DLCs的适用性尚不可知,建议开展对其他新型类二噁英化学物质的研究,验证该qAOP的化学适用性。
(2)继续开发与完善qAOP,尤其是构建下游KE与AO间的定量关系,提高预测信心与能力,能在更高阶的实际管理工作中得到应用。使用AOP进行危害识别和风险评估需要评估预测模型在AOP中的每个关键事件和关键事件关系上的性能。一般来说,关键事件越往有害结局的下游发展,利用相关关键事件的定量关系来预测有害结局的可信度就越强。生物个体与种群水平及以上的危害是化学物质监管和决策的最终目标,同时考虑结合合适的种群模型,通过对个体生存和繁殖的影响去评估对种群动态和结构的影响,将AO拓展至种群及以上水平上的危害。
(3)开展该qAOP对不同物种的适用性研究,将其应用拓展至敏感物种、本土物种和濒危物种等管理上关心的目标物种,进而确定敏感物种以及制定保护本地敏感物种的环境安全阈值(图3)[52, 56]。已知鸟类和鱼类之间AhR的目标氨基酸的差异导致与DLCs结合亲和力的不同,由此造成AhR激活(MIE)的剂量-效应关系物种差异。通过修改qAOP模型中AhR激活的剂量-反应参数,可以推断该模型在不同物种的适用性,从而解释物种对DLCs的敏感性[10]。物种间蛋白质序列的保守性可以用来推断物种之间的亲和力如何不同,或者感兴趣的物种与模型物种之间的敏感性如何不同[57]。有研究者利用序列比对等方法分析几个或多个物种之间的目标基因和蛋白质的相似性,从而预测物种之间的易感性(sequence alignment to predict across species susceptibility, SeqAPass)[58],只需要提供所选目标物种的MIE和KERs的物种特异性信息,利用qAOP模型就能得到感兴趣的化学物质的物种敏感性分布,支撑毒害化学物质的生态毒性基准与标准的制定研究。

图3 利用AhR-qAOP对DLCs进行鸟类胚胎毒性评估以提供风险管控依据Fig. 3 Avian embryo toxicity of DLCs was assessed using AhR-qAOP to provide evidence of risk management
(4)针对一些低AhR活性的新型DLCs和未知毒性的化学品,可以比较不同的活性效应浓度(PC20、EC50、EC20或ECthreshold等)作为计算模型输入值的计算结果,以获取优化的线性相关性。Zhang等[59]在检测PBDEs的AhR活性时,使用PC20作为输入值,PC20为产生TCDD的最大LRG响应的20%时对应的DLCs的浓度,以此来计算低AhR活性的DLCs的相对效力。Doering等[38]在构建针对鸟类和鱼类AhR-胚胎毒性qAOP过程中,对计算模型进行修正,采用ECthreshold代替EC50,对具有低AhR活性的PCBs的毒害效应进行预测,发现采用ECthreshold作为输入值,可以获得较好的线性相关性。
(5)在上述研究基础上,考虑构建基于AhR激活的AOP网络,将AO从个体水平上拓展至种群及以上水平,进一步探究其对DLCs混合物、环境中DLCs混合物等暴露危害的预测能力,促进其最终应用于DLCs的风险管控工作。已有研究提出AhR-AOP可为风险评估提供有用信息,如环境中可结合AhR的TCDD结构类似物一般以混合存在,可用混合物浓度加和的方式对这类混合的复合毒性进行评估[60]。Wei等[61]利用基于鸟类AhR的荧光报告基因法测试TCDD、2,3,7,8-TCDF和2,3,4,7,8-PeCDF这3种典型DLCs两两混合后的AhR活性,发现混合物诱导的鸟类AhR活性效力的联合效应是加和作用,进一步说明了利用该报告基因法在混合暴露危害评估中的应用潜力。但是否可利用该AhR活性结果去预测混合物暴露的胚胎致死效应尚不可知。因此未来可进一步研究该qAOP和AOP网络在多种DLCs混合物、环境中DLCs混合物暴露中的应用。
(6)可参考Patlewicz等[62]提出的支持AOP管控的科学框架,探索利用现有的AhR相关的qAOP分层级地支持对DLCs风险管控工作中不同层次的应用。例如利用该qAOP进行化学品初级阶段的毒性筛查与优先评估,累积数据的同时优化该qAOP;将qAOP的数学模型输出的结果与实验数据集(如人类临床数据集、合适的生态物种)进行基准测试,为未来AOP的实际应用提供科学依据和经验。

