不同发病状态的溃疡性结肠炎患者血清炎症因子和免疫球蛋白变化及与肠道菌群变化的相关性*
高磊,张英剑,刘晓敏,曹蕾,王瑞芳,薛娟
河南科技大学第一附属医院 1消化内科,2内镜中心,3检验科(河南洛阳471000)
溃疡性结肠炎(ulcerative colitis,UC)是由肠道微生态改变、免疫调节异常、炎症反应等多种因素诱发的慢性炎症性肠道疾病,临床表现为腹痛、腹泻、便血等症状,病灶多位于大肠,可累及直肠及远端结肠,并呈连续弥漫性分布,病情反复发作、迁延难愈,严重影响患者的身心健康[1-2]。人体肠道内存在种类繁多、数量巨大的细菌群体,在正确情况下参与肠道内分解、代谢,维持肠道内免疫系统的稳定[3]。研究表明,人体肠道菌群发生失衡,肠道细菌出现移位,进入人体微循环,诱发全身炎性反应和自身免疫异常,造成级联性免疫反应细胞凋亡,致使炎症持续反复发作,恶化病情[4]。经大量研究证实,机体免疫系统失衡、肠道菌群紊乱及细胞炎性反应是诱发UC的关键病理过程,也是UC反复发作、甚至炎癌转化的重要机制[5-7]。徐宝琪等[7]研究表明,UC患者不同病情阶段,其机体炎症反应、免疫球蛋白水平及与肠道菌群数量也不尽相同。本研究通过检测不同发病状态UC患者的血清炎症因子、免疫球蛋白及肠道菌群变化,进一步分析其相关性,为UC的临床治疗提供参考,现报告如下。
1 资料与方法
1.1 一般资料 选择2019年6月至2020年5月我院收治的UC患者90例作为研究对象。诊断标准:参照《炎症性肠病诊断与治疗的共识意见(2018年)》进行诊断[8];(1)有腹痛、腹泻及黏液脓血便,呈持续、反复发作状态;(2)结肠镜下见黏膜血管纹理模糊或紊乱、充血、水肿,有脓性分泌物附着,病变处见明显多发性溃疡或弥漫性糜烂。纳入标准:(1)均经病史、临床症状、电子肠镜及病理组织学确诊,符合《炎症性肠病诊断与治疗的共识意见(2018年)》中UC的诊断标准;(2)病程>4周;(3)近1个月未接受激素、益生菌、抗菌药物及免疫抑制剂等药物治疗;(4)年龄18~80岁;(5)临床诊疗资料完整。排除标准:(1)伴自身免疫性疾病者;(2)伴血液系统疾病者;(3)伴慢性肝肾疾病者;(4)伴严重心、脑、肺疾病者;(5)伴有克罗恩病等其他肠道疾病者;(6)伴有细菌型痢疾、肠结核等感染性结肠炎者;(7)存在精神疾病或意识障碍者;(8)入组前1个月有益生元、膳食纤维等摄入史者;(9)存在肠癌家族史者;(10)妊娠期、哺乳期妇女;(11)中途退出研究者。根据患者不同发病状态,将其分为急性组(n=30)、慢性复发组(n=30)、慢性持续组(n=30),另取同时间段内健康体检者30例为对照组。各组一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。本研究符合《赫尔辛基宣言》原则,且已经我院医院伦理委员会审批同意,患者或其家属均已签署知情同意书。
表1 各组一般资料比较 ±s

表1 各组一般资料比较 ±s
项目 例数 性别(例)男 女 年龄(岁) 病程(年)急性组30 17 13 42.34±8.49 2.43±0.61慢性复发组 30 16 14 43.48±7.20 2.47±0.55慢性持续组 30 15 15 42.95±9.11 2.49±0.59对照组 30 16 14 42.88±10.42 F/χ2值 0.628 1.432 0.851 P值0.311 0.076 0.127
1.2 方法
1.2.1 样本采集与预处理 采集各组受试者的清晨空腹状态下的肘静脉血8 mL置于10 mL EP管中,静置30 min,经TDZ4-WS自动脱帽离心机(长沙维尔康湘鹰离心机有限公司)离心15 min,离心半径为11 cm,速度为3 000 r/min,分离上层血清置于5 mL EP管中,置于-70℃冰箱中保持待检。采集各组受试者的新鲜粪便标本1.5 g置于试剂瓶中,加入4.5 mL稀释液稀释,经MX-S型旋涡混匀仪(美国scilogex公司)在3 000 r/min速度下震荡1 min,稀释10倍后平均置于不同试剂瓶中,取10μL接种于培养基中置于30℃环境下保存待检,培养基购自上海中信国建药业股份有限公司。
1.2.2 血清炎症因子检测 采用酶连免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测各组受试者的炎症因子基质金属蛋白酶-1(matrix metalloproteinase 1,MMP-1)、转化生长因子β(transforming growth factor beta,TGF-β)、高迁移率族蛋白B1(high mobility group protein B1,HMGB1)、β干扰素(interferon-β,IFN-β)、可溶性白细胞介素-2受体(soluble interleukin-2 receptor,sIL-2R)水平,采用美国Molecular Devices Flexstation 3酶标仪(美国RD公司),ELISA试剂盒均购自上海森雄生物技术公司,检测步骤严格按照试剂盒说明书进行。
1.2.3 血清免疫球蛋白检测 采用免疫比浊法检测各组血清免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白M(immunoglobulin M,IgM)水平,所用仪器为Array 360 System血清免疫球蛋白分析仪(美国贝克曼库尔特有限公司),使用仪器配套试剂盒,检测步骤严格按照试剂盒说明书进行。
1.2.4 肠道菌群检测 培养2~3 d后,由检验科专业人员初筛后采用VITEK-2 Compact型全自动细菌鉴定仪对双歧杆菌、乳杆菌、肠杆菌、肠球菌给予活菌计数。
1.3 统计学方法 采用SPSS 25.0统计软件,计数资料以例(%)表示,采用χ2检验或Fisher精确检验;血清MMP-1、TGF-β、HMGB1等计量资料以±s表示,经正态性检验与方差齐性检验后正态分布且方差齐性的计量资料,两组间比较行重复测量方差分析,多组比较行单因素方差分析,采用Pearson检验分析患者血清炎症因子与免疫球蛋白与肠道菌群的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 不同发病状态UC患者与对照组血清炎症因子水平比较 UC患者血清MMP-1、TGF-β、HMGB1、sIL-2R水平均明显高于对照组,IFN-β水平明显低于对照组;急性组患者血清MMP-1、TGF-β、HMGB1、sIL-2R水平均明显高于慢性复发组、慢性持续组,IFN-β水平明显低于慢性复发组、慢性持续组;慢性复发组患者血清MMP-1、TGF-β、HMGB1、sIL-2R水平均明显高于慢性持续组,IFN-β水平明显低于慢性持续组(P<0.05)。见表2。
表2 不同发病状态UC患者与对照组血清炎症因子水平比较 ±s
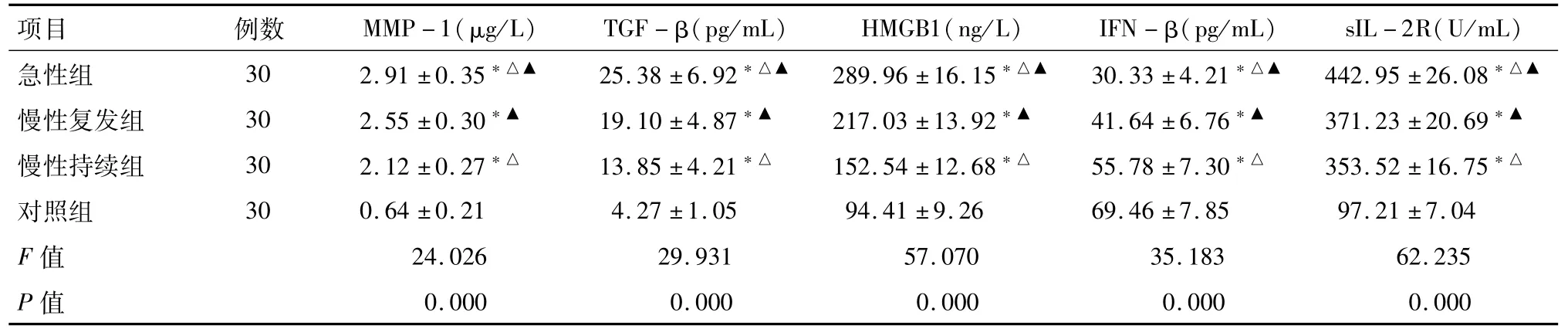
表2 不同发病状态UC患者与对照组血清炎症因子水平比较 ±s
注:*与对照组比较P<0.05;△与慢性复发组比较P<0.05;▲与慢性持续组比较P<0.05
项目 例数 MMP-1(μg/L) TGF-β(pg/mL) HMGB1(ng/L) IFN-β(pg/mL) sIL-2R(U/mL)急性组 30 2.91±0.35*△▲ 25.38±6.92*△▲ 289.96±16.15*△▲ 30.33±4.21*△▲ 442.95±26.08*△▲慢性复发组 30 2.55±0.30*▲ 19.10±4.87*▲ 217.03±13.92*▲ 41.64±6.76*▲ 371.23±20.69*▲慢性持续组 30 2.12±0.27*△ 13.85±4.21*△ 152.54±12.68*△ 55.78±7.30*△ 353.52±16.75*△对照组 30 0.64±0.21 4.27±1.05 94.41±9.26 69.46±7.85 97.21±7.04 F值 24.026 29.931 57.070 35.183 62.235 P值0.000 0.000 0.000 0.000 0.000
2.2 不同发病状态UC患者与对照组血清免疫球蛋白水平比较 UC患者血清IgA、IgM水平均明显低于对照组,急性组患者血清IgA、IgM水平均明显低于慢性复发组、慢性持续组,慢性复发组患者血清IgA、IgM水平均明显低于慢性持续组(P<0.05)。见表3。
表3 不同发病状态UC患者与对照组血清免疫球蛋白水平比较 (±s)g/L

表3 不同发病状态UC患者与对照组血清免疫球蛋白水平比较 (±s)g/L
注:*与对照组比较P<0.05;△与慢性复发组比较P<0.05;▲与慢性持续组比较P<0.05
项目 例数IgA IgM IgG急性组 30 2.01±0.17*△▲ 0.69±0.09*△▲ 12.66±0.64*△▲慢性复发组 30 2.23±0.21*▲ 0.84±0.11*▲ 12.61±0.72*▲慢性持续组 30 2.45±0.24*△ 0.98±0.13*△ 12.63±0.67*△对照组 30 2.57±0.16 1.48±0.15 13.13±0.93 F值 11.984 29.241 0.427 P值0.000 0.000 0.551
2.3 不同发病状态UC患者与对照组肠道菌群比较 UC患者双歧杆菌株数、乳杆菌株数明显低于对照组,肠杆菌株数、肠球菌株数明显高于对照组;急性组双歧杆菌株数、乳杆菌株数明显低于慢性复发组、慢性持续组,肠杆菌株数、肠球菌株数明显高于慢性复发组、慢性持续组;慢性复发组双歧杆菌株数、乳杆菌株数明显低于慢性持续组,肠杆菌株数、肠球菌株数明显高于慢性持续组(P<0.05)。见表4。
表4 不同发病状态UC患者与对照组肠道菌群比较 (±s)CFU/g
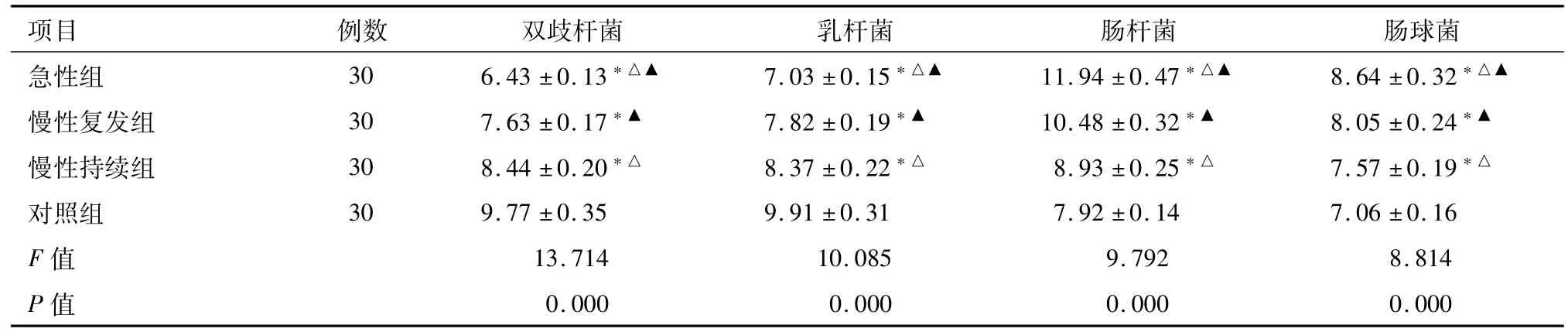
表4 不同发病状态UC患者与对照组肠道菌群比较 (±s)CFU/g
注:*与对照组比较P<0.05;△与慢性复发组比较P<0.05;▲与慢性持续组比较P<0.05
项目 例数 双歧杆菌 乳杆菌 肠杆菌 肠球菌急性组 30 6.43±0.13*△▲ 7.03±0.15*△▲ 11.94±0.47*△▲ 8.64±0.32*△▲慢性复发组 30 7.63±0.17*▲ 7.82±0.19*▲ 10.48±0.32*▲ 8.05±0.24*▲慢性持续组 30 8.44±0.20*△ 8.37±0.22*△ 8.93±0.25*△ 7.57±0.19*△对照组 30 9.77±0.35 9.91±0.31 7.92±0.14 7.06±0.16 F值 13.714 10.085 9.792 8.814 P值0.000 0.000 0.000 0.000
2.4 UC患者血清炎症因子与免疫球蛋白与肠道菌群的相关性分析 Pearson相关性分析结果显示:UC患者肠杆菌株数、肠球菌株数与血清MMP-1、TGF-β、HMGB1、sIL-2R 水平呈负相关(P<0.05),与血清IFN-β水平呈正相关(P<0.05);血清IgA、IgM水平及双歧杆菌株数、乳杆菌株数与血清MMP-1、TGF-β、HMGB1、sIL-2R水平呈正相关(P<0.05),与血清IFN-β水平呈负相关(P<0.05)。见表5。
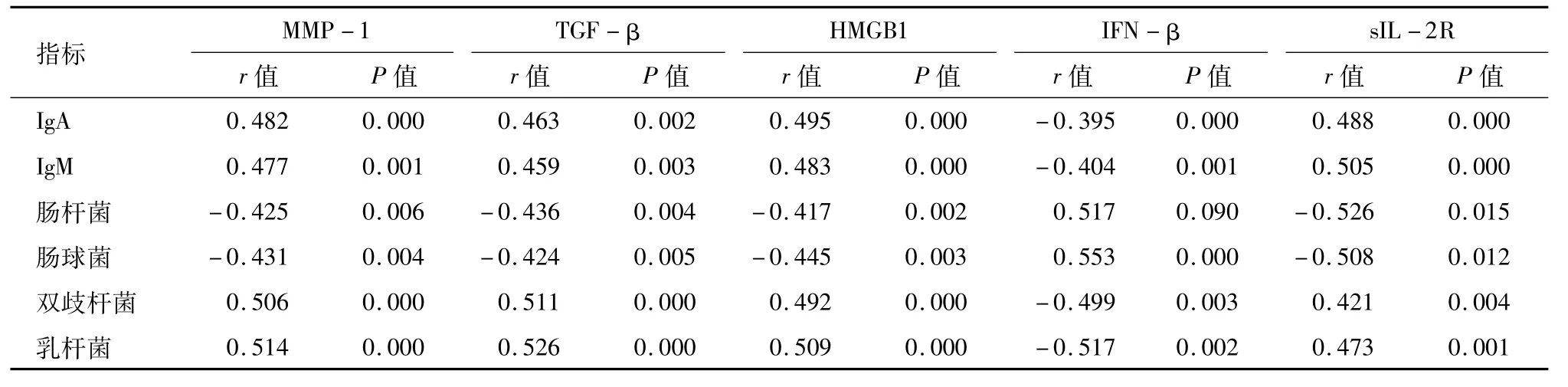
表5 UC患者血清炎症因子与免疫球蛋白与肠道菌群的相关性分析
3 讨论
UC是由肠道细菌激活所形成的异常免疫反应,造成细胞炎性反应增强,当炎性反应过度超过机体组织耐受度,会对靶器官造成损伤,导致功能障碍,进而发生结肠炎性变化[9]。正常情况下人体肠道内存在大量不同肿瘤的细菌,主要集中在结肠和小肠末端,主要包括人体共生菌、机会致病菌、病原菌3种[10]。肠杆菌、肠球菌属于机会致病菌,也被称为非优势菌群,通常情况下人体肠道内含量较少,当机体免疫功能下降时便会大量繁殖[11]。双歧杆菌、乳杆菌属于人体共生细菌,又被称为肠道优势菌群,具有调节免疫功能、分解、代谢等作用,能够对抗机会致病菌对人体肠黏膜的侵入[12]。正常情况下人体肠道内肠道菌群按照一定的比例共存并形成肠道生态平衡,当肠道菌群失调,会导致机体出现异常免疫反应,使得机会致病菌大量繁殖并不断增强侵袭力,破坏肠道黏膜屏障,引起机体肠黏膜反应[13]。本研究结果显示,UC患者双歧杆菌株数、乳杆菌株数明显低于对照组,肠杆菌株数、肠球菌株数明显高于对照组(P<0.05)。提示,与健康人群相比,UC患者有严重肠道菌群失调,具体表现为机会致病菌肠杆菌和肠球菌计数明显增加,而双歧杆菌和乳杆菌等益生菌合成减少,是造成肠黏膜损伤的重要原因之一,与国内外报道[14-15]基本一致。笔者发现,UC患者中急性组、慢性复发组、慢性持续组双歧杆菌株数、乳杆菌株数均依次降低,肠杆菌株数、肠球菌株数均依次升高(P<0.05)。提示急性期UC患者的肠道菌群紊乱更严重,细菌感染风险更高,病情更为严重。
UC主要病理特征为肠黏膜慢性炎症损伤,炎症反应参与UC发生发展。正常情况下肠道内人体共生菌会通过激活胃肠道黏膜固有层巨噬细胞和树突状细胞上Toll受体以激活T淋巴细胞,产生抗炎因子以诱导机体对菌群免疫耐受[16]。sIL-2R是一种重要的免疫抑制剂,可中和活化T细胞周围的白细胞介素-2,减弱机体的内分泌效应,抑制已活化的T细胞的克隆化扩增,发挥正反免疫调节作用[17]。HMGB1是一种重要的晚期致炎因子,受到TLR2调节,参与炎症过程中的神经-内分泌免疫调节机制,可激活单核巨噬细胞并释放多种促炎因子,发挥致炎作用[18]。IFN-β为典型的抑炎因子,可抑制单核巨噬细胞功能以发挥抗炎作用,其表达增加则可抑制机体炎症反应过度加剧[19]。正确情况下人体中MMP-1含量极低,在各种刺激下可表达。加重黏膜组织损伤程度[20]。TGF-β是一种抑炎因子,可抑制促炎因子TNF-α、IFN-γ产生,在炎症反应过程中发挥重要作用[21]。本研究显示,UC患者血清MMP-1、TGF-β、HMGB1、sIL-2R水平均明显高于对照组,IFN-β水平明显低于对照组,且不同发病状态UC患者之间存在明显差异(P<0.05),与既往的研究[22-23]一致,肯定了上述5种炎症因子在UC发生、发展中的作用,提示炎症因子水平表达变化可准确反映UC患者的发病状态。
受肠道菌群失调及肠黏膜炎症反应的影响,UC患者存在明显肠道免疫功能异常。体液免疫是微创肠道菌群平衡的主要系统[24]。有学者证实,UC患者存在不同程度的体液免疫功能紊乱,血清免疫球蛋白IgA、IgM表达发生明显变化[25-26]。本研究发现,UC患者血清IgA、IgM水平均明显低于对照组,UC患者中急性组、慢性复发组、慢性持续组均依次降低升高(P<0.05)。进一步证实UC患者存在明显的体液免疫功能紊乱,以IgA、IgM为主,IgG无明显变化,且随着病情加重而明显降低,这与彭林艳等[27]的研究结果一致。本研究结果显示,UC患者肠杆菌株数、肠球菌株数与血清MMP-1、TGF-β、HMGB1、sIL-2R水平呈负相关(P<0.05),与血清IFN-β水平呈正相关(P<0.05);血清IgA、IgM水平及双歧杆菌株数、乳杆菌株数与血清MMP-1、TGF-β、HMGB1、sIL-2R 水平呈正相关(P<0.05),与血清IFN-β水平呈负相关(P<0.05)。提示,UC患者的炎症状态与免疫球蛋白及肠道菌群变化密切相关,UC患者的机体高炎症状态会加重肠道菌群失衡及免疫球蛋白功能异常,形成炎症因子释放—肠道菌群失调—免疫功能异常的恶性循环,进而不断促进疾病恶化。
综上所述,不同发病状态UC患者的免疫球蛋白及肠道菌群不同,且与机体炎症状态具有一定相关性,可作为判断UC患者病情的重要参考指标。

