中海拔地区不同暴露时间下大鼠肝脏组织脂肪酸代谢相关指标变化
保积英,任明
1青海大学研究生院,西宁810016;2青海大学附属医院心内科
机体的脂肪酸代谢在缺氧适应中起重要作用。脂肪酸对碳水化合物起重要的补充作用[1]。肝脏作为能量代谢的关键器官,可表达丰富参与脂肪酸代谢的转录因子及酶类。低氧下肝脏中参与脂肪酸代谢的相关基因呈差异性表达[2]。AMP依赖的蛋白激酶(AMPK)是缺氧应激的主要感受器,在能量下降的适应性反应中起关键作用。研究证实,低氧应激通过激活AMPK调节下游靶蛋白,维持机体能量平衡。乙酰辅酶A羧化酶1(ACC-1)与肉毒碱棕榈酰基转移酶1(CPT-1)分别为脂肪酸合成与氧化的限速酶[3-4]。在低氧环境下参与脂肪酸代谢的相关蛋白主要受到海拔高度及暴露时间的影响。2019年1月—2021年7月,本研究通过动态测定中海拔地区(西宁地区)大鼠肝脏组织中参与肝脏脂肪酸代谢相关指标的水平变化,探讨中海拔地区不同暴露时间下肝脏脂肪酸代谢特点。现报告如下。
1 材料与方法
1.1 实验动物与主要材料 健康成年SPF级雄性SD大鼠60只,体质量168~206 g,购于西安站梦生物科技有限公司。酶标仪、PCR仪、蛋白转膜仪购自Bio-Rad公司。凝胶成像系统购自上海天能有限公司。漩涡混合器购自海门市其林贝尔仪器制造有限公司。real-time PCR仪购自ABI公司。电泳仪购自北京六一公司。电热恒温培养箱购自上海精宏试验设备有限公司。化学发光成像仪系统购自上海勤翔科学仪器有限公司。大鼠酮体(KB)、游离脂肪酸(NEFA)、丙氨酸转氨酶(ALT)检测试剂盒购自南京建成有限公司。重组Anti-CPT1A抗体、山羊抗兔IgG H&L、重组Anti-Acetyl Coenzyme A Carboxylase抗体、Anti-AMPK抗体、Anti-HIF-1α抗体购自Abcam公司。β-actin Loading Control antibody Mouse MAb购自义翘神州有限公司。
1.2 动物分组与处理 SD大鼠60只,根据饲养环境不同分为对照组、1 d组、3 d组、7 d组、15 d组、30 d组各10只,对照组在西安交通大学医学部动物实验中心动物房(海拔400 m)饲养30 d;1 d组、3 d组、7 d组、15 d组、30 d组分别在青海大学医学院高原医学中心动物房(海拔2 260 m)饲养1、3、7、15、30 d。各组大鼠居住和饮食条件均一致,室温25 ℃,空气流通,摄食及饮食自由,有专业人员给予定期消毒,饲养过程中无动物死亡。饲养的各环节均遵循各动物实验中心要求。本研究经青海大学附属医院伦理委员会批准,并按照国家卫生部动物管理条例进行。大鼠分别在达到实验规定的暴露时间后,给予水合氯醛腹腔注射麻醉,从心脏抽取血液4 mL于抗凝管内,用低温高速离心机3 000 r/min离心10 min,取上清液于冻存管内,置于-80 ℃冰箱内;随后取大鼠适量肝脏组织置于-80 ℃冰箱中保存备用。
1.3 血浆ALT、NEFA及肝脏组织中KB测定 采用ALT试剂盒、KB试剂盒和NEFA试剂盒分别检测血浆中的ALT、NEFA及肝脏组织中的KB,严格按照试剂盒操作步骤进行。
1.4 肝脏组织中AMPK、ACC-1、CPT-1、HIF-1α mRNA及蛋白检测
1.4.1 AMPK、ACC-1、CPT-1、HIF-1α mRNA检测 将肝脏组织在液氮急速冷冻后研磨成粉,取50 mg加入含有TRIzol试剂1 mL的离心管中,混匀,室温放置15 min以上。加入200 μL的氯仿,颠倒混匀后室温放置5 min。4 ℃、12 000 r/min离心15 min。吸取上清至新的离心管中,加入等体积异丙醇混匀,-20 ℃放置60 min。4 ℃、12 000 r/min离心15 min去上清液。加入75%乙醇洗涤,4 ℃、12 000 r/min离心15 min去上清液,用RNase free的水溶解沉淀。核酸蛋白定量仪检测RNA浓度,琼脂糖电泳检测RNA完整性。取总RNA 800 ng,加入1 μL引物(0.1 μg/μL)、10 μL 2×TS Reaction Mix、1 μL TransScript@RT/RI Enzyme Mix、1 μL TransScript@RT/RI Enzyme Mix、加RNase-free水至总体积为20 μL。轻轻混匀,25 ℃反应10 min,85 ℃反应5 s取出。将合成cDNA置于-80 ℃保存,后续荧光定量检测的样本cDNA使用RNase-free Water按照1∶1稀释进行反应。引物序列见表1。PCR反应体系包括Evagreen 2×qPCR Master Mix(10 μL)、上下游引物(各0.6 μL)、cDNA(2.0 μL)、无RNA酶水(6.8 μL)。PCR反应条件:预变性95 ℃ 10 min;变性95 ℃,5 s,40个循环;退火/延伸60 ℃,30 s,40个循环。

表1 待测基因引物序列
1.4.2 AMPK、ACC-1、CPT-1、HIF-1α蛋白检测 肝脏组织样本研磨后,取100 mg加入到预冷的1.5 mL离心管中,加入400 μL RIPA裂解液,充分混匀,4 ℃放置60 min后,4 ℃下12 000 r/min离心15 min收集上清。BCA法测定蛋白浓度。样本加入适量5×SDS-PAGE Loading buffer(含β-巯基乙醇),100 ℃沸水加热处理5 min,使蛋白充分变性,12 000 r/min离心5 min,取上清备用。预染蛋白Marker 9 μL,样品每孔上样蛋白50 μg。电泳结束后,转膜时采用恒压转膜,电压100 V,使用0.45 μm的PVDF膜。AMPK、β-actin(内参)转膜时间为60 min,CPT-1、HIF-1α转膜时间为90 min,ACC-1转膜时间为150 min。使用含5%脱脂奶粉的封闭液,封闭转印膜1 h,然后TBST洗3次,一次5 min。加一抗4 ℃孵育过夜后加入二抗,室温孵育1 h,漂洗3次,将显色液A液和B液混合,加2 mL至膜上,用ChemiScope mini化学发光仪检测、拍照。使用Quantity One软件分析蛋白条带灰度值,以目的蛋白条带灰度值与内参条带灰度值比值表示目的蛋白相对表达量。

2 结果
2.1 各组血浆ALT、NEFA及肝脏组织中KB水平比较 各组血浆ALT、NEFA及肝脏组织中KB水平差异均无统计学意义(P均>0.05)。见表2。
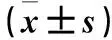
表2 血浆ALT、NEFA及肝脏组织中KB水平比较
2.2 各组肝脏组织中AMPK、ACC-1、CPT-1、HIF-1α mRNA及蛋白表达比较 对照组肝脏组织中AMPK mRNA表达量高于1 d组、3 d组、7 d组、15 d组和30 d组(P均<0.05)。15 d组ACC-1、CPT-1 mRNA表达量最低,30 d组ACC-1、CPT-1 mRNA表达量升高至对照组水平;1 d组、3 d组、7 d组、15 d组HIF-1α mRNA表达量高于对照组,30 d组降低至对照组水平。见表3。对照组与1 d组AMPK蛋白表达高于3 d组、7 d组、15 d组、30 d组(P均<0.05);3 d组ACC-1、CPT-1、HIF-1α蛋白表达量高于对照组、1 d组、7 d组、15 d组、30 d组(P均<0.05)。见表4。
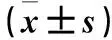
表3 各组肝脏组织中AMPK、ACC-1、CPT-1、HIF-1α mRNA表达比较
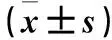
表4 各组肝脏组织中AMPK、ACC-1、CPT-1、HIF-1α蛋白表达比较
3 讨论
高原低氧习服是机体为了适应高原低氧低压环境而发生的一系列非遗传的、可逆的代偿性变化[5]。目前国内外研究多集中于高原习服过程中能量代谢模式的转变[6-8],发现氧气利用率更高以适应低氧环境。本研究结果显示,当急性(<3 d)暴露于中海拔地区,ACC-1、CPT1 mRNA表达及蛋白表达随着HIF-1α mRNA表达的增加呈现一过性增加,表明可能在急性暴露早期,脂肪酸合成及氧化代谢短暂性增强,但是随着机体逐渐产生习服,两者均逐渐降低,直至慢性暴露期一直维持接近对照组的水平,但在暴露全程中NEFA及KB水平未见明显变化。
有学者研究显示,慢性高原暴露(4 300 m,8周)高脂饮食组与高原暴露正常饮食组的大鼠肝脏组织磷酸化AMPK表达明显高于对照组,而与非高原暴露高脂饮食组比较差异无统计学意义,证明低氧环境下会激活AMPK的活性[9-10]。AMPK激活机制主要包括以下方面:增多的AMP/ATP与AMPK的γ亚基结合使其发生构象改变,激活AMPK;增多的AMP促进AMPK上游激酶肝激酶B1,直接磷酸化AMPK[11];AMP结合引起构象变化,该构象变化抑制蛋白磷酸酶对磷酸化AMPKα(Thr172位点)抗体的去磷酸化作用;通过上游激酶钙调蛋白依赖性激酶β的磷酸化作用激活AMPK。另外,由于上游激酶在不同组织的分布差异,使得AMPK活性的调节可能因组织不同而不同[10]。本研究结果仅显示AMPK mRNA及蛋白持续低表达,而对于AMPK的磷酸化水平未予以评估。
AMPK下游靶蛋白ACC-1大量表达于肝脏,可将乙酰CoA催化为丙二酰辅酶A,进一步合成脂肪酸。激活的AMPK通过磷酸化及基因表达调控ACC-1抑制脂肪酸合成代谢[12]。本研究结果显示,在急性暴露早期,ACC-1蛋白表达明显增加,而AMPK蛋白表达显著降低;随着暴露时间延长,7 d时ACC-1 mRNA及蛋白表达水平与对照组无显著差异,即从暴露第7天到第30天恢复到非暴露组水平,提示肝脏脂肪酸合成代谢一过性增强。但AMPK一直呈低表达,提示ACC-1还受到其他系统的调控。
CPT1是长链脂肪酸进入线粒体进行β氧化的限速酶。在低氧应激下,CPT1活性主要受脂肪酸合成中间产物丙二酰辅酶A调节,后者竞争性抑制CPT1的活性,从而抑制脂酰CoA进入线粒体进行β氧化。酮体是肝脏中氧化分解的中间产物,肝脏具有较强的合成酮体的酶系,合成原料为脂肪酸β氧化产生的乙酰CoA,可用于评估脂肪酸氧化水平。本研究结果显示,CPT1蛋白表达水平在暴露早期显著增加,之后逐渐恢复,而肝酮体含量在整个暴露期与对照组比较无明显变化,提示中海拔地区由于低氧状态很快被纠正,肝脏脂肪酸氧化代谢增强的持续时间短暂,并且程度较弱。
低氧环境下这类研究有很多。一项模拟低氧的研究发现,大黄鱼在急性低氧应激(96 h内)条件下,肝脏对脂质利用没有显著变化[13]。在人类肿瘤(相对缺氧环境)如肾透明细胞癌中,CPT1的表达和活性均低于正常肾脏[14]。在胃腺癌组织中,CPT1A基因表达下调,且CPT1A的表达降低与HIF-1α表达上调相关[15]。考虑到高原通常还伴有低温,一项冷缺氧相关研究[模拟海拔6 096 m、温度(10±1)℃]结果显示,暴露1 d和暴露7 d大鼠的肌肉和肝脏中CPT1表达显著减少,认为脂肪酸代谢、氧化代谢水平降低可能是动物低代谢状态的原因[16]。有学者发现,将肝细胞暴露于1% O2可降低CPT1 mRNA表达,抑制氧化代谢,诱导小鼠肝脏脂肪积聚,而对脂肪酸的合成无显著影响[17]。本研究结果提示,在低氧急性暴露下,参与脂肪酸合成与氧化的关键酶表达均增加,但由于缺氧状态很快被纠正(HIF-1α很快恢复到非暴露水平),持续时间短暂,随后恢复到对照组水平。由此可见,低氧环境下脂肪酸代谢复杂多变,除了不同的实验设计导致的结果差异外,在同一海拔的不同季节、不同性别研究对象也具有不同代谢特点[14,16-18]。
有部分研究支持本研究结果。有学者发现,在慢性暴露于高海拔环境(模拟海拔5 500 m、持续60 d)非运动状态下的大鼠,肝脏和骨骼肌中脂肪酸的氧化水平增加[19]。研究认为,慢性高原暴露(4 300 m,8周)可能通过激活AMPK使CPT1表达增加,从而纠正非酒精性脂肪肝的脂质堆积[9]。此外,恶性肿瘤的一个共同特征是持续的脂肪酸从头合成,因为需要满足肿瘤生长的生物合成需求,而这个过程是由限速酶ACC控制的[20],因此ACC抑制剂有望用于肿瘤治疗。以上研究提示,只要缺氧存在,为了产生更多的ATP,脂肪酸氧化就会合理增强。此外,本研究发现肝脏组织内CPT1蛋白表达趋势与HIF-1α一致。一项肾透明细胞癌相关研究指出,CPT1A是HIF-1和HIF-2复合物的直接靶基因,并且在肿瘤细胞中以VHL依赖的方式被抑制,导致脂肪酸分解代谢降低[14],但在单纯的低氧暴露下两者的关系有待深入研究。
综上,本研究显示,中海拔地区与平原地区暴露的大鼠脂肪酸代谢存在差异,中海拔地区急性暴露期的脂肪酸合成与氧化代谢均可能由于短暂性氧浓度下降而呈现一过性增强,之后随着缺氧迅速改善,又恢复到非暴露时的水平。不同氧浓度下的脂肪酸代谢变化规律及机制错综复杂,以后研究应深入分析其机制,进一步了解高原地区暴露后的生理变化,以便采取相应的措施来避免、克服高原低氧对人体的不利影响。

