高温大曲中吡嗪类化合物GC-MS检测方法的研究
苏 宁,吕志远,秦炳伟,张梦梦,邱振清,韩云翠,时雪萌,王滢滢,吕洪霞
(济南趵突泉酿酒有限责任公司,山东济南250115)
吡嗪是1,4位含氮的六元环化合物,具有明显的焦香或炒坚果、炒芝麻的香气[1]。白酒中吡嗪类化合物具有阈值低,气味强度高的特点,对焦香的形成具有很重要的作用,是白酒中重要的风味物质,也是大曲挥发性香味物质的重要组成成分。大曲在制作过程中产生的各类香味物质,可随着发酵和蒸馏过程进入酒体,因此,大曲中的香味物质对白酒的风味特征和品质具有一定的贡献[2]。目前,对于吡嗪类化合物的研究主要集中于对白酒中该类化合物的检测与分析[3],对大曲中吡嗪类化合物的检测方法研究较少,牛姣等[4]通过顶空固相微萃取结合气相色谱质谱联用技术,对仰韶陶香型高温大曲中挥发性香味物质进行分析,共检测出4种吡嗪类化合物。本研究采用GC-MS对高温大曲中吡嗪类化合物进行检测,共检出7种含一个或者多个甲基的吡嗪类化合物,为今后高温大曲的香味物质及最佳储存期的研究奠定了基础。
1 材料与方法
1.1 材料、试剂及仪器
材料:选用培曲期间(第0天~25天)及前期储存(第26天~80天)的高温大曲。
试剂及耗材:无水乙醇(色谱纯);内标物,2-甲氧基-3-甲基吡嗪;吡嗪类标准品,2-甲基吡嗪、2-乙基吡嗪、2,3-二甲基吡嗪、2,3-二乙基吡嗪、2,3,5-三甲基吡嗪、四甲基吡嗪、2,5/2,6-二甲基吡嗪。内标物与标准品,纯度均为99.9%,购自百灵威科技有限公司。
仪器设备:气相色谱质谱联用仪(7890 A-5975 C),安捷伦科技有限公司;电子天平(精确到0.1 g);分析天平(型号FA 2004,精确到0.0001 g),天津天马衡基仪器有限公司;超声波发生器(KQ 2200型),昆山市超声仪器有限公司。
1.2 试验方法
1.2.1 试验准备
内标标准储备液:称取0.01 g(精确至0.0001 g)的2-甲氧基-3-甲基吡嗪,使用60%乙醇水溶液溶解定容至100 mL,浓度为100 mg/L。
内标使用液:准确吸取10 mL内标标准储备液,使用60%乙醇水液稀释并定容至100 mL,浓度为10 mg/L。
吡嗪类混合标准储备液:分别称取0.1 g(精确至0.0001 g)吡嗪类标准品,使用60%乙醇水溶液溶解后定容至100 mL,使标准储备液浓度为1000 mg/L。
吡嗪类混合标准工作液:分别准确吸取2,5/2,6-二甲基吡嗪标准储备200 μL,其余标准储备液100 μL,使用60%乙醇水溶液定容至100 mL,使2,5/2,6-二甲基吡嗪的浓度为2 mg/L,其余吡嗪类浓度为1 mg/L。配制标准曲线浓度:2,5/2,6-二甲基吡嗪浓度梯度为0.2 mg/L、0.4 mg/L、1 mg/L、1.6 mg/L、2 mg/L,其余吡嗪类浓度梯度为0.1 mg/L、0.2 mg/L、0.5 mg/L、0.8 mg/L、1.0 mg/L,且内标浓度均为1 mg/L,待测。
1.2.2 试验前处理及优化
样品前处理:称取10 g(精确至0.1 g)大曲于三角瓶中,加入45 mL乙醇水溶液和5 mL内标使用液,超声,离心取上层清液,0.45 μm滤膜过滤,准确吸取1 mL滤液至进样瓶中,供GC-MS分析。
分别采用15%、25%、50%、60%乙醇水溶液作为提取溶剂,确定最优提取溶剂浓度。
加入乙醇水溶液后,分别采用20 min、30 min、60 min超声提取吡嗪类化合物,确定最优超声提取时间。
1.2.3 GC条件
色谱柱为HP-5 MS(30 m×0.25 mm×0.25 μm);进样口温度为250℃;载气为氦气,流速1 mL/min;程序升温起始温度为40℃,保留5 min,然后以3.5℃/min升至90℃,再以15℃/min升至270℃,保留5 min;分流进样,分流比10∶1,分流流量10 mL/min,进样量1 μL。
1.2.4 MS条件
电子轰击离子源(EI);电子能量70 eV;传输线温度280℃;离子源温度230℃。
1.2.5 定性定量方法
定性:SCAN模式下采集图谱,利用NIST 08标准谱库定性,确定监测离子参数。
定量:根据SCAN检测模式得到的离子检测参数,建立SIM检测模式,采用内标与标准曲线法,对吡嗪类化合物定量,每个样品测量3次。
1.2.6 方法检出限、回收率及精密度实验
以信噪比S/N为3计算出方法检出限。利用优化的前处理方法,进行回收率与精密度实验:分别取10 g大曲(同一个样品)于三角瓶中,加入45 mL乙醇水溶液和5 mL内标使用液,然后添加不同浓度的吡嗪类化合物标品,其中,2,5/2,6-二甲基吡嗪添加水平分别为0.4 mg/L、1 mg/L、2 mg/L,其余吡嗪类添加水平分别为0.2 mg/L、0.5 mg/L、1 mg/L,超声,离心取上层清液,0.45 μm滤膜过滤,准确吸取1 mL滤液至进样瓶中,待测,作为加标回收实验;每个添加水平分别做6个平行样品,计算相对标准偏差,作为该方法的精密度。
2 结果与分析
2.1 标品和样品的定性检测
定性分析:对大曲样品图谱的每个峰,利用NIST 08检索每个吡嗪类化合物,然后利用2 mg/L 2,5/2,6-二甲基吡嗪和1 mg/L其余吡嗪类的标准品,对保留时间和定性离子验证,最后确定了大曲中7种吡嗪类化合物,其中保留时间和定性离子见表1。
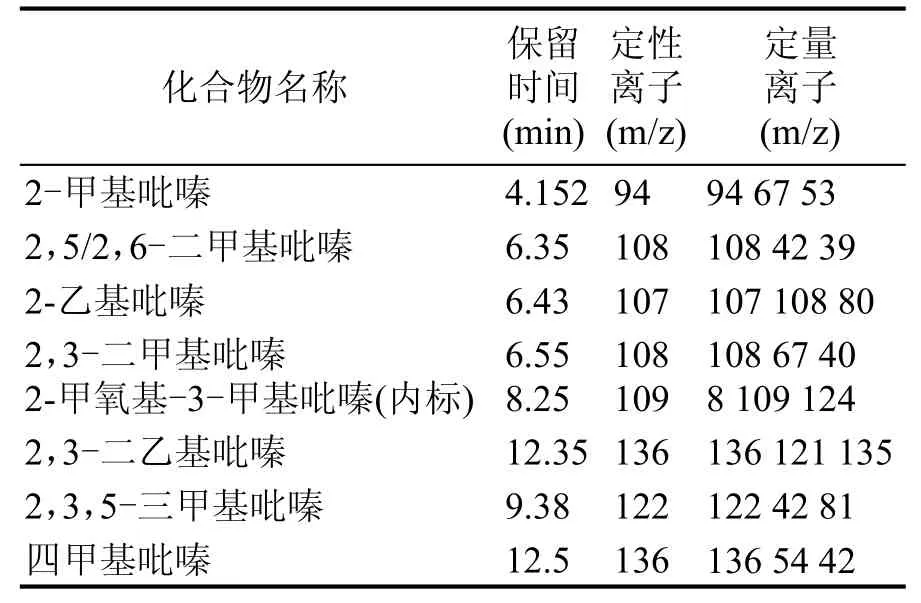
表1 7种吡嗪类化合物监测离子参数
定量分析:通过表1的定性分析,确定了7种吡嗪类化合物的定量离子,通过保留时间与定量离子,建立7种吡嗪类化合物的SIM检测模式,根据内标法,建立吡嗪类化合物的标准曲线,其中,大曲样品色谱图见图1。
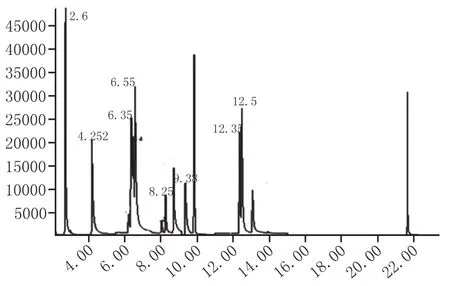
图1 大曲样品7种吡嗪类化合物和内标的色谱图
2.2 前处理方法的优化
2.2.1 提取液的优化
分别采用蒸馏和浸泡的方式对大曲吡嗪类物质进行提取。与浸泡方式相比,蒸馏过程极易产生大量气泡,导致液体溢出,危险且造成提取物的损失。
浸泡溶剂浓度优化:色谱柱为弱极性色谱柱,用水作为提取剂的样液,经过色谱柱时,会有一定的柱流失,影响色谱柱的寿命。结合柱损与乙醇(色谱级)价格,试验初步定乙醇水溶液作为提取溶剂,其浓度分别为15%、25%、50%和60%,对同一大曲样品浸泡超声30 min提取,检测过程相同,结果对比见图2。

图2 同一曲样不同浓度乙醇水溶液吡嗪类化合物检测结果
由图2可知,同一大曲样品在25%、50%、60%乙醇水溶液分别作为提取溶剂时,7种吡嗪类化合物的检测结果相差较小,而15%乙醇水溶液作为提取溶剂,检测结果含量最低。因此,选用浓度较低的25%乙醇水溶液对大曲进行浸泡处理最优。
2.2.2 超声时间优化
用25%乙醇水溶液,提取同一大曲样品中吡嗪类化合物,超声时间分别为20 min、30 min、60 min,检测过程相同,结果对比见图3。
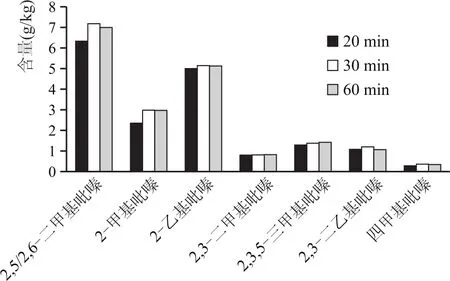
图3 同一曲样不同超声时间吡嗪类化合物检测结果
由图3可看出,对同一样品、同一乙醇水溶液浸泡,不同超声时间提取对比结果发现,30 min与60 min超声对比,检测结果相差不大;与20 min超声相对比,检测结果含量明显高于20 min超声结果含量。因此,30 min是最优超声时间。
对标准溶液进行检测分析,系列标准溶液中各组分含量(mg/L)与内标含量(mg/L)的比值为X横坐标,吡嗪类各组分与其内标的峰面积的比值为Y纵坐标,得到7种吡嗪类化合物的标准曲线,其线性方程、线性范围和相关系数见表2。
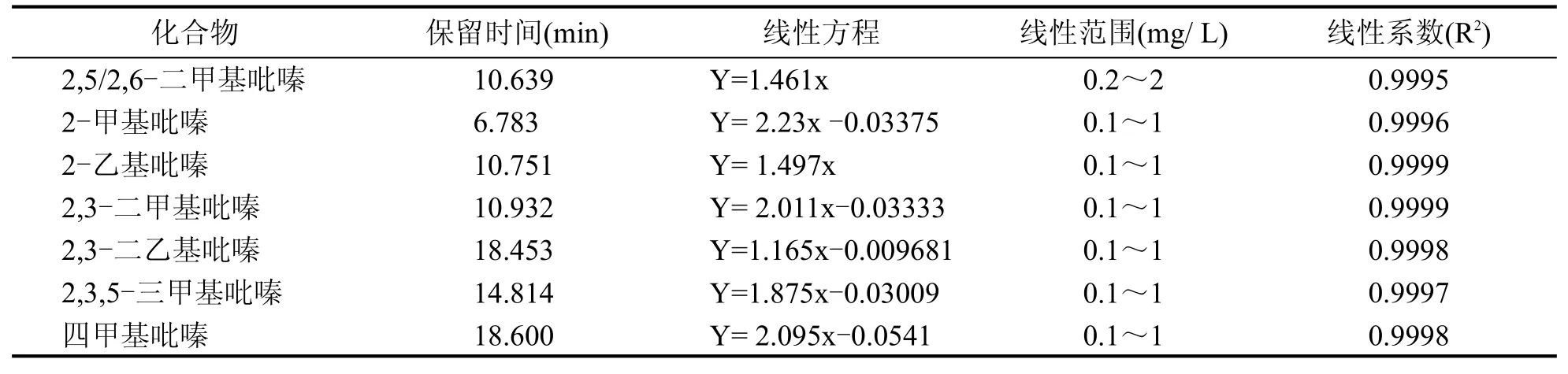
表2 7种吡嗪类化合物线性方程、线性范围和相关系数
方法检出限、试验回收率与精密度,结果见表3。
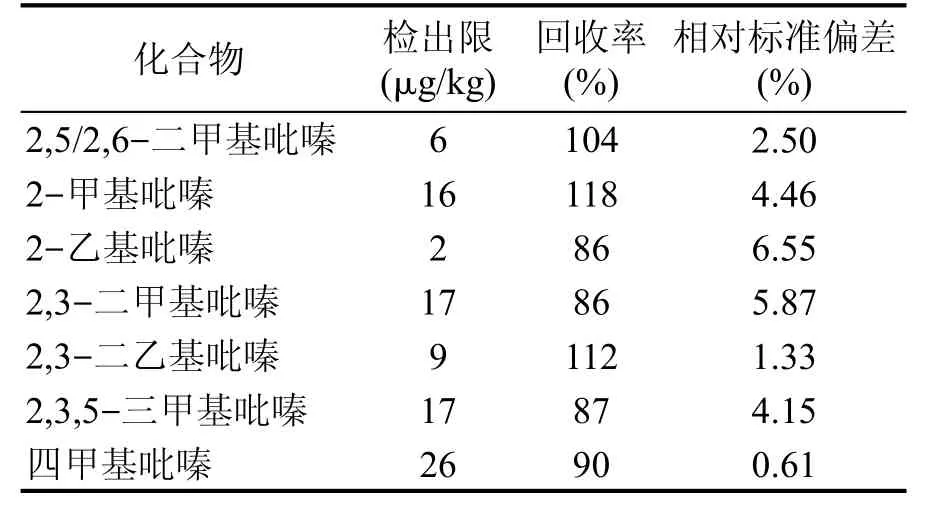
表3 方法检出限、回收率、相对标准偏差
由表2、表3可得,7种吡嗪类化合物线性相关系数均大于0.999,方法检出限在2~26 μg/L之间,加标回收率为86%~118%,相对标准偏差为0.61%~6.55%。说明该方法适用于高温大曲中7种吡嗪类化合物的检测。
2.4 样品检测验证分析
按照试验方法对培曲及前期储存期间的高温大曲样品进行检测,其7种吡嗪类化合物含量的动态变化见图4。
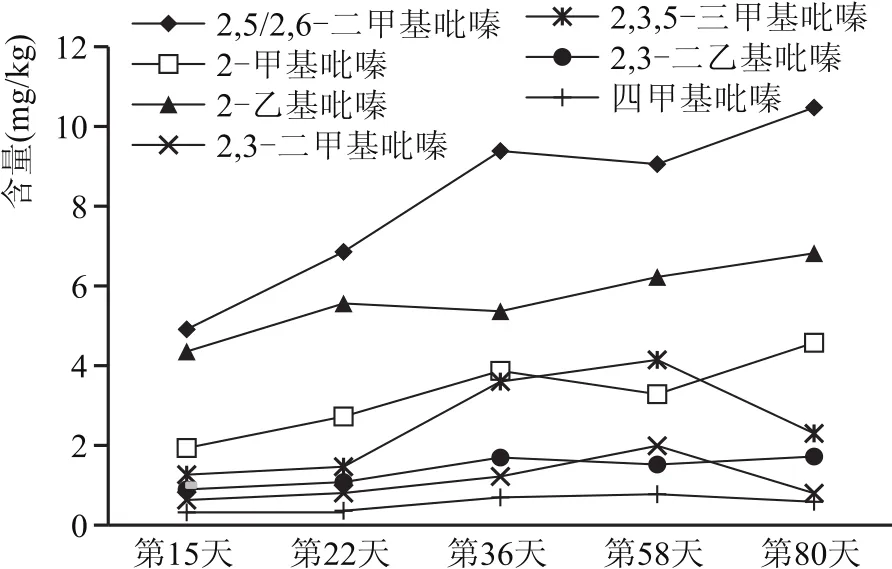
图4 7种吡嗪类化合物在培曲及前期储存期间的变化曲线
由图4可得,7种吡嗪类化合物在培曲及前期储存期间的高温大曲中均被检测出。其中,2,5/2,6-二甲基吡嗪的含量均明显高于其他6种吡嗪类化合物,四甲基吡嗪的含量最低;随发酵天数的增长,这7种吡嗪类化合物的总含量也不断增加。吡嗪类化合物主要由芽孢杆菌属代谢产生[5-7],梁晨等[8]对大曲储存过程中原核生物群落结构及风味成分演替规律研究表明,储存前期芽孢杆菌属在高温大曲中的含量增加,这也与本实验的结果符合。
3 结论
通过优化试验方法,采用GC-MS技术,建立了一种高温大曲中7种吡嗪类化合物的检测方法,本方法用25%乙醇水溶液,超声30 min对大曲进行浸泡处理,既最大程度的减少了目标化合物的损失,也节约了成本,同时,该方法操作简单,检出限低,灵敏度可靠,适用于高温大曲中吡嗪类化合物的检测。
培曲期间(0~25 d)及前期储存(第26天~80天)的高温大曲,7种吡嗪类化合物的总含量在第80天时达到最高,可达5.455 mg/kg,其中,2,5/2,6-二甲基吡嗪的含量最高,均明显高于其他6种吡嗪类化合物。本实验只对0~80 d的高温大曲进行了检测,所以高温大曲中7种吡嗪类化合物的具体变化规律及最佳储存期的选择需进一步扩大范围进行研究。

