重组大肠杆菌的酚酸脱羧酶克隆表达及固定化研究
赵 婷,袁 萌,晋湘宜,李 良,李俊微,方尚玲
(1.湖北工业大学生物工程与食品学院,湖北省酿造工艺与装备工程技术研究中心,湖北武汉430068;2.黄鹤楼酒业有限公司,湖北武汉430050)
酚酸脱羧酶(phenolic acid decarboxylase,PAD)是一种能够催化酚酸类物质发生非氧化脱羧反应(nonoxidative decarboxylation)的蛋白酶,可以催化分解酚酸类物质产生4-乙烯基衍生物[1]。酚酸类物质的4-乙烯基衍生物中的4-乙烯基苯酚有药物和辛香风味,可用于食品添加剂及香精香料行业[2-4],对葡萄酒和其他发酵食品和饮料的香气形成具有重大贡献[5]。
酶在温和的反应条件下(低温和低压下,pH值介于5~8之间)具有较高活性,还能减少副反应的发生[6]。但由于受到温度、pH值、酶液浓度、溶剂等因素的影响,游离酶的催化活性很低甚至容易失活。酶的固定技术可以克服这些问题,与游离酶相比,固定化有助于增强酶在苛刻环境中的稳定性,提高酶的催化活性和储存稳定性;另外,固定化酶可以更快速地从反应体系中分离出来,从而最大限度地减少或消除产物对酶的污染,促进了酶的有效回收和循环利用[7-9]。
本试验从解淀粉芽胞杆菌中克隆表达得到了酚酸脱羧酶的重组菌株,分别选用壳聚糖、海藻酸钠、大孔树脂,不同的交联剂进行酶的固定化,并对壳聚糖固定酚酸脱羧酶进行优化,从而确定酚酸脱羧酶的最佳固定方案,使其能够更好的应用于实际生产。
1 材料与方法
1.1 材料、试剂及仪器
菌株细胞:解淀粉芽胞杆菌,本实验室保存;大肠杆菌感受态细胞DH5α和BL21(DE3),天根生化科技(北京)有限公司。
试剂及耗材:壳聚糖,海藻酸钠,大孔树脂(HPD700,X-5),磷酸二氢钠、磷酸氢二钠和无水碳酸钠,Fe3O4,三聚磷酸钠,戊二醛,新戊二醇二缩水甘油醚交联剂,冰乙酸,均为分析纯试剂;甲醇,色谱纯试剂。质粒pMD18-T和Taq聚合酶,TaKa-Ra公司;质粒 pET-28a(+),Novagen公司。细菌DNA试剂盒和质粒提取试剂盒,Biomiga公司;限制性内切酶 NcoI、XhoI和T4 DNA连接酶,New England Biolabs公司;BCA蛋白浓度测定试剂盒和SDS-PAGE凝胶试剂盒,上海碧云天生物技术有限公司;对香豆酸、4-乙烯基衍生物,上海源叶生物技术有限公司。
LB培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠10。
仪器设备:S1000梯度PCR仪,美国Bio-Rad公司;MiniProGel蛋白制胶与电泳系统,上海碧云天生物技术有限公司;MultifugeX1R高速冷冻离心机,赛默飞世尔科技(上海)有限公司;Scientz-IID超声波细胞粉碎机,宁波新芝生物科技有限公司;HH-6数显恒温水浴锅,浙江金坛市富华仪器有限公司;UltiMate3000高效液相色谱仪,赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 克隆与表达
根据细菌DNA试剂盒说明书从解淀粉芽胞杆菌中提取总DNA,根据NCBI上(登录号:NC_000964.3)酚酸脱羧酶的基因序列设计该基因的特异性引物,正向引物:5′-CATGCCATGGCCATGGAAAACTTTATCGGAAGCCATA-3′,反向引物序列 :5′-CCGCTCGAGTTTTAATTTTCCCGCGCGAATA-3′。PCR反应体系如表1所示,PCR反应条件如表2所示。

表1 PCR的反应体系
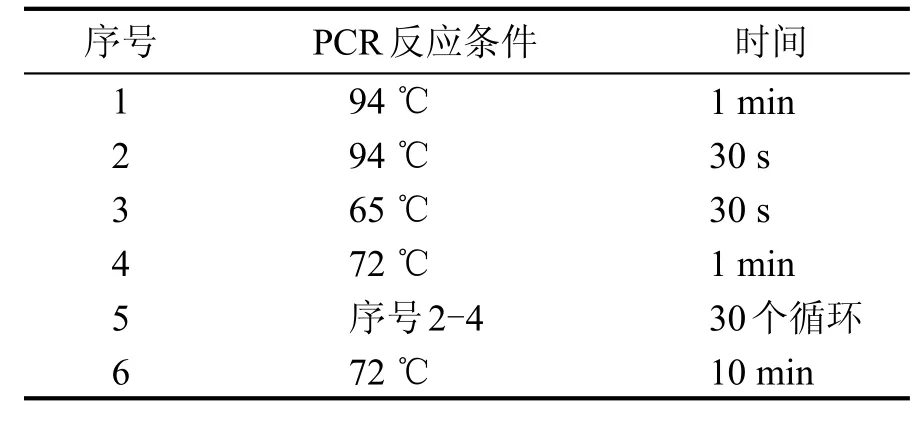
表2 PCR反应条件
通过PCR扩增得到的酚酸脱羧酶基因与pMD18-T连接,转染至大肠杆菌DH5α,挑取阳性克隆测序验证并保存。基于载体上携带的抗性基因,每100 mL培养基中添加100 μL的100 mg/mL氨苄抗生素。提取重组质粒扩增目的基因进行双酶切(NcoI和XhoI),与pET-28a(+)连接并转染至大肠杆菌BL21(DE3),LB培养基中培养并测序验证。构建成功的重组质粒在250 mL锥形瓶中扩大培养,以37℃、180 r/min培养3.5 h,添加200µL的500 mmol/L IPTG以21℃、180 r/min诱导表达18 h,每100 mL培养基中添加100 μL的100 mg/mL卡那抗生素。
1.2.2 酶的纯化和表达量测定
经诱导表达获得的菌液以8000 r/min离心5 min取下层沉淀,加入10 mL浓度为50 mol/L的Tris-HCl(pH 7.0)重悬。超声波处理酶液的参考系数为:每次处理的菌悬液为10 mL,输出功率300 W,间歇时间5 s,工作时间5 s,全部时间15 min。8000 r/min离心5 min取上清液得到粗酶液。在ÄKTA FPLC纯化系统上使用镍琼脂糖凝胶柱(1×10 cm)和50 mmol/L磷酸盐缓冲液(pH7.8)纯化粗酶液,该缓冲液分别由300 mmol/L的NaCl和不同浓度(40 mmol/L、45 mmol/L、250 mmol/L)的咪唑组成。在SDS-PAGE上电泳分析空载的大肠杆菌BL21(DE3)蛋白质样品、粗酶液蛋白质样品和纯化的酶液蛋白质样品,并通过考马斯亮蓝染色将凝胶中的蛋白质可视化,用BCA蛋白浓度测定试剂盒测定蛋白质浓度。
1.2.3 酶活力的测定
将底物对香豆酸配制成50 mmol/L的溶液,反应体系为1 mL,含有0.8 mL Na2HPO4-柠檬酸缓冲液(pH6.0)、0.1 mL的50 mmol/L底物、0.1 mL酚酸脱羧酶液,37℃水浴反应5 min后加入2 mL甲醇终止反应。0.22µm滤膜过滤后用HPLC(高效液相色谱仪)测定生成的4-乙烯基衍生物含量。将0.1 mL酶液替换成0.1 mL缓冲液,并在相同条件下反应的样品为对照。定义每分钟产生1 μmol 4-乙烯基衍生物的酶量为1 IU,酚酸脱羧酶酶活力单位为IU/mL。
酚酸脱羧酶活力(IU/mL)=cx/VT
其中:c——所加酶液的量,mL;
x——根据标准曲线计算出的4-乙烯基衍生物含量,mmol/L;
V——酶促反应体系的最终体积,mL;
T——酶促反应时间,min。
用UltiMate 3000高效液相色谱(HPLC)进行测定。Hypersil GOLDC18色谱柱(3 µm,4.6×250 mm)。流动相甲醇∶0.1%乙酸=40∶60(v/v),流速1.0 mL/min,柱温30℃,进样量20µL,检测波长280 nm。
1.2.4 不同材料固定酚酸脱羧酶
1.2.4.1 壳聚糖的固定化
将2 g壳聚糖溶解于100 mL的2%醋酸溶液中,搅拌使其形成透明均一的胶体,然后用1 mL注射器将其滴到4 mol/L的NaOH溶液中(保持针头和液面垂直),形成微球,然后一直用蒸馏水洗,直至中性。将制好的壳聚糖微球加入到一定的1.5%戊二醛中,30℃下恒温水浴摇床摇动3 h,再用蒸馏水反复洗去戊二醛,将壳聚糖小球保存于4℃下备用。称取0.5 g的壳聚糖微球,加入10 mL的酚酸脱羧酶液,4℃振荡交联16 h后,用蒸馏水洗去多余酶液即得固定化酶。
1.2.4.2 磁性壳聚糖微球的固定化
取0.2 g的Fe3O4溶于50 mL的三聚磷酸钠(TPP)溶液中,进行超声溶解,然后用1 mL注射器将其逐滴加入2%的壳聚糖溶液中。随着壳聚糖与三聚磷酸钠形成凝胶微球,纳米Fe3O4被壳聚糖包裹其中,从而形成壳聚糖包裹的磁性微球。用强磁铁块进行收集、洗涤3次,并冷冻干燥。用去离子水重复收集、洗涤、收集3次,去除多余三聚磷酸钠溶液。取一定量的磁性壳聚糖微球水重悬液作为固定化酶的载体。加入一定体积的1.5%戊二醛,避光置于25℃,120 r/min条件下进行交联。交联结束后,用去离子水洗涤3次,去除多余戊二醛。之后,加入5 mL pH6.0的0.1 mol/L的柠檬酸-柠檬酸钠缓冲液重悬载体,并加入一定量的酚酸脱羧酶,25℃、120 r/min条件下进行酶的固定化[10]。
1.2.4.3 海藻酸钠的固定化
将4 g/L海藻酸钠缓慢加入温水中并迅速搅拌,等其溶化均匀后按体积比1∶1与粗酶液混合后静置片刻。取2.5 mL注射器吸取混合液,缓慢滴入一定浓度的氯化钙溶液中,固定42 min后,缓慢搅拌,并过滤。得到的球状固定化酶用去离子水洗涤,加入戊二醛溶液在26℃下进行交联。完成交联后用去离子水洗涤,即得到酚酸脱羧酶固定酶[11]。
1.2.4.4 大孔树脂的固定化
将两种大孔树脂AB-8、X-5分别用无水乙醇浸12 h,然后用蒸馏水冲洗至无醇,保存于4℃冰箱备用。取适量处理好的AB-8、X-5大孔树脂,用滤纸擦干表面水分,分别称取1.0 g放入PE管中,加入10 mL酶液,200 r/min振荡吸附4 h,过滤即得固定化酶,晾干12 h,40℃烘干4 h。向吸附完成的体系中加入一定体积的1.5%戊二醛,40℃、120 r/min下振荡4 h,交联完成。
1.2.5 壳聚糖固定酚酸脱羧酶的优化
1.2.5.1 交联剂对固定化酶效率的影响
按照2%壳聚糖浓度,30℃下恒温水浴摇床摇动交联3 h,分别选用1.5%戊二醛和1.5%新戊二醇二缩水甘油醚作为交联剂,4℃振荡交联16 h,考察不同交联剂对固定化酚酸脱羧酶的影响。每组实验重复3次,取平均值。
1.2.5.2 交联剂浓度对固定化酶效率的影响
按照2%壳聚糖浓度,30℃下恒温水浴摇床摇动交联3 h,4℃振荡交联16 h,考察新戊二醇二缩水甘油醚交联剂浓度分别为0.5%、1%、1.5%、2%和2.5%对固定化酚酸脱羧酶的影响。每组实验重复3次,取平均值。
1.2.5.3 固定化时间对固定化酶效率的影响
按照2%壳聚糖浓度,1.5%新戊二醇二缩水甘油醚交联剂,在30℃下恒温水浴摇床摇动交联,考察固定化时间分别为10 h、12 h、14 h、16 h、18 h对固定化酚酸脱羧酶的影响。每组实验重复3次,取平均值。
1.2.5.4 壳聚糖浓度对固定化酶效率的影响
按照1.5%新戊二醇二缩水甘油醚交联剂,在30℃下恒温水浴摇床摇动交联3 h,考察壳聚糖浓度分别为1%、1.5%、2%、2.5%、3%对固定化酚酸脱羧酶的影响。每组实验重复3次,取平均值。
2 结果与分析
2.1 酚酸脱羧酶基因的克隆及表达
以解淀粉芽胞杆菌DNA为模板,PCR扩增得到目的片段,通过琼脂糖凝胶电泳检测,结果如图1所示,该片段全长为489 bp,编码162个氨基酸。进行SDS-PAGE凝胶电泳分析的结果如图2所示。
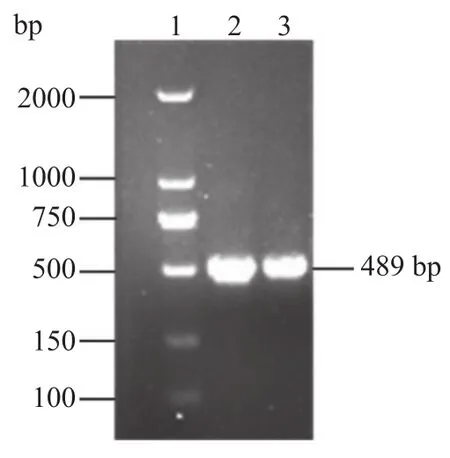
图1 酚酸脱羧酶琼脂糖凝胶电泳图

图2 酚酸脱羧酶的SDS-PAGE凝胶电泳图
2.2 不同材料固定化酚酸脱羧酶
为了找到最经济合适的固定化材料,分别选取了壳聚糖、海藻酸钠、磁性壳聚糖、两种大孔树脂作为固定化材料,其结果如表3所示。不同材料的固定化效果不同,其中大孔树脂的固定化效果最差,壳聚糖的固定化效果最好,达到了75%。

表3 不同材料的固定化率
2.3 壳聚糖固定酚酸脱羧酶的优化
为了进一步增加固定化的效果,对壳聚糖固定酚酸脱羧酶的方法进行优化,包括交联剂类型(戊二醛,新戊二醇二缩水甘油醚交联剂),壳聚糖浓度,交联时间,交联剂含量。
结果如图3所示,选择壳聚糖的浓度分别为1%、1.5%、2%、2.5%、3%,当浓度过低时固定化效果仅为60%,此时观察到壳聚糖微球比较小,不容易成球,容易分散,导致其固定化效果差。当浓度过高时,此时壳聚糖形成的球很厚很结实,可能导致孔隙过于紧密,固定化效果也不理想。因此,当壳聚糖浓度为2%时,此时的固定化效果最佳。

图3 壳聚糖浓度对酶固定化的影响
如图4所示,当分别选择戊二醛和新戊二醇二缩水甘油醚为交联剂时,不管是低浓度还是高浓度下,新戊二醇二缩水甘油醚的固定化效果都强于戊二醛。并且,由于戊二醛呈带有刺激性气味,可引起局部皮肤黏膜刺激,对人体的毒性远大于新戊二醇二缩水甘油醚,所以选用新戊二醇二缩水甘油醚为交联剂。

图4 两种交联剂对酶固定化的影响
如图5所示,当固定化时间小于12 h时,酚酸脱羧酶的固定化效果随着固定化时间的延长而增加,可能是因为固定化时间过短导致酶还没有固定好,当固定12 h时,固定效果达到最佳。而随着固定化时间的逐渐延长,酶逐渐失活,固定效率反而降低。因此,固定化的最佳时间为12 h。

图5 时间对酶固定化的影响
如图6所示,当新戊二醇二缩水甘油醚的浓度低于1.5%时,酚酸脱羧酶的固定化效果随着交联剂浓度的增加而增加,当交联剂浓度为1.5%时,固定化效果达到最佳。而随着交联剂浓度的升高,酚酸脱羧酶的固定化效果逐渐降低,可能是因为交联剂浓度过高导致酶失活。因此,新戊二醇二缩水甘油醚浓度为1.5%最佳。

图6 DCNG浓度对酶固定化的影响
3 结论
分别选择不同的方法和材料对酚酸脱羧酶进行固定,结果表明,壳聚糖的固定方法最佳,并且壳聚糖材料经济易得。进一步对壳聚糖固定酚酸脱羧酶的方案进行优化,结果表明,当壳聚糖浓度2%,固定化时间12 h,交联剂为1.5%新戊二醇二缩水甘油醚,此时的固定化效果最佳,达到93%。
由于在天然状态下,酶的稳定性较差,且基本都是一次性使用,很难进行重复利用,而酶经过适宜条件的固定化后,各项稳定性及耐受性质将会得到一定的提升,并能很好的进行回收再利用,所以我们对重组的酚酸脱羧酶进行了固定化研究。本研究是源自解淀粉芽胞杆菌的酚酸脱羧酶的第一次固定化,经过优化的酚酸脱羧酶固定化效果很好,能够利用此类方法进行固定化并使用,降低酶的生产及使用成本,为工业化生产提供了一条可能的道路。

