Mile′s术后乙状结肠造口坏死合并严重腹部感染1例
王浩,范小华,梁学敏,张思奋,郑婵美,陈宝珍,蔡玩珠
肛管直肠癌经腹会阴联合切除(mile′s)术后乙状结肠造口坏死在临床中不多见,是该手术较严重并发症之一,如处理不当,可造成腹壁及腹腔内严重感染而需要二次手术,甚至危及生命[1-2]。Mile′s术后肠造口坏死影响因素众多,传统认为手术操作不当致边缘血管损伤是主要因素;但随着低位直肠癌及直肠肛管癌术前新辅助化疗的广泛开展,放射性肠损伤成为另外一个不容忽视的因素。本文报道我院Mile′s术后乙状结肠造口坏死合并腹腔感染、反复腹壁感染的二次手术患者1例,分析造口坏死及反复腹壁感染的原因,提出防治策略。
1 病例简介
患者男性,53岁,BMI 28.58 kg/m2,无基础疾病;于2019年10月23日肠镜病理及盆腔MR检查确诊为“直肠肛管腺癌,累及左侧提肛肌、前列腺左后缘及尿道口”;经过院内MDT,结合患者意愿,决定先行术前新辅助放化疗。患者于2019年11月开始在我院放疗科行直肠肛管癌术前新辅助放化疗,放疗剂量为50 Gy/25 F,同期口服卡培他滨片(1. 5 g po bid)化疗,放化疗过程顺利。放化疗结束后经综合评估,肿瘤退缩明显,间断门诊复诊6周。2020年2月肛门指检:肿瘤退缩明显,仍可触及肛管直肠溃疡面,质韧,活动度差。复查肠镜:直肠肛管原肿瘤位置可见溃疡面;乙状结肠及直肠黏膜充血水肿、血管扩张;诊断为直肠肛管癌放化疗后,放射性肠炎。患者排除手术禁忌症后,于2020年3月2日在气管插管全麻下行腹腔镜下mile′s术。术后病理诊断:(直肠肛管)在肌层及肛管周围骨骼肌中见少许低分化腺癌残留,肿瘤最大径约2.2 mm;病理学分期ypT1NOMx TRG1级。术后给予预防感染、抑酸护胃、静脉高营养支持、维持水电解质平衡等治疗。术后第2天,结合VET评分,常规开始使用依诺肝素钠皮下注射(40 mg h qd)预防血栓;术后第1~5天病情平稳,造口黏膜红润,有排气排便;术后第6天开始,造口黏膜血运转差,呈贫血状,造口与腹壁间隙可见少量脓性分泌物,伴有间断发热、左下腹胀痛,D-二聚体明显升高(0.91升高至15. 60 mg/L FEU),予禁食、抗感染、抗凝等治疗,并加强造口护理;术后第10天(2020年3月12日),患者腹痛伴高热加重,造口无血供坏死(见图1),透明试管明确造口坏死至腹膜以下,CT提示“左下腹壁降结肠造口,腹腔内降结肠走行迂曲、积液,肠壁较多积气”,综合患者症状、体征及辅助检查,考虑坏死肠管已延续至腹腔。于2020年3月12日行腹腔镜探查术,术中探查见:肠造口肠段远端坏死累及腹膜内,并部分网膜包裹,部分小肠与降结肠粘连,左侧腹腔散见脓苔,少量脓性液体。充分游离脾曲、清除腹腔、腹壁脓苔及坏死组织,于原位再次行造口,降结肠与腹壁分层固定并一期开放。二次手术术后第5天出现造口周围腹壁感染并形成腔隙(见图2),仔细探查发现造口远端肠管9点位(冠状面)距造口边缘3 cm处穿孔,与周围形成感染腔隙,予VSD治疗后穿孔处闭合、周围腔隙痊愈。患者术后共化疗4个疗程,方案为XELOX方案(奥沙利铂200 mg ivd qd+卡培他滨1.5 g bid po×14 d),持续随访4个月,肠造口排便通畅,未见狭窄,未见黏液血便。于2020年11月再次出现造口旁腹壁感染,肛窥经造口直视下探查发现造口远端肠管5点位(冠状面)距造口边缘4 cm处穿孔、形成瘘管,并与周围形成感染腔隙;治疗上予局麻下切开引流、清除穿孔瘘管纤维化组织,加强造口护理及保持切口引流;内科予口服益生菌、复方谷氨酰胺胶囊,外用康复新液经造口保留灌肠等,经治疗后感染控制,穿孔处闭合,周围腔隙愈合。后继续在门诊随诊,并坚持口服益生菌、复方谷氨酰胺胶囊等治疗。随访至2021年4月,未见肿瘤复发及转移,未见造口肠管再次穿孔及腹壁感染。
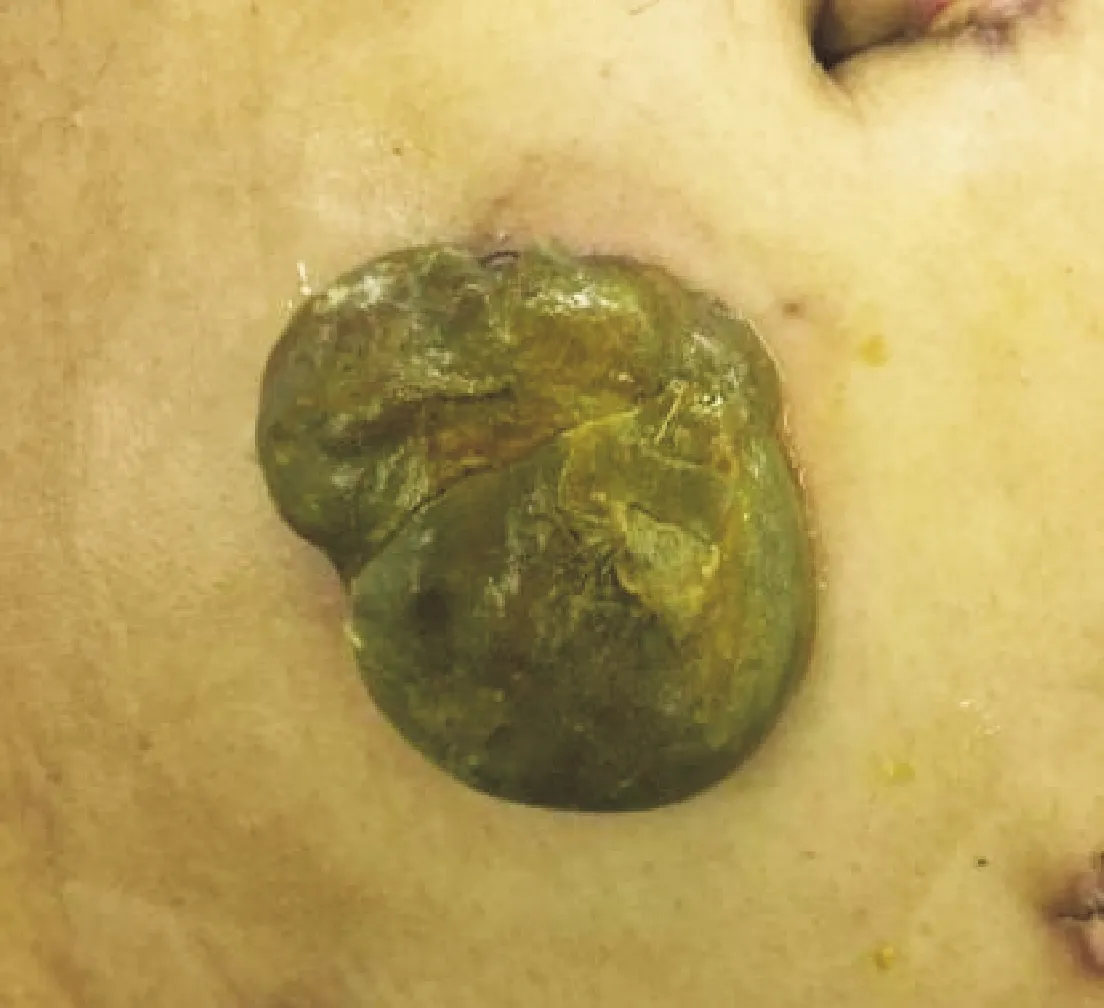
图1 肠造口坏死
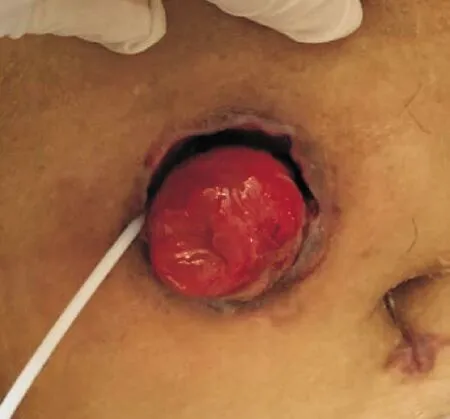
图2 造口周围腹壁感染并形成腔隙
2 讨论
乙状结肠造口坏死的间接影响因素包括:肥胖、糖尿病、急诊手术、术前放化疗、乙状结肠肠管松解程度、肠系膜血管血供、腹壁开口大小及造口底板裁剪大小等,其直接原因是造口近端肠管血运障碍[3]。放疗是盆腔恶性肿瘤治疗的最主要手段之一。随着低位直肠癌及肛管恶性肿瘤新发病例数的不断增长,放疗的严重并发症放射性肠损伤已成为消化内科、消化内镜、肛肠外科等多学科关注的重要课题,需要多学科协作,才能获得最满意的诊疗效果。
2.1 影响造口近端肠管血运的因素
结肠肠管的直接血供来源是边缘血管弓[4],即连接各二级血管的一条通道,术中二级血管的结扎并不一定影响边缘血管弓的完整和通畅性。而乙状结肠肠管血供存在两处危险区域:①中结肠动脉与左结肠动脉之间的Griffiths关键点;②乙状结肠动脉最下支与直肠上动脉之间的Sudesk危险区[5-6]。因此,良好乙状结肠造口血运的关键是保证以上边缘血管弓的完整性和通畅性。手术操作应注意以下要点:①手术在遵循TME原则下,离断、裁剪系膜过程中应特别留意对血供的保留;②基于TME中高位结扎与低位结扎在肿瘤复发、5年生存期等方面无明显差异[7-8],因此术中尽可能保留左结肠动脉;③避免对乙状结肠远端(拟造口肠管)进行肠系膜、脂肪垂的过度修剪;④腹壁开口及造口隧道应坚持“宁大勿小”原则,缝合关闭各层腱膜组织时不易过密,固定肠管时避免误扎系膜血管。对于系膜肥厚而肠管相对细小的病例,肠管与皮肤固定时,可在一个点位缝合皮肤缩小直径使之与肠管实际直径相匹配,避免腹壁开口与肠管直径相差太多导致固定后肠管张力太大。
2.2 放射性肠损伤是手术并发症的危险因素
放射性肠损伤或放射性肠炎(radiation enteritis, RE)是指盆腹腔恶性肿瘤接受放射治疗时或放射治疗后引起的肠道并发症,是放疗最常见的并发症。根据起病时间和病程变化,一般以3个月为界限,可分为急性期(acute radiation enteritis,ARE)和慢性期(chronic radiation enteritis,CRE);根据累及部位可分为小肠炎、结肠炎及直肠炎。血管损伤是RE的病理基础,其病理特征主要包括间质纤维化、黏膜水肿、溃疡、炎性细胞浸润等,且存在显著的血管病变。其在内窥镜下表现为毛细血管扩张出血,超声下具有肠壁弥漫性增厚、血流信号增多的表现[9]。诊断方面:结合患者放疗史、临床表现和辅助检查,即可确定放射性肠损伤的病变性质和部位,RE需与炎症性肠病、肠结核、Whipple综合征等疾病相鉴别。Sherman等[10]按病变的临床表现严重程度将RE分为4级。RE的发病与放射剂量、放射面积呈正相关,如在5周内照射量>50 Gy,其发病率约8%[11]。止血的对症治疗、改善或重建黏膜屏障是CRE的主要治疗方法[12-13]。
有研究表明,低位直肠癌(含直肠肛管癌)新辅助放化疗后的TME手术,其手术近端切缘普遍存在放射性损伤,且在术前被内镜预判为放射性肠炎的患者中表现更为突出,而放射性肠损伤与术后的吻合口漏、吻合口狭窄、肠造口血运障碍、肛门功能障碍、肠梗阻、肠瘘等并发症密切相关[14-15]。
在本例中,该患者术前行放化疗,并取得了较满意效果,但新辅助治疗是否构成造口坏死的主要因素呢?术前新辅助治疗对肠管影响通常被认为是危险因素[16],表现为CRE,组织表现为肠壁内小血管损伤、组织纤维化等,术中通常见肠管水肿,正常间隙融合甚至消失,超声刀烧灼后可见大量渗液,但新辅助治疗会给外科手术尤其是乙状结肠造口带来何种程度影响,目前并没有共识。但有研究表明,新辅助治疗可能增加围手术期伤口感染、吻合口瘘等并发症的发生[17]。如前所述,RE的病理基础是血管损伤;而术后肠造口缺血性坏死多发生于术后24~48 h[18],该患者造口缺血从术后第6天开始,呈“慢性贫血样”改变,直至造口远端无血供。因此,笔者认为新辅助治疗后血管损伤(微血管或边缘血管闭塞)是构成造口坏死的主要因素。目前,新辅助治疗仍然是中低位直肠癌(含肛管直肠癌)综合治疗的重要手段,放化疗后患者适当延期手术时间(4~6周)能否最大程度降低并发症值得商榷。另外,“天河术”[19]是基于降低直肠癌新辅助放化疗后带来吻合口漏、吻合口狭窄及肛门直肠功能损害的新术式,即近侧扩大切除手术,对于放化疗后行mile′s术的患者,能否借鉴“天河术”原理行近端扩大切除,或术中快速冰冻证实切缘有无放射性损伤,值得进一步深入研究。
3.3 经验及教训
在本例肠造口坏死病例中,以下经验教训值得总结。首先,本例患者的BMI为 28.58 kg/m2,而BMI>26 kg/m2即构成造口坏死的危险因素,但因患者年龄相对较轻,无基础疾病,术前并未引起足够重视。其次,根据二次手术探查情况可以确定:坏死肠管已延续到腹腔,并引起严重感染,提示对坏死程度判断不到位,二次手术时机应提前。第三,术后逐渐缺血坏死发生在手术48 h后,D-二聚体术后第6天明显升高,未进行充分讨论及处理。第四,二次手术造口定位不宜选用原位造口。
整个案例的前期处理暴露出造口管理中最常见的问题:即造口师(护理人员)与手术医生分离现象,手术医生仅负责造口的手术操作,而造口师负责定位及术后管理,权限弱化。如何将具有肠造口坏死危险因素的患者管理规范化呢?对于此类患者,必须实施围手术期医护一体化流程,做到入院医护一体化评估、术前医护一体化讨论、术中同时上台、术后造口互评(手术医生评价造口定位、造口师评价造口质量)、并发症医护一体化处理等。实施手术前造口师应做到充分评估,除了定位精准化和个性化,在术前讨论环节,还应向主刀医师提出造口的要求和术后护理的难点;手术过程中,主刀医师应按照原定部位、大小、高度实施手术;对于复杂造口,造口师可同时上台。术中采取恰当的预防措施和仔细的手术操作,固定肠管与皮肤前,应反复观察造口肠管的血运,对预防造口坏死起着重要作用。术后造口一旦出现血运障碍,除了加强造口护理之外,观察及评估造口坏死范围显得尤为重要。评估造口坏死范围,可采用透明试管插入造口,在充足光线下观察坏死深度及范围,一旦超出腹壁厚度1/2,应尽早行二次手术,以免坏死程度进一步扩大,引起腹腔内广泛感染。二次手术造口定位不宜选用原位造口,术前应再次征询造口师意见,并选取新的造口位置,以免引起隧道内再次感染及皮肤黏膜分离,远期造成造口狭窄。
本例造口逐渐缺血坏死发生在手术48 h后,并非文献报道[18]最常见的48 h内,且D-二聚体明显升高,应高度警惕造口远端血管血栓可能性。D-二聚体是纤溶酶水解纤维蛋白而产生的降解物质,能够反映机体的纤溶过程,是监测机体有无血栓形成的重要指标[20];目前相关研究表明,D-二聚体升高同样能够反映机体的感染状态[21]。本例二次手术证实未发生血栓,提示术后第6天已存在严重腹腔感染。因此,术后任何血液指标的变化均应重视并充分讨论,采取积极的处理措施;术后早期使用抗凝药物对此类患者预防血栓形成显得非常必要。
在本例中,术后远端肠管反复自发性穿孔引起腹壁感染需要引起重视。在临床中,ARE一般出现在放疗后2~3周,临床表现为恶心呕吐、腹痛腹泻、黏液血便、肛门坠胀及里急后重感等,用药后一般可以改善甚至自限;而CRE则多发生于放疗后6~60个月,持续时间久,临床表现为乏力消瘦、食欲不振、消化不良、慢性贫血,严重者可出现肠管狭窄、穿孔、肠瘘及肠梗阻等。按照Sherman[10]分级,该病例属于临床Ⅳ级。对于术前新辅助放化疗的患者,手术治疗后的随访除了关注肿瘤的规范随访之外,CRE的持续随访不容忽视。如该病例的治疗过程,除了二次手术之外,反复腹壁感染给患者身体、心理和经济带来巨大负担。术后CRE的随访和监测应该由多学科完成,内科治疗包括:营养支持、黏膜保护剂、谷氨酰胺[22]、生长抑素及其类似物[23]、高压氧[24-25]等,对于内科治疗无效的病例,才考虑内镜下治疗及手术治疗。外科手术指征为:内科治疗无效,有顽固性慢性失血、肠梗阻、肠穿孔并发腹腔感染、肠瘘等器质性病变患者,手术方式即切除肠段吻合或造口[26]。
因此,对于有造口坏死危险因素的患者,在临床中都应该引起足够重视,除了关注手术细节,RE作为独立因素应重点关注;同时,围手术期医护一体化流程对防治造口坏死及远期并发症起到了关键作用,应作为重要理念在临床中推广。

