雷公藤甲素对GSDME依赖性肝癌细胞焦亡的影响*
程 希,周淑萍,何 杰
(1.中国科学技术大学附属第一医院,安徽 合肥 230001;2.安徽理工大学基础医学院,安徽 合肥 232001;3.东南大学附属中大医院,江苏 南京 210009)
肝癌是一种肝脏恶性肿瘤,是目前临床最为常见的肿瘤之一,可分为原发性和继发性两大类。研究发现,每年新发肝癌患者在肿瘤发病中高居第5位[1]。不幸的是,大多数肝癌患者均在晚期被确诊,缺乏早期有效治疗。目前临床上抗肝癌药物主要是以化疗药物为主,可能产生不良反应和毒副作用,严重影响患者的生活质量[2]。因此,寻找低细胞毒性且有效的抗肝癌药物尤为重要。
雷公藤是卫矛科雷公藤属植物,药理学作用主要包括抗炎、抗肿瘤及免疫抑制等[3-4]。既往研究发现,雷公藤可以通过调控细胞生长周期、血管内皮生长因子受体、血管生成、肿瘤细胞增殖和凋亡等机制发挥抗肿瘤作用[5-6]。其中雷公藤有效活性成分雷公藤甲素(triptolide,TP)在抗肿瘤中被广泛研究。研究表明,TP能够通过抑制核转录因子活性,激活Caspases通路,活化分裂原活化蛋白激酶,以及干预肿瘤细胞周期,抑制肿瘤血管形成等途径发挥抗肿瘤作用[7-8]。但目前有关TP抗肝癌的分子作用机制尚不完全清晰。细胞焦亡是一种新的细胞死亡方式,广泛参与了心血管疾病的发生发展及肿瘤的进程。因此,本研究拟通过细胞实验探究TP对肝癌细胞焦亡的影响及其分子作用机制,进而为肝癌的防治提供新的方向。
1 材 料
1.1 细胞 人肝癌细胞株Bel-7402(中科院上海细胞库,批号:BEL7402-mCherry-luc)。
1.2 试剂 雷公藤甲素(大连美仑生物技术有限公司,批号:T3652-1MG);RPMI1640培养基(gibco公司,批号:14040-133);胎牛血清(gibco公司,批号:12657-029);CCK-8试剂盒(江苏碧云天公司,批号:C0037);PI染色试剂盒(江苏碧云天公司,批号:ST511);Caspase-3一抗(Cell Signaling Technology公司,批号:9662);IL-1β一抗(Cell Signaling Technology公司,批号:3498);IL-18一抗(Cell Signaling Technology公司,批号:3504);GSDME一抗(Cell Signaling Technology公司,批号:5321);β-actin一抗(江苏碧云天公司,批号:AF5009);一抗稀释液和二抗稀释液(江苏碧云天公司,批号:P0256-100ml);HRP标记的兔二抗和鼠二抗(武汉博士德公司,批号:A0409);IL-1β(江苏碧云天公司,批号:PI305);IL-18试剂盒(江苏碧云天公司,批号:PI553);GSDME siRNA和转染试剂盒(广州锐博公司,批号:C10511-05)。
1.3 主要仪器LWD300-38LFT型倒置相差显微镜(日本Olympus公司);3111型CO2培养箱(美国Thermo Scientific公司);DW-40W255型低温冰箱(中国海尔公司);YXJ-2型高速离心机(湖南湘仪实验室仪器有限公司);H22822脱色摇床(湖南湘仪实验室仪器有限公司);XN55DZG303A型纯水仪(美国Millipore公司);JD801D型凝胶电泳成像系统(美国Bio-Rad公司)。
2 方 法
2.1 细胞培养 采用10%的胎牛血清完全培养基培养人肝癌细胞株Bel-7402,培养基内加入适量的HEPES抗生素,并将培养细胞放置于37℃含5%的CO2培养箱内培养。上述细胞按照每2 d换液1次,3~4 d传代处理。传代比例1∶3。
2.2 CCK-8检测细胞活力 将Bel-7402细胞按照密度为1×104/孔种于96孔板内,待细胞贴壁生长12 h,倾去原培养基,加入终浓度为2.5、5、10 μg/mL的雷公藤甲素,同时设置加入等量培养基的空白对照组,每组均设置6个复孔,分别培养24 h;在避光条件下,每孔加入10 μL的CCK-8溶液,混合均匀,并于37℃、5% CO2培养箱内孵育1 h;采用单功能酶标仪设置检测波长为450 nm测定各孔吸光度值;依据各孔吸光度值进行OD值处理,细胞活力(OD)=实验组细胞OD值-空白对照组细胞OD值。
2.3 GSDME siRNA转染 在培养的细胞Bel-7402密度约占培养板的50%时,无血清同步化处理24 h后,按照转染试剂盒操作说明书进行GSDME siRNA转染,将转染后的细胞培养板放置于培养箱内继续培养24 h。
2.4 碘化丙啶(propidium iodide,PI)染色检测细胞焦亡 选取对数生长期细胞,按照1×105/孔细胞接种于96孔板内,待细胞生长密度达到50%~60%时,加入实验药物雷公藤甲素与细胞共培养24 h,之后进行PI和细胞核DAPI染色并于光学显微镜下拍照。
2.5 ELISA检测IL-1β和IL-18的含量 收集各组细胞上清液,按照IL-1β和IL-18试剂盒说明书进行各自浓度测定。
2.6 Western blotting检测肿瘤细胞GSDME、Caspase-3、IL-1β和IL-18表达 将处理完毕的肿瘤细胞清洗后放置于研磨管内,按照合适的比例加入细胞裂解液放置于冰上裂解40min,每间隔5 min进行细胞涡旋振荡保证裂解完全,将裂解后的离心管放置于离心机内,4℃,12 000 r/min离心10 min,得到细胞上清液。BCA法测定蛋白质浓度,按照35 μg/孔上样,电泳,转膜,孵育GSDME一抗(1∶1 000),Caspase-3一抗(1∶1 000)、IL-1β一抗(1∶1 000)和IL-18一抗(1∶1 000)于4℃过夜,洗膜,孵育对应的二抗室温孵育60 min,TBST洗膜5 min×3次,加入显影液,显影并拍照,最后采用Image J软件分析相关蛋白灰度值。
2.7 统计学方法 采用SPSS 20.0统计学软件分析,计量资料采用“均数±标准差”(±s)表示,两组间比较采用t检验,多组间比较采用ANOVA,以P<0.05为差异有统计学意义。
3 结 果
3.1 TP对肿瘤细胞活力的影响 与空白对照组比较,伴随TP处理浓度的增加,肝癌细胞株Bel-7402的细胞活力均明显降低(P<0.01)。其中在TP处理浓度为10.0 μg/mL时肿瘤细胞活力降低最为显著。(见图1)

图1 各组Bel-7402细胞活力比较(±s,n=6)
3.2 TP对肿瘤细胞焦亡的影响PI染色结果显示,与空白对照组比较,10.0 μg/mL的TP处理细胞能够明显增加PI阳性细胞数目(P<0.01),诱导细胞焦亡;Western blotting结果显示,与空白对照组比较,TP组能够明显促进Caspase-3、GSDME-N、IL-1β和IL-18表达(P<0.01)。(见图2~3)
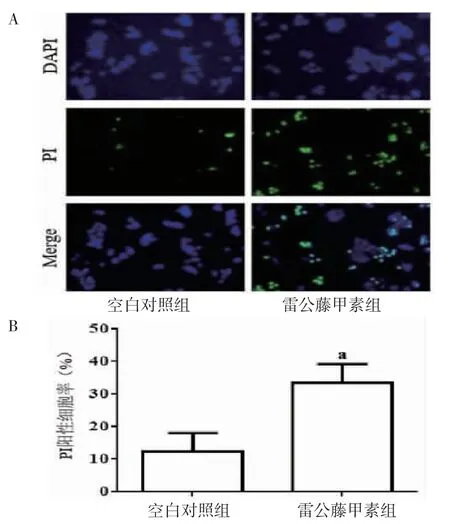
图2 两组细胞焦亡水平及比较(±s,n=6)
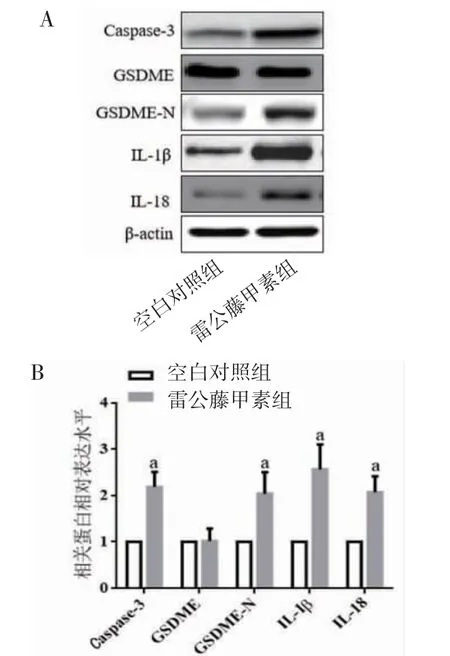
图3 两组细胞Caspase-3、GSDME、GSDME-N、IL-1β和IL-18蛋白表达及比较(±s,n=6)
3.3 TP对肿瘤细胞IL-1β和IL-18的影响 与空白对照组比较,TP组肿瘤细胞上清液中IL-1β和IL-18含量均明显升高(P<0.01)。(见图4)

图4 两组细胞IL-1β和IL-18的含量比较(±s,n=6)
3.4 siGSDME对肝癌细胞焦亡的影响 与TP组比较,转染GSDME siRNA组PI阳性细胞数目明显降低(P<0.01),转染GSDME无关片段组对焦亡影响不明显。(见图5)

图5 各组细胞焦亡的情况及比较(±s,n=6)
4 讨 论
肝癌作为我国最为常见的恶性肿瘤之一,严重威胁了患者的生命。早期诊断和早期治疗是改善肝癌患者生存预后的有效方式[9]。近年来,有关肝癌的治疗取得了一定程度的发展,其中临床治疗上主要是以手术、介入、放疗及抗肿瘤药物治疗等方式进行干预[10]。越来越多的研究者把目光投向了中医药疗法。
雷公藤是一种有效的抗肿瘤中药,研究发现TP作为雷公藤有效活性成分能够通过抑制细胞增殖、促进凋亡及抑制血管生成等方式抑制肿瘤细胞生长[11-12]。研究表明,TP具有明显的抗肿瘤活性。在非小细胞肺癌中,TP能够抑制MAPK信号通路,抑制血管生成,改善非小细胞肺癌患者临床症状[13]。在乳腺癌细胞系中,给予TP能够有效抑制乳腺癌细胞增殖,促进凋亡相关蛋白Caspase-3和Bax表达[14]。上述研究均表明雷公藤甲素在促进肿瘤细胞凋亡中发挥重要作用。新近研究发现,活化Caspase-3不仅能够诱导细胞凋亡也能够诱导GSDME依赖性细胞焦亡[15]。当细胞高表达GSDME时活化Caspase-3能够诱导GSDME依赖性细胞焦亡,而当细胞低表达GSDME时激活Caspase-3会诱导细胞凋亡[15-17]。但是有关Caspase-3介导的GSDME型细胞焦亡在肝癌中的作用尚不清楚。细胞焦亡是一种新的细胞死亡方式。既往研究发现,细胞焦亡是由Caspases介导的细胞炎症性死亡。细胞焦亡主要可分为Caspase-1/4/5/11介导的GSDMD依赖性细胞焦亡和Caspase-3介导的GSDME依赖性细胞焦亡两大类[15,18]。GSDME作为Gasdermins家族蛋白成员之一,由具有细胞毒性的GSDME-N和GSDME-C组成。当细胞受到外界致病因子或是死亡信号刺激后会通过活化Caspase-3,进而促使GSDME剪切形成GSDME-N片段,随后其与细胞膜上的磷脂分子结合形成GSDME细胞孔洞,导致细胞内容如IL-1β、IL-18等无释放直至细胞肿胀破裂[19]。近年来,有关Caspase-3介导的GSDME依赖性细胞焦亡在肿瘤进展中广泛研究[15]。因此,通过诱导细胞焦亡可能成为抑制肿瘤发生发展的重要手段。为此,我们通过体外细胞实验探究TP对细胞Bel-7402焦亡的影响及其分子作用机制。通过体外培养人肝癌细胞株Bel-7402。结果发现,与空白对照组比较,随着TP浓度的增加细胞活力明显降低。采用10.0 μg/mL TP处理Bel-7402,细胞焦亡数量明显增加。以上结果表明,TP能够有效促进肿瘤细胞焦亡发生过程。为进一步阐明TP对细胞焦亡的分子作用机制,实验通过Western blotting检测焦亡相关蛋白Caspase-3、GSDME、IL-1β以及IL-18表达,结果发现,与空白对照组比较,TP组细胞Caspase-3、GSDME-N、IL-1β及IL-18表达明显升高,同时细胞上清液中炎症因子IL-1β、IL-18释放明显增加。上述研究结果表明,TP能够通过促进肝癌细胞焦亡过程,抑制肝癌的发生发展。本实验通过转染GSDME siRNA 24 h后TP处理细胞Bel-7402,结果发现,与TP组细胞比较,GSDME siRNA能够显著抑制细胞焦亡。
综上所述,TP能够通过促进Caspase-3介导的GSDME依赖性细胞焦亡过程,抑制肝癌细胞增殖,改善肝癌进程。上述研究结果为TP用于治疗肝癌提供了新的理论基础。

