阿特拉津降解菌ATR3的分离鉴定与土壤修复
杨立杰,施德志,彭 湃,吴 迪,杨君子,李彦成,王恩彪,孟 垚,魏小娜,李婷婷*
(1.沈阳化工研究院有限公司,辽宁 沈阳 110021;2.辽宁石油化工大学 环境与生物工程学院,辽宁 抚顺 113001)
阿特拉津因效率高、价格低廉,是我国玉米田施用最广泛的除草剂之一。但阿特拉津的使用量大,半衰期长(在水体中的半衰期为41~237 d,在土壤中的半衰期为8~99 d),且存在条件不同其半衰期也存在差异[1-2]。同时由于阿特拉津溶解性较好,迁移率高,很容易造成水体和环境的污染,因此阿特拉津作为一种典型的有机污染物所引发的生态和环境问题也日益严重[3]。阿特拉津在土壤和水体中的主要降解方式为生物降解[4]。随着研究的深入,已有很多降解阿特拉津的单一菌株或者复合菌株被发现,由于气候和生态环境因素对微生物有较大的影响,所以同一菌株在不同土壤不同环境条件下的降解能力存在较大差异[5]。同时,对于阿特拉津的吸附、解吸附、毒性及在水体中的降解途径也做了大量研究[6-8]。然而,目前已有的研究多集中在降解菌株的筛选,降解试验也局限在培养基[9-10]。由于不同区域、不同土壤类型中的阿特拉津降解菌的特征存在差异,土壤环境相较于培养基营养相对贫瘠,成分更为复杂,在培养基中具有高效降解活性的微生物往往无法在土壤中维持较高的数量,也就无法体现出其修复功能[11]。这就使得理论研究与实际土壤修复工作出现断层。室内模拟修复实验可以避开原位实验中很多不可控因素(如温度、湿度等),消除了随机误差对实验结果的影响,同时又能模拟大田的土壤环境,是连接理论研究与原位修复工作的重要桥梁[12]。本研究旨在从长期接触阿特拉津的污染土壤中驯化分离可利用阿特拉津为唯一氮源、具有高效修复能力的细菌,并对其进行菌种鉴定和降解特性的研究。在此基础上,通过室内模拟的污染土壤修复实验,考察降解菌对土壤中阿特拉津的残留及对植物的解毒效果。以敏感作物玉米为研究对象,观察不同土壤类型中阿特拉津对玉米植株生长发育的影响以及降解菌株对玉米的解毒作用,为阿特拉津污染土壤的原位修复提供必要的参考。
1 材料与方法
1.1 材料
1.1.1 供试土壤 菌株筛选土壤采自辽宁省沈阳市施用阿特拉津10余年的玉米田表层土(0~10 cm),盆栽试验土壤采自辽宁省沈阳市、辽宁省朝阳市、黑龙江省大庆市从未施用过阿特拉津的土壤,采样点信息和基本理化性质见表1。
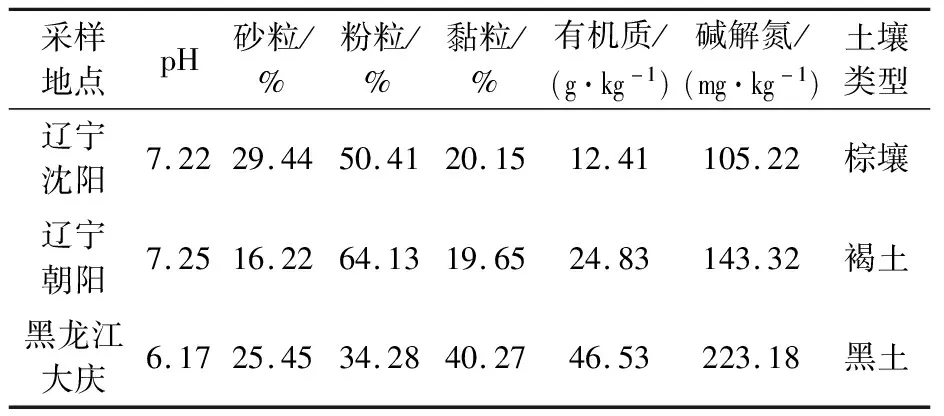
表1 供试土壤基本理化性质
1.1.2 培养基 LB培养基和基础无机盐培养基采用常规方法配置。唯一氮源培养基(g/L):K2HPO41.79,KH2PO40.45,MgSO4·7H2O 0.10,NaCl 0.40,葡萄糖10.00,1 mL微量元素储存液,pH 7.0。根据实验要求加入一定量的阿特拉津原药。微量元素配方(g/L):FeSO4·7H2O 2.0,MnSO4·H2O 2.0,CuSO4·5H2O 0.8,ZnSO4·7H2O 10.0,Na2MoO4·2H2O 0.5,Na2B4O7·10H2O 0.4,EDTA 5.0。配置固体培养基时,琼脂粉添加量为15 g/L。115 ℃灭菌20 min备用。
1.1.3 主要仪器与试剂 高效液相色谱仪(Agilent 1100,Agilent,USA);色谱柱(150 mm×4.6 mm)(Ultimate XB-C18,Agilent, USA);高速冷冻离心机(D3024R,北京大龙兴创试验仪器有限公司);立式高压蒸汽灭菌锅(LDZX-50KB,上海申安医疗器械厂);基因扩增仪(ETC811PCR,北京东胜创新生物科技有限公司);电泳设备(ESP600,上海天能科技有限公司)。阿特拉津原药购自上海安普科学仪器有限公司(纯度98%以上);其他常规试剂均购自中国医药集团有限公司,液相色谱仪所用试剂均为色谱纯。
1.2 方法
1.2.1 阿特拉津降解菌的富集和分离 10 g 污染土加入盛有 100 mL 唯一氮源培养基(阿特拉津浓度 100 mg/L)的250 mL 三角瓶中,30 ℃,180 r/min 培养7 d,取 10 mL 悬浊液接入100 mL 新鲜的含高浓度阿特拉津(200 mg/L)的唯一氮源培养基中继续富集培养,每次富集培养时,培养基中的阿特拉津质量浓度均较前次增加100 mg/L,直至阿特拉津在培养基中的质量浓度达到1 000 mg/L。部分富集的菌悬液于-80 ℃保存,其余用于后续试验。最终富集的菌液进行10-2、10-3、10-4、10-5和10-6梯度稀释并涂布于唯一氮源培养基(含1 000 mg/L阿特拉津),分别将长出的菌落划线分离纯化并将纯化的单菌落斜面保存。
1.2.2 降解菌的筛选及降解能力测定 将分离纯化的单菌落分别接入LB液体培养基中,30 ℃,180 r/min 培养过夜,收集菌体,生理盐水洗涤 2 次,制备成OD600值为1.0 的菌悬液,2%接种量接种到以阿特拉津为唯一氮源的无机盐培养基中(阿特拉津质量浓度1 000 mg/L),30 ℃,180 r/min 培养72 h。空白对照不加菌。每个处理3个重复,每隔4 h取样,测定培养液的OD600值和残留的阿特拉津含量。高效液相色谱测定农药阿特拉津残留量,色谱条件为流动相:V甲醇∶V水=4∶1;流速1.0 mL/min;进样量 5 μL;检测波长220 nm;色谱柱Ultimate XB-C18(150 mm×4.6 mm)。根据对照和各样品的残留浓度计算去除率,取去除率最高的菌株进行后续实验。
1.2.3 高效降解菌的鉴定 菌株的形态及生理生化特性测定参照文献[13]。16S rRNA 基因克隆参照文献[12],Fast DNA SPIN Kit for Soil试剂盒提取菌体总DNA,16S rRNA 的通 用 引 物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-CGGTTACCCTTGTTACGACTTC-3′)进行 PCR 扩增反应,序列测定由上海生工生物工程股份有限公司完成,将测序结果用BLAST软件与GenBank 数据库中的相关 16S rRNA 基因序列进行同源性比对分析。调取相似性高的菌株16S rRNA 序列,经Clasta X软件包比对后导入 MEGA(version 5.1)软件中构建系统发育树。
1.2.4 高效降解菌的土壤修复试验 将采集的棕壤、褐土和黑土过筛,设置3个处理,每个处理3个重复,并分别装于花盆中。①CK:自然土不做处理;②T1处理:添加阿特拉津4 mg/kg;③T2处理:添加阿特拉津4 mg/kg+降解菌(1.0×108cfu/g)。挑选籽粒饱满,形状规则的玉米种子,播种于各处理土壤中,每盆播种 5粒。室温培养,观察并记录不同处理土壤玉米种子的出苗率、株高、根长、干质量等数据。从添加阿特拉津当天开始计时,分别于第 0、7、14天,检测土壤中阿特拉津的残留量,检测方法参照文献[14],origin 8.0画图,SPSS 18.0软件进行统计分析。
2 结果与分析
2.1 降解菌的富集、分离及其生理生化鉴定
菌落经分离纯化以及高效液相色谱定量分析,从长期施用阿特拉津的玉米田土壤中分离出一株高效降解菌菌株ATR3。该菌在添加200 mg/L阿特拉津作为唯一氮源的培养基上形成较明显的透明圈,接种24 h后,菌落周围的阿特拉津去除率为96%。
光学显微镜下观察,该菌幼龄菌杆状,老龄菌球状,有明显的杆、球变化,无鞭毛;LB平板上菌落光滑,表面凸起,圆形,呈亮黄色。革兰染色阳性,M.R(甲基红实验)、V.P(乙酰甲基甲醇试验)阴性,不水解淀粉,不水解明胶,氧化酶阴性,接触酶阳性。经PCR扩增后,得到长约1 500 bp的16S rRNA片段(图1)。通过NCBI的BLAST比对结果表明,菌株ATR3的16S rRNA基因序列与多株节杆菌属(Arthrobactersp.)的同源性在99%以上。系统进化树(图2)比对结果表明,菌株ATR3与节杆菌属菌株Arthrobacterkeyseri亲缘关系最近,在同一聚类分支。结合菌株ATR3生理生化分析和分子鉴定结果,确定菌株ATR3为节杆菌属(Arthrobactersp.)。
图1 16S rRNA 片段的扩增
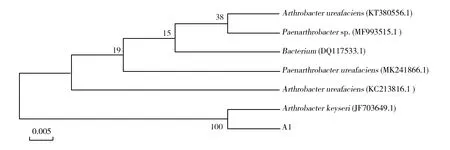
图2 菌株ATR3 16S rRNA系统发育树
2.2 培养时间对降解菌ATR3生长和阿特拉津残留率的影响
利用紫外分光光度计和高效液相色谱对培养基中阿特拉津的含量进行检测,分别得到菌株ATR3的生长曲线和阿特拉津降解曲线,如图3所示。从图3可以看出,0~45 h为菌株ATR3的对数生长期;72 h后进入稳定期。培养12 h后,对阿特拉津的降解效率为50%,培养18 h后,降解效率为62%;培养24 h后,降解效率为92%,培养48 h后,降解效率为97%。

图3 降解菌ATR3生长和阿特拉津残留率
2.3 降解菌ATR3对不同类型土壤修复效果
降解菌土壤修复试验结果显示,在不添加降解菌ATR3的含农药土壤中,由于化学水解作用和土壤中土著微生物的分解代谢,棕壤、褐土和黑土中的阿特拉津浓度均有一定量的降解,但阿特拉津降解菌ATR3加入到土壤后,阿特拉津的去除效率明显提高,14 d后,阿特拉津(4 mg/kg)在土壤中的去除率为98.75%(图4)。阿特拉津在三种土壤中的去除速率也存在一定的差异,无论是否加入降解菌,阿特拉津在棕壤中降解最快;14 d后,T1和T2处理阿特拉津降解去除率大于99%。7 d后,褐土不添加降解菌的T1处理,阿特拉津残留率为24.01%,加入降解菌ATR3的T2处理,残留率为5.25%,14 d后,T1处理阿特拉津残留率为4.02%,T2处理残留率为0.15%。14 d后,黑土中残留率为18.84%,去除速率最慢。加入降解菌的T2处理后,阿特拉津残留率仅为1.25%。说明阿特拉津去除与土壤pH、黏粒含量和土壤有机质等理化性质密切相关。

图4 不同处理土壤中阿特拉津残留量
2.4 降解菌ATR3施用后对玉米生长的影响
不同处理玉米幼苗出苗率、根长、株高和干质量随时间变化结果如表1所示。当玉米种植于阿特拉津含量为4 mg/kg的土壤时,添加降解菌剂、污染处理与未污染处理土壤相比,各处理玉米出苗率存在一定的差异,但差异不显著。玉米根长和株高与未受阿特拉津污染的土壤处理(CK)相比受到抑制。添加降解菌剂(T2)后,玉米根长与株高受到的抑制作用减小。7 d时三种处理玉米生物量存在一定的差异,变化趋势与根长和株高结果一致;14 d时,阿特拉津污染条件下玉米生物量与对照相比受到明显影响,表明随着种植时间延长抑制效果逐渐增强,而添加修复菌剂处理的污染土壤(T2),14 d时玉米生物量较污染处理(T1)略有增加,但促进效果不显著。与棕壤和褐土相比,T1处理的玉米出苗率、株高、根长、干质量均受到抑制,加入降解菌ATR3后,抑制作用明显缓解,玉米植物的各项指标基本恢复正常,与不添加阿特拉津处理(CK)相比无显著差异,说明T2处理中残留的阿特拉津浓度不足以对玉米生长产生抑制作用。
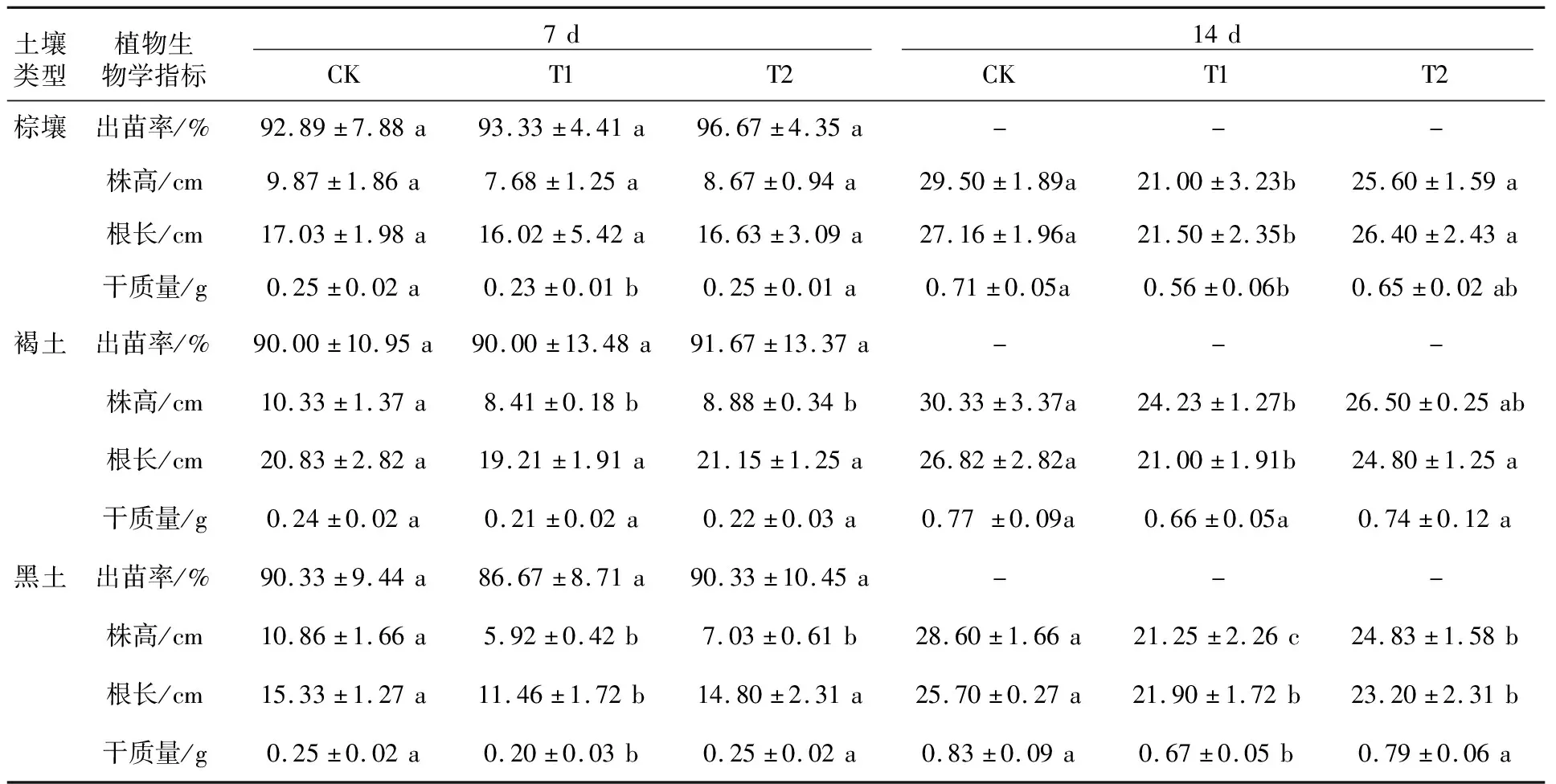
表1 降解菌ATR3施用后对玉米生长指标的影响
3 讨 论
阿特拉津作为一种药效高、用量少的三嗪类除草剂,目前主要用于玉米田阔叶杂草的防治,由于其结构稳定,具有隐形药害,可在土壤中长时间残留,在水体和土壤中的主要降解方式是微生物降解[2,13]。本研究筛选的阿特拉津降解菌属于节杆菌属,该菌属细菌具有很强的抗旱性、耐饿性和耐盐性,通常被认为是土壤中的优势菌[15],因此本研究筛选的阿特拉津降解菌具有很好的土壤修复前景。国内外研究中报道的阿特拉津降解菌的降解效率不尽相同。主要是农药的微生物降解受很多因素的影响,例如培养时间、温度、农药浓度、pH、湿度、农药性质、土壤C/N、土壤有机质含量以及碳源和氮源的存在与否等[16-18]。前人对阿特拉津污染土壤的生物修复作用研究,大多集中在菌株(FM326、LY2、MSD6等)[4,7]对土壤中阿特拉津的去除率上,而对后茬敏感作物的修复指标研究的报道较少。李红梅等[11]和刘春光等[12]的研究表明,菌株在一定时间内能解除阿特拉津对单一土壤敏感作物小麦及水稻产生的药害。本研究的降解菌ATR3以阿特拉津为唯一氮源,48 h内对1 000 mg/L阿特拉津的降解率达97%,不同土壤类型玉米盆栽试验结果表明,菌株ATR3在短期内都能有效解除阿特拉津对敏感作物玉米产生的药害。说明该菌株能有效去除不同类型土壤中阿特拉津残留。本研究通过测定盆栽玉米的各项生物学指标,表明菌株ATR3处理污染土壤14 d后,可明显恢复敏感作物玉米的各项生物指标(株高、鲜重、干质量),且对玉米无明显药害,显示出较好的修复效果,说明菌株ATR3可以修复阿特拉津污染土壤。检测阿特拉津在土壤中的残留量结果表明,本研究筛选的阿特拉津降解菌ATR3能有效去除土壤中的阿特拉津残留,可为阿特拉津的微生物修复提供有价值的菌种资源。另外,除草剂在降解过程中还受到土壤有机质、质地和其他因素影响[20-21]。本研究中的阿特拉津在棕壤、褐土和黑土中的去除速率存在显著差异,其中阿特拉津在棕壤中去除最快,褐土次之,黑土中去除最慢。由三种土壤的基本理化性质可知,黑土的有机质含量最高,棕壤最低。南超[22]研究发现,有机质含量与农药降解能力呈负相关关系,这也是黑土中阿特拉津危害更为严重的原因之一,有机质相对含量较高的土壤,阿特拉津更易与其中的有机物发生相互作用,影响代谢速率,这与本研究结果相似。因此,在今后的研究中,应重点关注黑土中农药降解菌的筛选以及对土壤的修复效果。

