产糖乳酸菌的筛选、鉴定及其产糖条件的优化
韩 瑨
(光明乳业股份有限公司 乳业生物技术国家重点实验室,上海 200436)
微生物胞外多糖(exopolysaccharides, EPS)被定义为由微生物分泌到周围环境中的高分子聚合物,其主要作用是协助细菌黏附以及抵抗各种不利的环境因素(干燥、有毒和/或环境压力等)[1]。乳酸菌(lactic acid bacteria, LAB)作为一类典型的EPS产生菌,在食品加工领域有着长期且安全的应用历史[2]。由于LAB通常被认为是安全的食品级微生物,因此LAB及其纯化的EPS可直接被应用于乳制品行业,以代替商业乳化剂和增稠剂,从而改善酸奶或发酵乳的黏度、质地和口感[3]。除了上述优异的加工性能外,LAB EPS还可为环境(生物絮凝剂、生物吸收剂和重金属去除剂[4])和人体健康(抗肿瘤剂[5]、免疫刺激剂、抗氧化剂[6]、药物输送剂[7]、益生元[8])提供多种增益作用。尽管LAB EPS的各类功效得到了广泛的认同,并且该领域的文章发表数量与日俱增,但被市场化、产业化的产品却凤毛麟角(α-葡聚糖如右旋糖苷[9]、β-果聚糖如levan[10])。乳杆菌属(Lactobacillus)微生物是LAB的重要分支,至今已有超过180种微生物划归该属,其典型的菌株特性为革兰阳性、无孢子形成、酶触反应阴性、兼性需氧或微需氧、杆状、营养需求复杂(碳水化合物、氨基酸、维生素等)。鼠李糖乳杆菌(Lactobacillusrhamnosus)是乳杆菌家族的成员之一,最早被发现于1968年并归类为干酪乳杆菌(Lactobacilluscasei)的一个亚种,后于近代(1989年)被重新归类为一个独立的乳杆菌种。到目前为止已有大量学者针对L.rhamnosus的各种益生特性进行了广泛的报道。Yan等[11]发现新生小鼠在定殖了鼠李糖乳杆菌LGG后肠道发育更健康,其成年期的易感性更低。Pahumunto等[12]认为,每天饮用含有鼠李糖乳杆菌-SD11和麦芽糖醇的发酵牛奶,可有效降低唾液变异链球菌对口腔的危害。不难发现,此类报道的研究对象多为鼠李糖乳杆菌菌体本身或其发酵混合物,但有关该类微生物的具体代谢产物(如EPS等)及其生物学功能的研究却相对偏少。Shao等[13]从L.rhamnosusKF5发酵乳中分离获得2个多糖组分,研究人员在对多糖进行结构表征后,还进行了免疫调节实验,发现两组分均有不同程度的调节免疫活性。鉴于微生物来源的功能性EPS的应用范围越来越广,更多的产糖LAB需要被发掘和研究。针对上述研究背景,本研究首先从筛选EPS高产的LAB入手,继而对目标菌株进行了鉴定,最后利用单因素和响应面实验优化了菌株产糖条件,旨在为后续相关的开发与研究工作提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源LactobacillusrhamnosusB6(CGMCC No.13310)、KF7由光明乳业股份有限公司提供;LactobacillusbulgaricusLB340、HM及StreptococcusthermophilusST-21、TA-40由丹尼斯克公司提供;Lactobacilluscasei334、393购自ATCC。
1.1.2 试验材料 脱脂乳粉(Foterra,新西兰),主要成分为乳糖54.5%、蛋白质32.9%、矿物质7.9%、水分3.8%、脂肪0.9%。
1.1.3 培养基及试剂 MRS琼脂/液体培养基(默克公司,德国);M17琼脂/液体培养基(OXOID LTD.,英国);三氯乙酸、无水乙醇(国药集团化学试剂有限公司,上海)。
1.1.4 仪器与设备 电炉(108H,Fisher scientific公司);高压灭菌锅(HVE-50,HIRAYAMA公司);超净工作台(SG-402TX,THE BAKER COMPANY公司);高速冷冻离心机(AVANTI J30I,美国BECKMAN COULTER公司);真空冷冻干燥机(FreeZone 12,美国LABCONCO公司);黏度计(R180,德国proRheo公司);隔水式恒温培养箱(GNP-9270,上海精宏实验设备有限公司)。
1.2 方法
1.2.1 发酵种子的制备 将L.rhamnosusB6、KF7、L.bulgaricusLB340、HM、L.casei334、393和S.thermophilusST-21、TA-40的冻干粉以少量无菌蒸馏水溶解,用接种环挑取一环划线于MRS(杆菌培养)或M17(球菌培养)琼脂培养基上,37 ℃厌氧培养24 h,用接种环挑取单菌落接入1 mL 对应的液体培养基中,采用涡旋混合仪将细胞均匀分散后,37 ℃厌氧培养24 h,以2%(体积分数)接种量接种于50 mL 对应的液体培养基中,37 ℃厌氧培养24 h,15 000 r/min离心10 min,弃去上清,沉淀部分以无菌蒸馏水洗涤2次后,用原培养体积的无菌蒸馏水悬浮,即得发酵种子液。
1.2.2 发酵培养基的制备 脱脂乳培养基的制备:将脱脂乳粉与蒸馏水混匀,充分溶解后,120 ℃灭菌20 min即得质量浓度40~120 mg/mL的无菌脱脂乳培养基。
1.2.3 多糖的制备 将发酵乳于15 000 r/min离心10 min,取上清,加入3倍的80%~100%(体积分数)乙醇于上述离心后的上清液中,静置过夜,15 000 r/min离心10 min,收集沉淀物并溶于少量蒸馏水中,加入三氯乙酸,使其终浓度达到10%(体积分数),冷藏过夜,15 000 r/min离心10 min,取上清,透析袋(MWCO=14 kD)透析48 h,期间每8 h换水一次,袋内透析液经真空冷冻干燥即得多糖。
1.2.4 发酵乳黏度的测定 使用黏度计对发酵乳的黏度进行测量,测量条件:德国proRheo公司R180型黏度计、1#转子、转速100转/秒,温度15 ℃。
1.2.5 高产EPS菌株的筛选与鉴定 将1.2.1所述方法制备的发酵种子液按3%(体积分数)的接种量无菌接入100 mg/mL脱脂乳培养基中,37 ℃厌氧培养24 h,根据1.2.3和1.2.4所述方法测定发酵乳的黏度和多糖含量。采用生理生化实验结合16S rDNA基因序列比对的方法对目标菌株进行鉴定。
1.2.6 产糖条件的单因素实验 ①发酵时间对多糖产量的影响:将L.rhamnosusB6种子液以3%(体积分数)接种量无菌接入100 mg/mL脱脂乳培养基中,37 ℃厌氧培养,分别于12、24、36、48和60 h取样,按1.2.3所述方法制备多糖并称重。②发酵温度对多糖产量的影响:L.rhamnosusB6种子液以3%(体积分数)接种量无菌接入100 mg/mL脱脂乳培养基中,分别于31、34、37、40和43 ℃厌氧培养24 h,按1.2.3所述方法制备多糖并称重。③脱脂乳浓度对多糖产量的影响:将L.rhamnosusB6种子液以3%(体积分数)接种量无菌接入40、60、80、100和120 mg/mL脱脂乳培养基中,37 ℃厌氧培养24 h,按1.2.3所述方法制备多糖并称重。④接种量对多糖产量的影响:将L.rhamnosusB6种子液分别以1%、3%、5%、7%和9%(体积分数)接种量无菌接入100 mg/mL脱脂乳培养基中,37 ℃厌氧培养24 h,按1.2.3所述方法制备多糖并称重。
1.2.7 产糖条件的响应面优化 ①响应面实验的设计:在单因素实验的基础上,针对4个影响EPS合成的主要因素:发酵时间(A)、发酵温度(B)、脱脂乳浓度(C)和接种量(D),采用Box-Behnken法进行响应面实验的设计。每个因素取3个水平(表1),分别用-1、0、1表示,形成4因素3水平的响应面分析。以多糖含量为响应值,A、B、C和D为自变量,利用统计软件Design Expert 8.0对试验数据进行二次多项回归拟合,建立二次响应面回归模型,最后求得最优影响因子水平组合。②验证实验:将L.rhamnosusB6分别在优化条件和未优化条件(1.2.5所述条件)下发酵,按1.2.3所述方法制备多糖、称重,并与预测值比较。③数据处理:采用Design Expert 8.0.6 软件进行响应面设计、数据分析及回归模型建立,运用Origin Pro 2016、Excel 2013 进行图像制作。

表1 响应面设计的因素、水平和代码
2 结果与分析
2.1 菌种的筛选与鉴定
将不同菌株的种子液按3%(体积分数)接种量无菌接种于100 mg/mL脱脂乳,静置发酵24 h,所得发酵乳的黏度和多糖含量如图1所示。L.rhamnosusB6发酵乳的黏度和多糖含量最高,为0.215 Pa·s和261 mg/L,S.thermophilesTA-40(0.174 Pa·s、224 mg/L)、ST-21(0.136 Pa·s、195 mg/L)发酵乳次之,而L.bulgaricusLB340、HM发酵乳因多糖含量过低而无法测得黏度值。S.thermophiles和L.bulgaricus产糖性能的巨大反差与各自的发酵特性有关。S.thermophiles和L.bulgaricus是酸奶发酵的传统乳酸菌株,前者可通过发酵产EPS增加酸奶的黏度,后者则是乳酸产生与积累的主要贡献者[14]。在筛选过程中L.rhamnosusB6表现出更优于S.thermophiles的产糖性能,因此值得进一步研究。
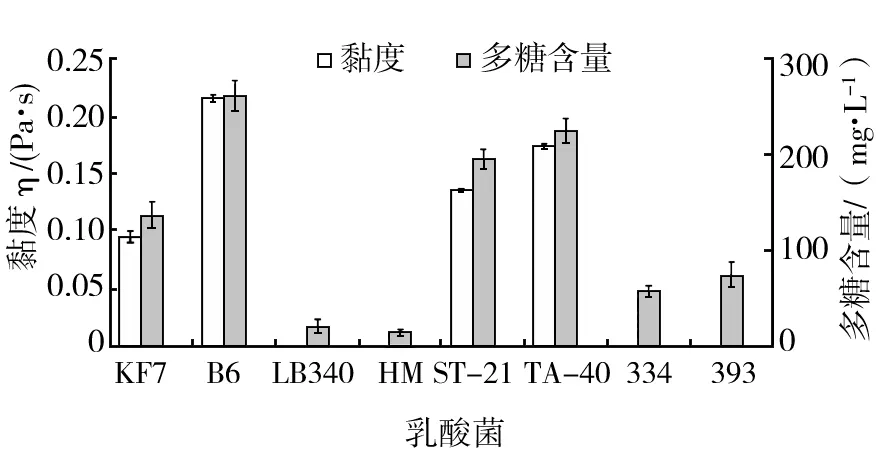
图1 不同发酵乳的多糖含量与黏度比较
EPS高产菌株B6的生理生化实验结果见表2,其结果结合16S rDNA序列(未列出)显示B6为1株L.rhamnosus,现保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),编号为CGMCC No.13310。
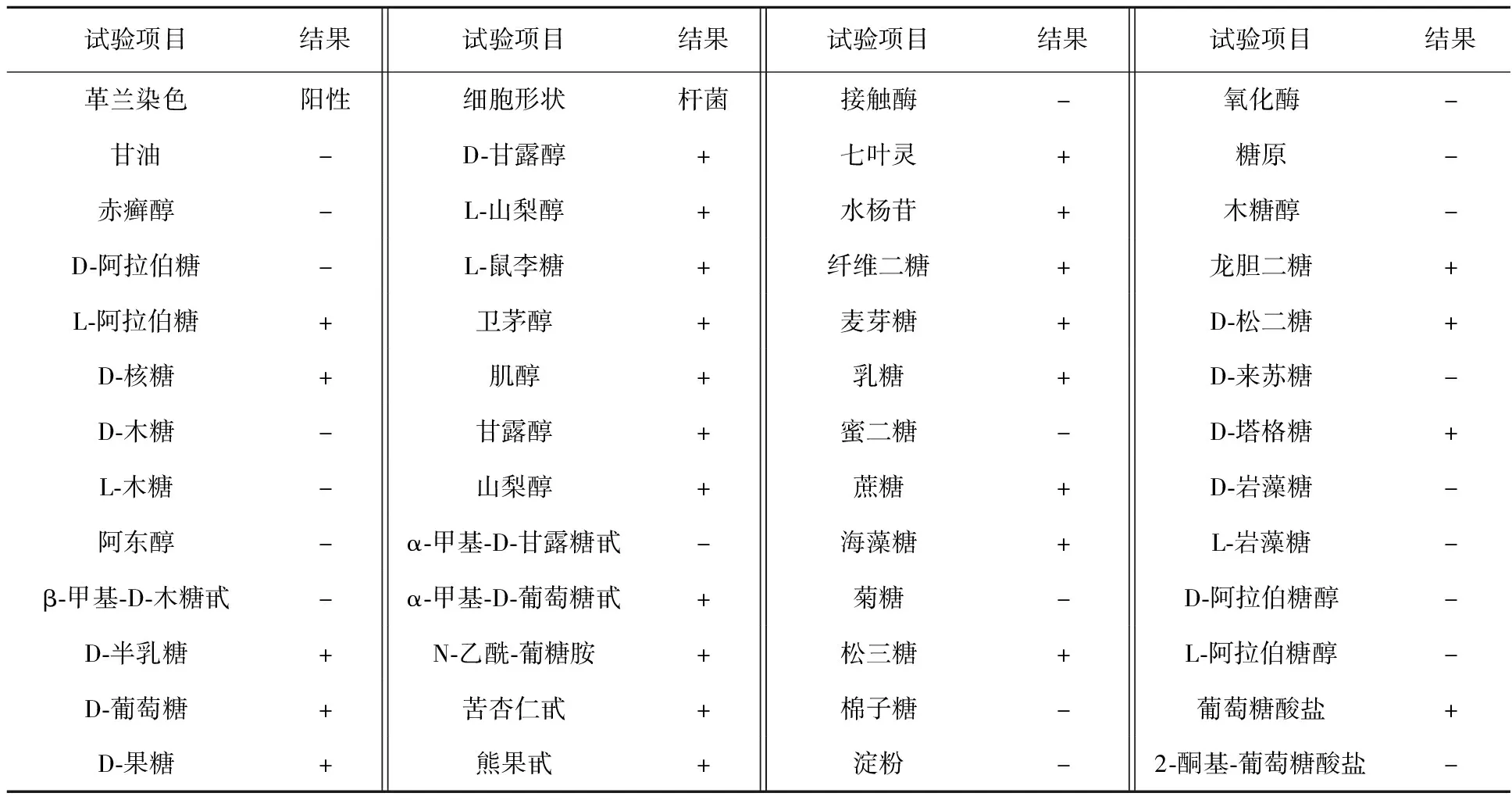
表2 L.rhamnosus B6的生理生化特性
2.2 产糖条件的单因素实验
2.2.1 发酵时间对多糖产量的影响 将L.rhamnosusB6种子液以3%(体积分数)接种量无菌接入100 mg/mL脱脂乳培养基中,37 ℃厌氧培养,测定不同时间获得的发酵乳中的多糖含量,结果如图2A所示。在发酵初期,L.rhamnosusB6 EPS的产量随着发酵时间的延长而增加,其中发酵12~24 h的发酵乳中EPS的积累速率最快(137 mg/L),产率最高(11.4 mg/L/h),这是因为通过12 h的增殖作用后,脱脂乳体系内的L.rhamnosusB6菌体达到较高水平,大量高活力菌体利用碳源充足的环境优势,完成了短时、高速合成特定产物(EPS)的代谢作用。当发酵36 h时,EPS产量达到峰值(308 mg/L)。进一步延长发酵时间后发现,发酵乳中EPS含量依次降低,分别为295 mg/L(48 h)和277 mg/L(60 h)。对于这种现象可能的解释有两种:一是乳酸菌发酵过程中积累的有机酸对EPS产生的降解作用;二是菌体为应对发酵后期碳源匮乏的生境而降解EPS。鉴于EPS产量最大值出现在36 h,因此选取该时间点作为最适发酵时间。
2.2.2 发酵温度对多糖产量的影响 将L.rhamnosusB6种子液以3%(体积分数)接种量无菌接入100 mg/mL脱脂乳培养基中,分别于不同温度(31、34、37、40和43 ℃)下厌氧培养24 h,各发酵乳中多糖含量如图2B所示。以31 ℃为起点,L.rhamnosusB6发酵乳的EPS含量随着发酵温度的升高而增加,40 ℃时达到最高值(296 mg/mL),该现象说明40 ℃有利于L.rhamnosusB6代谢合成与积累EPS,大部分鼠李糖乳杆菌在40 ℃左右均具备一定的代谢活性(降解亚硝酸盐[15]、降血糖[16]等),因此40 ℃为L.rhamnosusB6的优选发酵温度。
2.2.3 脱脂乳浓度对多糖产量的影响 将L.rhamnosusB6种子液以3%(体积分数)接种量无菌接入含40、60、80、100和120 mg/mL脱脂乳培养基中,37 ℃厌氧培养24 h,经测定不同脱脂乳浓度的发酵乳中多糖含量分别为156、231、288、261和254 mg/L(图2C)。多糖产量的差异可能与培养基中养分和EPS合成底物的浓度以及渗透压有关。当脱脂乳浓度较低时,培养基中可用于细菌增殖的养分以及合成EPS的碳源相对不足,致使EPS产量减少,而高浓度脱脂乳带来的高渗透压直接影响细胞膜的通透性,从而降低菌株正常代谢和EPS产量。由图2C可知,80 mg/mL发酵乳中的EPS含量最高,表明该培养基的营养成分、底物浓度以及渗透压力对L.rhamnosusB6来说最适合,因此80 mg/mL为最适脱脂乳浓度。
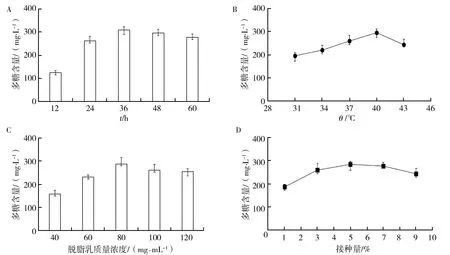
图2 发酵时间(A)、发酵温度(B)、脱脂乳浓度(C)和接种量(D)对多糖产量的影响
2.2.4 接种量对多糖产量的影响 将L.rhamnosusB6种子液以1%、3%、5%、7%和9%(体积分数)接种量无菌接入100 mg/mL脱脂乳培养基中,37 ℃厌氧培养24 h,分析接种量对多糖产量的影响(图2D)。当接种量处于较低水平(1%~3%)时,多糖含量随着接种量的增加而增加(186、261 mg/L),继续增加接种量至5%时,发酵乳中多糖含量达到峰值(286 mg/mL),再进一步加大接种量发现各发酵乳中累积的多糖总量不再增加,表明发酵体系中的部分多糖合成原料被大量菌体消耗,最终导致单位体积内的多糖含量趋于稳定或相对不足。因此选择对多糖积累效果最佳的接种量5%(体积分数)为最适接种量。
2.3 产糖条件的响应面优化
2.3.1 响应面实验 在单因素实验的基础上,本研究进一步选用Box-Behnken响应面法对发酵乳体系中的主要影响因素(发酵时间、发酵温度、脱脂乳浓度和接种量)和评价因素(多糖含量)的相关性及其相互影响进行了系统分析,通过专业统计软件(Design Expert 8.0.6)推算建立二次回归数学模型,从而获得一组模拟的优选发酵条件组合。在Box-Behnken中心组合原理的指导下,共设计分析实验29个,其中析因点24个,中心零点重复实验5个,结果如表3所示。
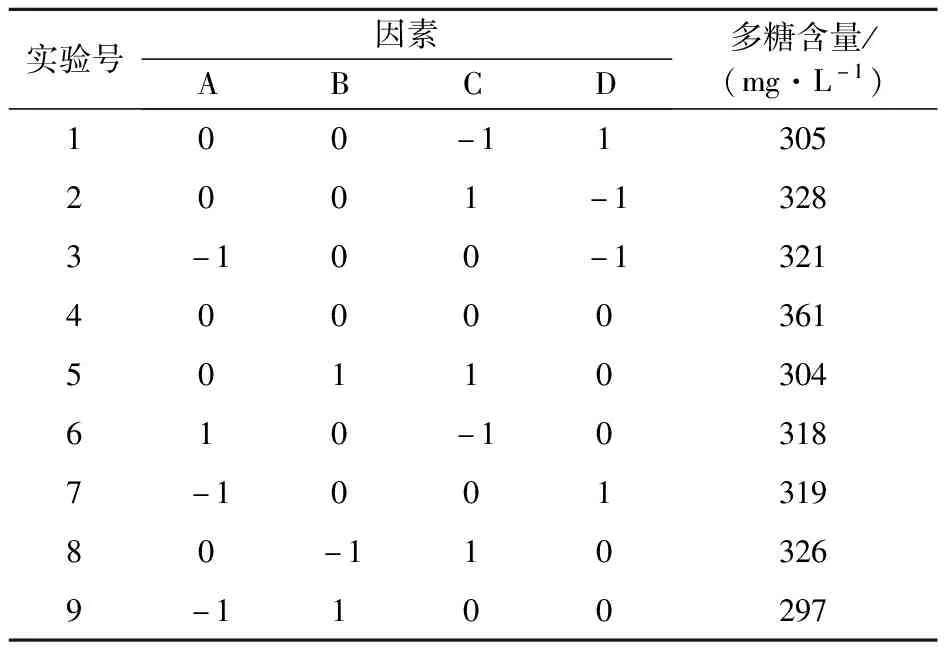
表3 响应面的设计和结果
表3数据经Design Expert 8.0.6分析后获得多元二次响应面回归模型:多糖含量(mg/L)=363+14.687A-9.83B+15.17C+2.33D-2.00AB-0.25AC+3.25AD-14.42A2-29.42B2-33.17C2-14.17D2。对上述回归模型进行方差分析后发现,模型高度显著(P< 0.000 1),且无失拟项因素存在(P=0.353 5>0.05),模型复相关系数的平方R2=0.990 6,表明实验数据间的误差小,拟合程度极高,无需引入更高次的项来提高拟合度,而调整R2=0.981 3显示调整后的模型拟合度依然处于较高水平(表4)。由此可见,该模型可较好地描述L.rhamnosusB6合成多糖过程中各主要因素的影响状况,对其发酵条件的优化具有重要的指导意义。
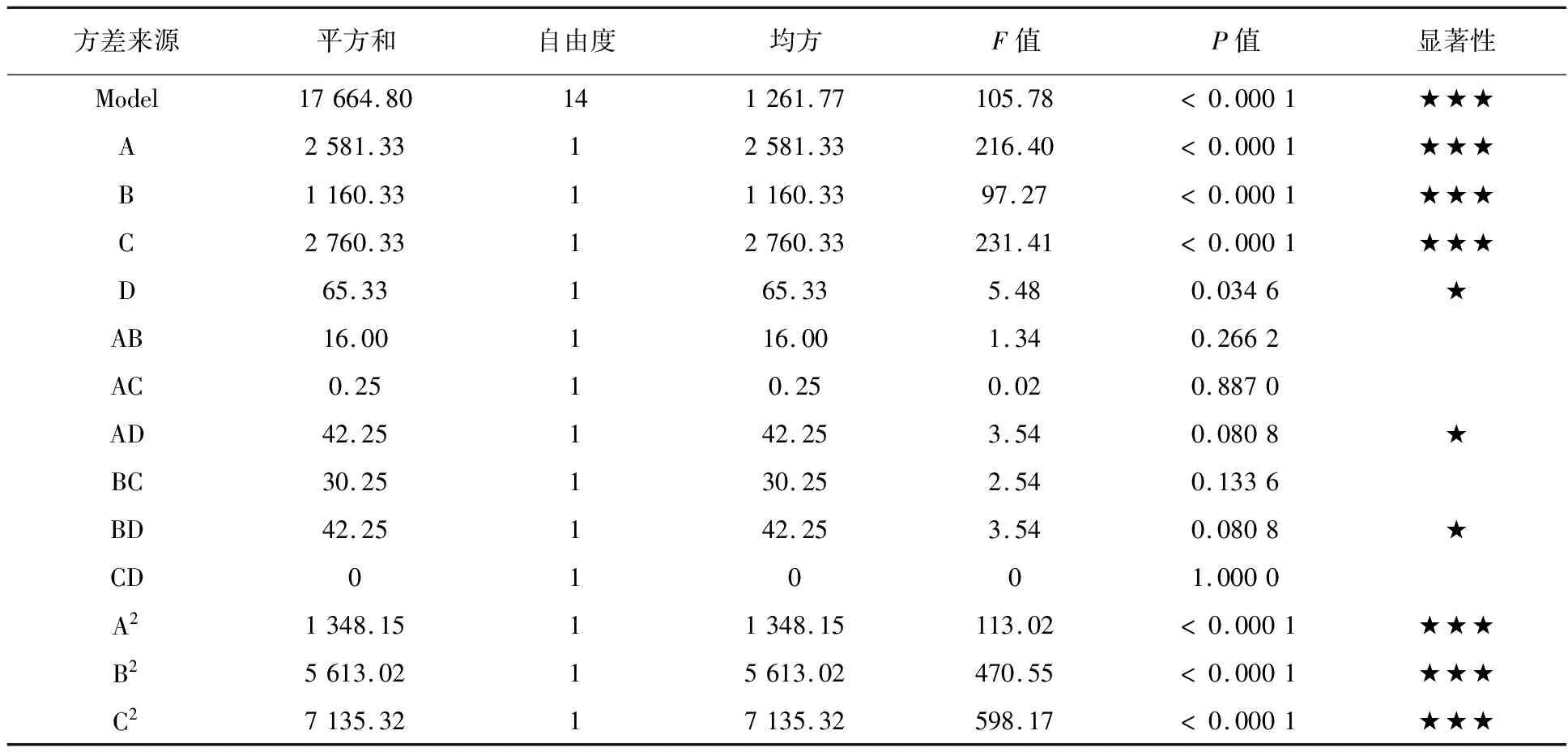
表4 响应面模型的方差分析
各因素间的交互作用对L.rhamnosusB6多糖产量的影响顺序:AD(P=0.080 8)=BD(P=0.080 8)>BC(P=0.133 6)>AB(P=0.266 2)>AC(P=0.887 0)>CD(P=1.000 0),其中部分因素的交互作用(发酵温度和脱脂乳质量浓度、发酵时间和接种量)对多糖产量的影响如图3所示。
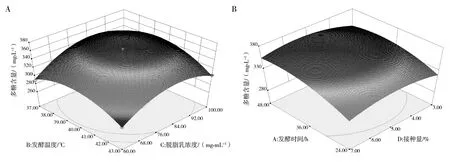
图3 发酵温度和脱脂乳浓度(A)、发酵时间和接种量(B)对多糖含量的交互影响
通过响应面分析软件对二次回归模型进行推算和预测,获得优选的发酵条件组合:发酵时间41.46 h,发酵温度39.11 ℃,脱脂乳质量浓度90.6 mg/mL,接种量4.7%(体积分数),在此条件下,发酵乳中粗多糖含量可达365.6 mg/L。为提高后续实验的可操作性,对优化参数进行取整化处理:发酵时间41 h、发酵温度39 ℃、脱脂乳质量浓度91 mg/mL,接种量5%(体积分数)。
2.3.2 验证实验 为了验证预测参数的可靠性,将L.rhamnosusB6分别于优化条件(发酵时间41 h、发酵温度39 ℃、脱脂乳质量浓度91 mg/mL,接种量5%)和未优化条件(发酵时间24 h、发酵温度37 ℃、脱脂乳质量浓度100 mg/mL、接种量3%)下发酵,按1.2.3所述方法测定发酵终点处各体系中的多糖含量,同时与预测含量进行比较,结果如图4所示。

图4 验证实验的结果
经验证,在优化条件下,L.rhamnosusB6的多糖平均产量为354.5 mg/L,基本与预测值(365.6 mg/L)处于同一水平。与优化前(261 mg/L)相比,优化后的发酵乳中多糖含量显著提高了35.8%。上述数据表明应用响应面法对L.rhamnosusB6发酵产糖条件的优化是有效的。
3 讨 论
自L.rhamnosus被发现以来,以菌株LGG为代表的研究最为广泛。近期有综述总结了该菌株三十年来的研究成果,发现其具备黏附细胞、调节免疫、抗菌、抗氧化、治疗腹泻等多种有益的生物学活性[17]。Tuo等[18]指出4株野生型L.rhamnosusSB5L、J5L、SB31L和1N1L可耐受或存活于模拟胃肠液,拮抗大肠埃希菌、沙门氏菌、志贺氏菌等致病微生物,其活菌、细胞壁和胞内遗传物质(DNA)可诱导人外周血单核细胞分泌促炎细胞因子IL-12、IFN-g和TNF-α。Martin等[19]提出L.rhamnosusCNCM I-3690菌株可通过刺激黏液产量和细胞保护应答保护肠屏障。Hu等[20]指出,摄入L.rhamnosusFLRH93发酵乳可刺激上调肠道中Bcl-2的表达,且下调NLRP3的表达,从而减少炎症因子白介素1-β(IL1-β)和肿瘤坏死因子-α(TNF-α)的产生,进而改善或预防由癌症化疗药物5-氟尿嘧啶(5-FU)引发的肠道损伤。上述研究为鼠李糖乳杆菌在功能型产品领域的应用提供了大量理论依据。
然而,有关L.rhamnosus的报道大多集中在菌体本身或发酵混合物,但对明确的代谢产物(如EPS等大分子代谢产物)的研究相对较少。研究人员通过摸索总结得到多种提高L.rhamnosus多糖产量的方法:调整培养条件[21]、过氧化物刺激[22]、与其他菌株共培养[23]等。Peant等[24]发现4株L.rhamnosus的多糖合成基因簇极为相似,均由长度为185 kb,负责编码17个开放阅读框(Open Reading Frame,ORF)的染色体区域组成。Shao等[13]从L.rhamnosusKF5的发酵乳中分离获得两个多糖组分S1和S2:前者的分子量为1.36×104D,单糖组成为葡萄糖、阿拉伯糖、葡萄糖胺、半乳糖胺和半乳糖,比例为2.03∶1.29∶1.25∶0.72∶0.61;后者的分子量为1.23×106D,单糖组成为鼠李糖、葡萄糖和半乳糖,比例为1.73∶1.47∶1.00。进一步研究发现,这两个组分对脾细胞的体外增殖有显著的刺激作用。L.rhamnosusKL37的多糖可抑制来自T-细胞的免疫应答[25],并积极影响炎症介质的产量[26],从而发挥一定的免疫调节作用。尽管此类报道已覆盖了多糖的产量提高、结构表征、产糖基因以及功能等多个研究领域,但相关研究还缺乏深度,尤其在功能机制和作用机理方面有待进一步发掘,此外,鲜有结构、功能、机理三者一体化、完整化、系统化的L.rhamnosus多糖报道呈现。
本研究首先从筛选EPS高产的LAB菌株入手,筛选到多糖产量显著高于常规乳酸菌的菌株L.rhamnosusB6。其生理生化结合16S rDNA结果显示,该菌株为1株L.rhamnosus,通过单因素实验发现L.rhamnosusB6的最适产糖条件为发酵时间36 h、发酵温度40 ℃、脱脂乳质量浓度80 mg/mL、接种量5%(体积分数),最后利用响应面法分析了各影响因素间的相互作用,结果显示,将L.rhamnosusB6以5%(体积分数)接种量无菌接种于质量浓度为91 mg/mL的脱脂乳中,39 ℃静置发酵41 h后,所得发酵乳中的多糖含量可达354.5 mg/L,产量比优化前提高了35.8%。本研究为L.rhamnosusB6多糖的后续研究提供了研究材料的基本保障,L.rhamnosusB6多糖的结构表征、生物活性及其机制的探索将在此基础上有序开展。

