致病性与无致病性茄科罗尔斯通氏菌转录组测序与分析
周大祥,龙泉洲,李彦杰,邓雪松
(1.重庆三峡学院 生物与食品工程学院,重庆 万州 404120;2.重庆三峡医药高等专科学校 基础医学部,重庆 万州 404120)
茄科罗尔斯通氏菌(Ralstoniasolanacearum)是一种可在全球范围内造成严重危害的重要植物病原细菌,可侵染50多个科的数百种植物,其中对茄科植物的危害最严重,是世界上分布最广、危害最重且最难防治的重大细菌性病害[1]。茄科罗尔斯通氏菌作为一个复杂的群体,生理分化明显,不同寄主来源的菌株在寄主范围、演化型(Phylotype)、生化型和致病力等细菌学特征上有很大差异[2-5]。国内外学者对茄科罗尔斯通氏菌的研究主要从分泌系统[6]、群体感应[7]、毒性基因[8]和致病力分化[9]等方面进行。最近王晓林[10]报道对青枯菌菌株Po82在铜胁迫及侵染过程中的转录组分析,发掘了新的铜抗性相关基因,但利用转录组技术全面挖掘茄科罗尔斯通氏菌致病相关基因,对其通过哪些信号通路响应致病过程还未见报道。本研究首先从染病番茄中分离出致病性和无致病性茄科罗尔斯通氏菌,进行转录组测序,通过基因差异表达、COG、GO和KEGG等分析方法,挖掘茄科罗尔斯通氏菌在不同致病力条件下的转录本差异,以期加深对茄科罗尔斯通氏菌在不同致病力条件下基因表达的理解,为进一步深入研究茄科罗尔斯通氏菌致病分子机理提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 致病性茄科罗尔斯通氏菌(Ralstoniasolanacearum)(RS+)和无致病性茄科罗尔斯通氏菌(RS-)从番茄植株上分离,由西南大学植物保护学院马贯华鉴定并馈赠。菌株在常温下保存于灭菌蒸馏水中。
1.1.2 培养基(g/L) ①NB培养基:牛肉浸膏3,酵母浸膏1,蛋白胨5,葡萄糖10,蒸馏水加至1 000 mL,pH值6.8~7.0。②TTC培养基:蛋白胨10,酸水解酪蛋白1,葡萄糖5,琼脂18,蒸馏水加至1 000 mL,pH 7.0,灭菌放凉后加经过滤灭菌浓度为1%的TTC(2,3,5-三苯基氯化四氮唑)5 mL。
1.1.3 主要试剂与仪器 SV Total RNA Isolation System细菌总RNA提取试剂盒(美国Promega);PrimerScript RT reagent Kit with gDNA Eraser反转录试剂盒(日本Takara);SYBR Premix Ex Tax II荧光定量PCR试剂盒(日本Takara);TTC(2,3,5-三苯基氯化四氮唑)(北京鼎国)。常规PCR仪(C1000,美国BIO-RAD);Quantitative Real-Time PCR仪(CFX96,美国BIO-RAD);分光光度计(Nanodrop-2000,美国Thermo);光照培养箱(MGC-250BP-2,上海一恒);核酸电泳仪机(164-5050,美国BIO-RAD);凝胶成像系统(Versadoc1000,美国BIO-RAD);温控摇床(MaxQ4000,美国Thermo);超纯水仪(IQ7000,美国Milli-Q)。
1.2 方法
1.2.1 测序样品的制备及测序 将致病性与无致病性番茄茄科罗尔斯通氏菌进行TTC平板培养鉴定,注茎接种法接种番茄进一步鉴定致病性。取致病性与无致病性茄科罗尔斯通氏菌分别接种于20 mL NB培养基中,摇床培养(28 ℃,250 r/min)至A600约为0.8(以NB培养基为对照),得到活菌悬液。取两种茄科罗尔斯通氏菌悬液各1 mL,10 000 r/min离心30 s,弃上清,再用1 mL NA液体培养基重悬。参照SV Total RNA Isolation System(Promega)试剂盒方法提取细菌总RNA,Nanodrop-2000分光光度计检测样品总RNAOD260/280在1.8~2.2之间,电泳检测样品总RNA无明显降解且23S条带亮度高于16S条带1.5倍以上,合格的总RNA可以用于转录组测序。
1.2.2 转录组数据分析 两株菌的mRNA富集及转录组测序委托上海国家人类基因组南方研究中心,在Illumina HiseqTM2500中进行双向测序。参考基因组的转录组数据分析,首先对raw reads进行质控和过滤,以参考基因组(茄科罗尔斯通氏菌GMI1000(序列号:AL646053.1))为参考序列,将clean reads 映射到参考基因组的编码序列上,再利用Trinity软件通过序列重叠方法得到重叠群(Contigs),进一步组装成转录本(Transcripts),最后利用Tgicl软件进行聚类去冗余得到Unigene。BIAST分别对Unigene进行差异基因表达、COG、GO、KEGG等数据分析。基于泊松分布法(PossionDis)作差异表达基因分析,筛选标准为对比组样品间表达倍数(fold change)≥2和错误发现率(false discover rate,FDR)<0.001;对差异表达基因作GO 和 KEGG功能分类及富集分析,功能和通路显著富集筛选标准均为FDR≤0.01。
1.2.3 转录组qRT-PCR验证 选取转录组数据中4个差异表达基因,通过PrimerQuest Tool在线程序设计引物。以gyrB基因作内参(表1),采用PrimerScript RT reagent Kit with gDNA Eraser(Takara)试剂盒进行反转录,SYBR Premix Ex Tax II(Takara)试剂盒进行qRT-PCR扩增,扩增平台为CFX96 Real-Time PCR System(BIO-RAD,USA)。PCR反应程序:95 ℃预变性30 s;95 ℃ 15 s,60 ℃ 30 s,40个循环。基因相对表达量的计算采用公式:F=2-△△Ct,其中△△Ct =(致病性茄科罗尔斯通氏菌的目的基因的Ct值-致病性茄科罗尔斯通氏菌的内参基因的Ct值)-(无致病性茄科罗尔斯通氏菌的目的基因的Ct值-无致病性茄科罗尔斯通氏菌的内参基因的Ct值)。

表1 qRT-PCR选用基因及其引物
2 结果与分析
2.1 转录组测序质量评估
测序质量评估报告显示,测序数据质量合格,满足后续分析要求(表2)。碱基质量分布、GC含量分布、碱基质量混合分布、测序饱和度和均一化分布数据合格,可以用于后续转录组分析。clean reads经组装后得到5 111条Contigs,其中大多数Contigs的长度在200~2 499 bp之间,显示测序数据组装质量较好。

表2 测序质量控制统计信息
2.2 Contigs的COG功能分类
图1显示,将注释到COG数据库的3 336条Contigs进行蛋白直系同源分类,得到24个功能类别,分别与代谢、转录、翻译、细胞运动与分泌以及信号转导机制等相关。其中表达数目最多的基因类别是未知功能,其次分别是一般功能预测、氨基酸转运与代谢、转录和能量的产生与转化等。
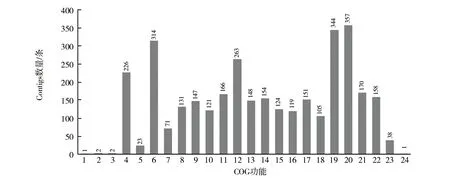
图1 Contigs的COG功能分类
2.3 Contigs的GO功能分类
GO功能分类将Contigs分为分子功能(molecular function)、细胞组分(cellular component)和生物过程(biological process)。图2显示,生物过程中的代谢过程、细胞过程、定位、定位建立、生物调控和刺激应答等是茄科罗尔斯通氏菌Contigs最多的种类;细胞组分中的细胞、细胞部件、高分子配合物、细胞器和细胞器组分等是Contigs富集较多的种类;生物过程中的催化活性、结合剂活性、转运因子活性、转录调节活性、结构分子活性和电荷载体活性等是Contigs富集最多的种类。通过GO分析表明,代谢过程、细胞过程、定位、刺激应答、细胞、细胞部件、催化活性和结合剂活性等途径中的Contigs可能共同参与茄科罗尔斯通氏菌对植物的侵染过程。
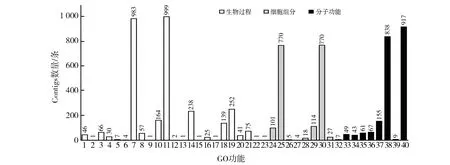
图2 Contigs的GO功能分类
2.4 Contigs的KEGG功能分类
KEGG数据库将Contigs分为代谢(metabolism)、遗传信息处理(genetic information processing)、环境信息处理(environmental information processing)、细胞过程(cellular processes)和生物体系统(organismal systems)。通过KEGG代谢通路分析发现,共有2 672个基因注释到27个信号通路中。其中,注释到代谢的最多,为2 023个,占全部注释基因的75.71%。其次为注释到环境信息处理的膜转运和信号转导的基因较多,分别为169和150个。这些代谢通路中的氨基酸代谢、膜转运、细胞运动和翻译等可能在茄科罗尔斯通氏菌对寄主致病过程中发挥着重要作用(图3)。
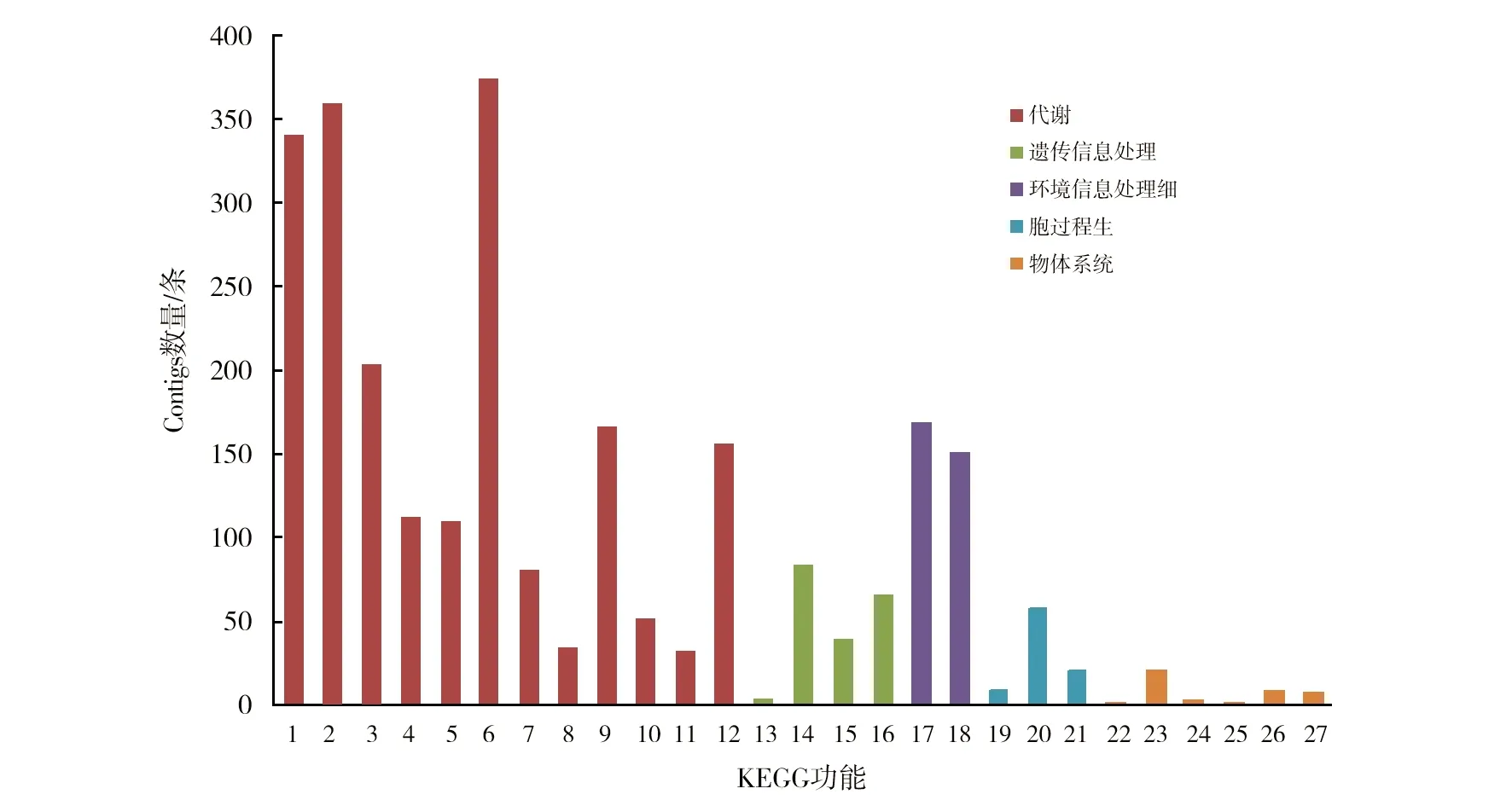
图3 Contigs的KEGG功能分类
2.5 差异表达基因分析
表3显示,与无致病性茄科罗尔斯通氏菌(RS-)相比,致病性茄科罗尔斯通氏菌(RS+)共发现779条差异表达基因,差异表达基因数量偏少,可能与转录组样品为相同菌株不同致病性有关。其中上调表达376条,占全部差异表达基因的48.27%,下调表达403条,占全部差异表达基因的51.73%。上调表达差异倍数范围为1.00~7.45,差异倍数均值为1.89,下调表达差异倍数范围为1.00~6.71,差异倍数均值为2.41。上调表达基因长度范围为141~4 500 bp,平均长度为1 003 bp,下调表达基因长度范围为120~9 969 bp,平均长度为1 104 bp。

表3 差异表达基因的数量及表达变化范围
2.6 DEGs的GO富集分析
为进一步认识差异表达基因的功能,在GO功能分类基础上进行GO富集分析。图4所示,有1 068个基因注释到GO富集分析中的差异表达基因。其中,上调表达的差异基因按照富集程度排序,分子功能中的催化活性、结合剂活性、转运因子活性和电荷载体活性等是茄科罗尔斯通氏菌致病时差异表达基因富集最多的种类;细胞组分中的细胞、细胞部件、细胞间区域、高分子配合物和细胞器等是差异表达基因富集较多的种类;生物过程中的代谢过程、细胞过程、定位、定位建立、生物调控和刺激应答等是差异表达基因富集最多的种类。下调表达的差异基因按照富集程度排序,分子功能中的催化活性、结合剂活性、分子感应器活性、转运因子活性和转录调节活性等是差异表达基因富集最多的种类;细胞组分中的细胞、细胞部件和细胞器等是差异表达基因富集较多的种类;生物过程中的细胞过程、运动、代谢过程、刺激应答、生物调控和定位等是差异表达基因富集最多的种类。通过GO富集分析表明,青枯侵染植物时,代谢过程、调节过程、刺激应答、细胞及组分和定位等途径中的差异表达基因可能共同参与对植物的致病响应。
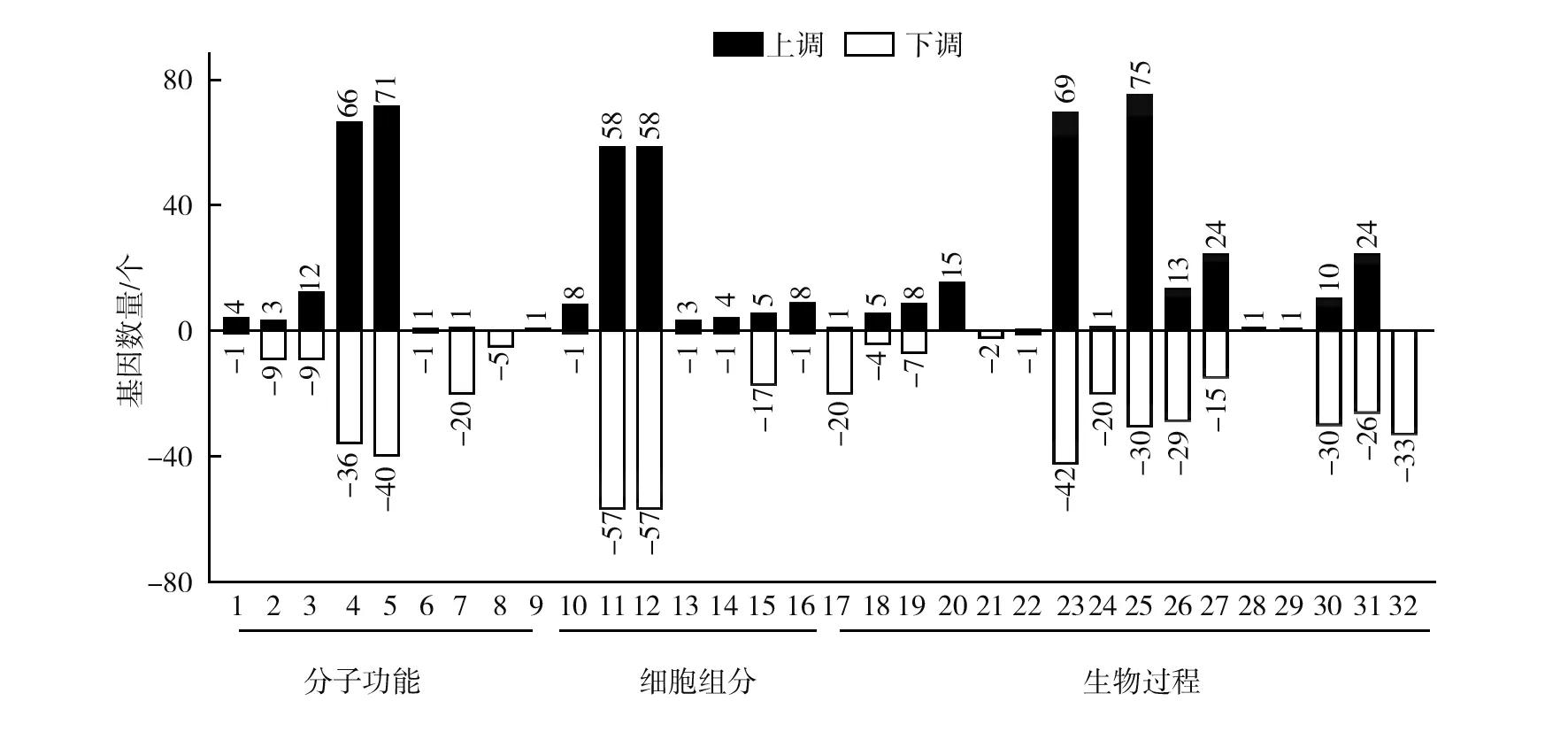
图4 DEGs的GO功能分类
2.7 DEGs的KEGG代谢通路分析
图5显示,有425个基因注释到信号通路中的差异表达基因,共富集到23个KEGG二级pathway参与茄科罗尔斯通氏菌致病性响应。根据富集程度从大到小排列,前四个KEGG富集的显著信号通路见表4,其中,富集程度用Q值表示,Q值是由P值经过FDR校正后的值,越小表示富集程度越显著。Q值小于0.05的显著富集的二级通路分别为细胞运动(cell motility)、膜转运(Membrane transport)、信号转导(signal transduction)和氨基酸代谢(amino acid metabolism),进一步可将其显著富集到20个三级子代谢通路中(表4)。富集结果表明,茄科罗尔斯通氏菌对寄主的响应由众多信号通路共同参与,其作用方式可能包括增强细菌趋化性、强化鞭毛组装能力、提高细菌分泌系统、上调双组分信号转导系统、调整MAPK信号通路和增强氨基酸代谢等。
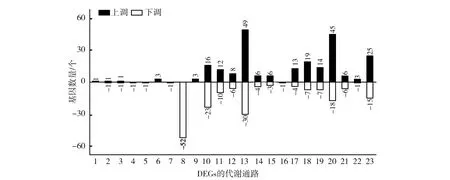
图5 DEGs的KEGG代谢通路
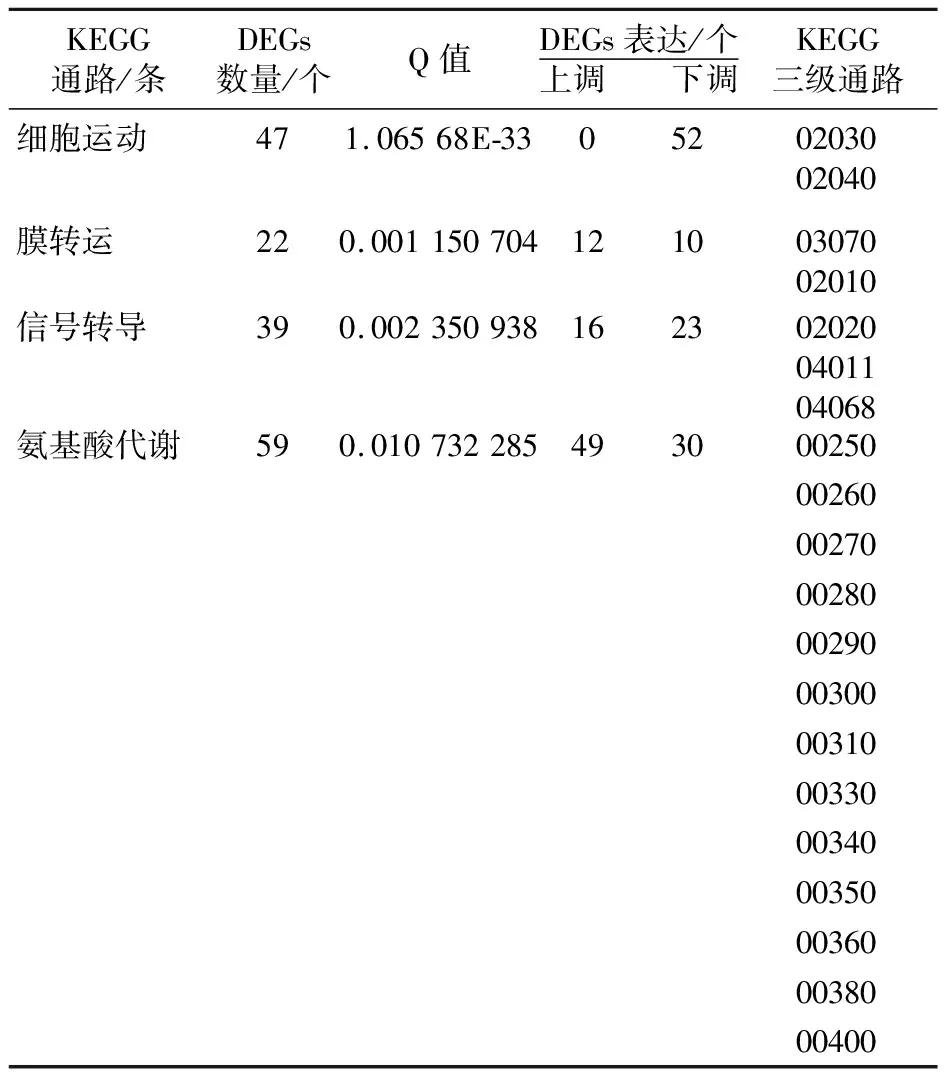
表4 KEGG富集的显著信号通路
2.8 茄科罗尔斯通氏菌Ⅲ型分泌系统基因表达差异分析
通过分泌系统细菌将毒力蛋白转运至胞外,与寄主细胞发生相互作用而产生毒性。目前为止,发现在革兰阴性病原菌中至少存在7种不同类型的分泌系统(Ⅰ~Ⅶ型分泌系统)。转录组测序发现,茄科罗尔斯通氏菌Ⅲ型分泌系统的hrp基因簇中的23个基因,有16个在致病性茄科罗尔斯通氏菌中上调表达。在茄科罗尔斯通氏菌中已经注释和假定的78个Ⅲ型分泌系统效应子中,共有68个基因出现差异表达,其中在致病性茄科罗尔斯通氏菌中有59个上调表达,9个下调表达(表5)。
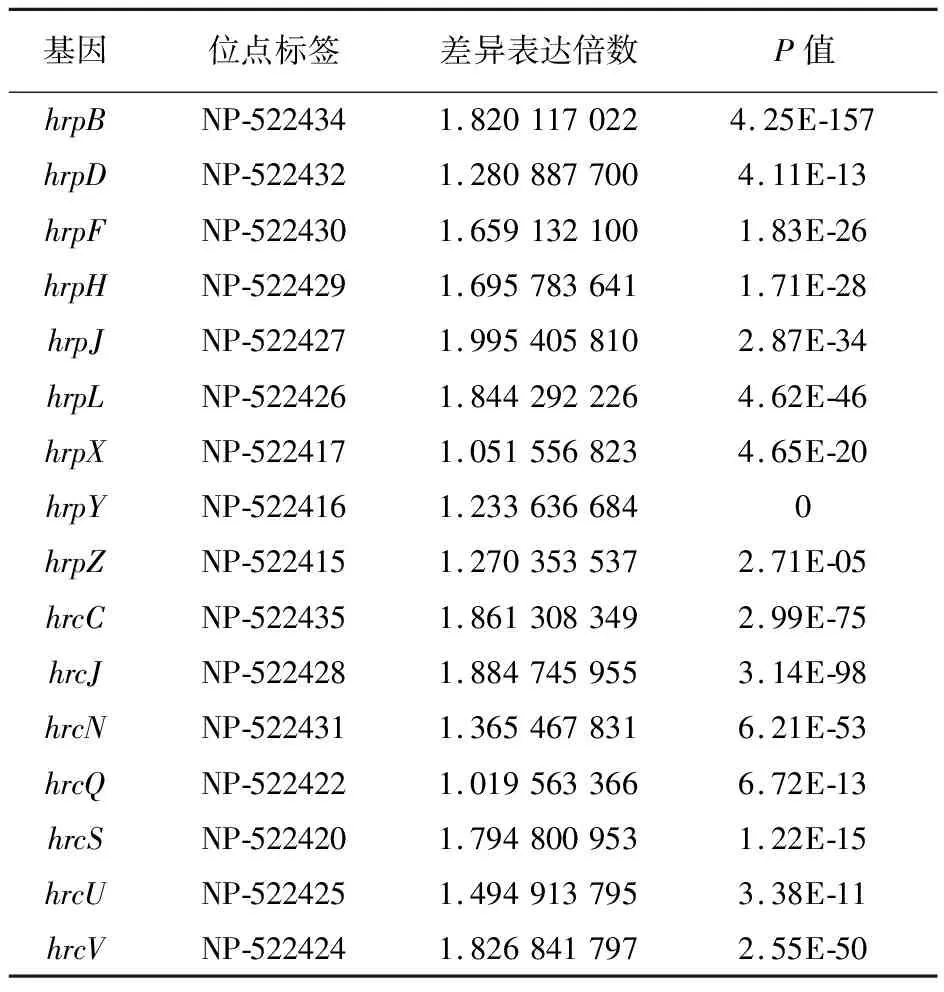
表5 致病性茄科罗尔斯通氏菌表达上调T3SS分泌系统基因簇的相关基因
2.9 qRT-PCR验证结果
随机挑选fliC、hrpB、ripX和hrcU等4个差异表达基因进行qRT-PCR扩增,评估转录组测序结果的可靠性。以log2FC表示基于转录组和qRT-PCR分析的基因表达量变化,其中log2FC=log2[RS+表达量/RS-表达量],设置4次重复。相关性分析结果显示,两种检测方法的皮尔逊相关系数为r=0.883 9,P<0.01(图6),表明基于转录组测序分析差异表达基因的表达结果较为可靠。
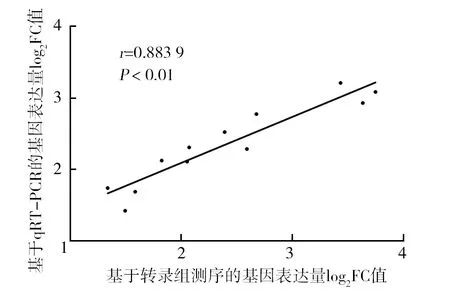
图6 相关差异表达基因的qRT-PCR与RNA-seq结果的相关性分析
3 讨 论
基于高通量、高质量和低成本的基础,Illumina测序技术以其独特的优势已成为越来越多国内外研究者的主要选择[11]。本研究从自然界分离的番茄茄科罗尔斯通氏菌致病性和无致病性菌株出发,通过比较转录组学挖掘出的茄科罗尔斯通氏菌致病基因,对后续探究其致病机理具有非常重要的意义,并为青枯病生防菌的筛选、应用研究提供参考。
转录组分析结果显示,RS-和RS+对比发现779条差异表达基因(DEGs),其中上调表达376条,下调表达403条。差异表达基因的GO富集分析发现,代谢过程、调节过程、刺激应答、细胞及组分和定位等途径中的差异表达基因可能共同参与青枯菌对植物的致病响应。而KEGG分析表明,代谢通路中的氨基酸代谢、膜转运、细胞运动和翻译等可能在茄科罗尔斯通氏菌对寄主致病过程中发挥着重要作用。信号通路富集表明,茄科罗尔斯通氏菌对寄主的响应由众多信号通路共同参与,其作用方式可能包括增强细菌趋化性、强化鞭毛组装能力、提高细菌分泌系统、上调双组分信号转导系统、调整MAPK信号通路和增强氨基酸代谢等。
鞭毛作为植物病原细菌运动的器官,保证了植物病原细菌能够正常运动[12],而植物病原细菌的运动导向与趋化性相关,因此,很多病原细菌的致病性又与细菌的运动性及趋化性有关[13-14]。病原菌在侵染植物时,趋化性具有重要的作用[15]。转录组分析显示,与无致病性茄科罗尔斯通氏菌相比,致病性茄科罗尔斯通氏菌鞭毛组成相关基因都下调表达(motAB-FlhABCDF-flgABCDEFGIJKLMN-fliACDEFGHIJKLMNOPQRST)。而在细菌趋化性,cheABD1D3D4RWZ1等8个基因均下调表达。推测茄科罗尔斯通氏菌的运动性与趋化性降低,影响了病原菌的致病力。
菌毛具有黏附在细胞表面的能力,与植物病原菌的致病性相关,与病原菌运动性无关,失去菌毛,致病力也随之丧失[16]。转录组测序分析发现,PilA、PilE2、RSp1092、RSc2675、RSc2677、RSc2678和RSc2679等菌毛相关基因表达下调,结果与茄科罗尔斯通氏菌致病力丧失一致。
目前为止,发现在革兰阴性病原菌中至少存在6种不同类型的分泌系统(Ⅰ~Ⅵ型分泌系统),这些分泌系统通过分泌或注射的方式释放效应蛋白(效应子),以刺激或干扰寄主细胞的活动,从而能够调控一系列的病原细菌-寄主细胞的相互作用[17]。一系列复杂网络调控茄科罗尔斯通氏菌毒力因子的表达,位于该调控网络的核心是PhcA—LysR家族转录调控因子[18]。XpsR连接PhcA调控esp基因的表达,与VsrC共同激活esp基因的启动子[7,19]。PhcA也调控作为胞外蛋白相关基因的tex基因[20]。转录组测序发现,茄科罗尔斯通氏菌Ⅲ型分泌系统的hrp基因簇中的23个基因,有16个基因在无致病性茄科罗尔斯通氏菌中下调表达(hrpBDFHJKXYZ-hrcCJNQSUV)。在茄科罗尔斯通氏菌中已经注释和假定的78个Ⅲ型分泌系统效应子中,共有68个基因出现差异表达,其中有59个下调表达,9个上调表达。无致病性茄科罗尔斯通氏菌中phcA基因的表达量降低不显著,但xpsR和tek基因表达量显著降低,引起esp基因表达量也显著降低,推测xpsR和tek基因影响茄科罗尔斯通氏菌的致病力。

